DNA疫苗多次重复接种对特异性抗体滴度和亲合力影响
王 静,刘 洋,田向向,曲仕钊,闫冬梅
(1.佳木斯大学基础医学院免疫学教研室,黑龙江 佳木斯 154007;2.郑州大学第一附属医院检验科,河南 郑州 450000;3.佳木斯大学附属第一医院消化内科,黑龙江 佳木斯 154007)
疫苗是控制和消灭传染病主要手段,是现代医学的重要成就之一。然而,受限于对机体免疫防御机制的认识,传统疫苗研发主要依赖实践经验积累。近年来,伴随着基础免疫学和病原生物知识与技术手段的不断拓展,疫苗研发开始摆脱对“经验”的依赖,逐渐向“理性”疫苗设计迈进。
完全实现疫苗的“理性”设计是一项艰巨的科学挑战,原因是影响疫苗潜在因素众多,这些因素包括:宿主的内在因素(如:性别、年龄、定植微生物群以及感染等)[1-2]、环境因素(如:地理位置、季节等)[3-4]、目标病原体因素以及疫苗因素等等。在上述因素中,尤以疫苗因素与疫苗设计的关系最为密切,以往研究显示疫苗的类型、接种剂量以及接种部位均会影响个体对疫苗的免疫应答[5]。此外,疫苗接种次数显而易见的也是影响免疫应答强度和质量的重要因素,然而经过系统地文献回顾我们发现仅有少量研究对该问题进行过正面探讨[6-7]。但是,艾滋病、疟疾以及广谱流感疫苗研发所遭遇的困难提醒我们,传统疫苗研发经验并不完善,亟须对影响疫苗效果的因素进行更深入、更全面的分析。
在本研究中,为了探讨疫苗接种次数与特异性免疫应答,特别是与抗体应答之间的关系,我们利用表达OVA 的 DNA疫苗作为模式疫苗,在重复接种小鼠的过程中在多个时间点采样并检测了OVA特异性抗体应答在重复接种过程中的动态变化。
1 材料与方法
1.1 实验动物c57BL/6小鼠,6~8周龄,16只,雌、雄各8只。购自上海南方模式生物科技股份有限公司,饲养于上海市公共卫生临床中心实验动物中心SPF级动物房。室内安静整洁,温度控制在(22±2)℃,单笼饲养(12 h黑夜/12 h白昼,早上8: 00开灯),食物和水供应充足。
1.2 疫苗及菌株表达OVA的DNA疫苗由本课题组在前期研究中构建完成[8]。用于小鼠接种的OVA DNA疫苗均使用去内毒素质粒抽提试剂盒(Plasmid Giga Kit)制备并溶于无菌PBS中。
1.3 主要试剂及仪器感受态细胞,cat#D0351,碧云天生物技术公司;Plasmid Giga Kit,cat#12191,QiaGEN;高亲和力EIA板,cat#9018,CORNING;OVA抗原,A5503,Sigma; Goat anti-mouse IgG-HRP,cat#115-035-003,Jackson Immuno Research;Goat anti-Mouse IgG1、IgG2b、IgG2c、IgG3,cat#ab97240、ab97250、ab97255、ab97260,Abcam;TMB,cat#NO.MG882,上海迈基生物技术有限公司;DMEM培养基,REF#10-040-CVR,CORNING;胎牛血清(FBS),REF#10091,Gbico;ELISPOT试剂盒,cat#551083,BD;PMA,cat#P8139,sigma;Ionomycin,cat#407953,sigma;OVA/Pep,cat# 04010006545,上海强耀生物科技有限公司;800TS酶标仪,Biotek;水浴锅、MTX-超速离心机、CO2恒温细胞培养箱,Thermo;ELISPOT仪,北京安泰永信医疗科技有限公司。
1.4 疫苗接种与样本采集免疫规划如图1所示,每只小鼠每次肌注接种50 μg OVA DNA疫苗,连续接种8次,每次间隔2周。每次疫苗接种前先通过下颌静脉穿刺采集50 μL外周血,并且在第8次免疫结束后第4周、第6周采集小鼠外周血,于第6周时对小鼠实施安乐死,采集外周血和脾脏细胞进行免疫学检测。

图1 疫苗接种与采样规划
1.5 OVA特异性结合抗体(IgG)及其亚类检测用pH 9.6的碳酸盐包被缓冲液稀释OVA抗原至1 μg/mL,加入高亲和力96孔EIA板中,100 μL/孔,4 ℃包被过夜。1×PBS洗涤3次,每孔加入200 μL封闭液(5%脱脂奶粉,1×PBS),37 ℃孵育1 h。PBST(0.05% Tween20,1×PBS)洗5次,取用稀释液(6%甘油,0.6% Tween20,5%脱脂奶粉,1×PBS)2倍比稀释后的小鼠血清至各个孔中,每个样本做1个复孔,37 ℃孵育1 h。1×PBST洗5次,加入用稀释液5000倍稀释后的HRP标记的山羊抗鼠IgG二抗,每孔100 μL,37 ℃孵育1 h。1×PBST洗5次,加入底物TMB 100 μL,室温避光显色15 min后上机检测,取2次结果的平均值进行统计学分析。小鼠血清中IgG抗体亚类检测时,操作步骤大部分和血清中特异性IgG抗体检测一致,只是加入不同的HRP标记的山羊抗鼠IgG二抗即:IgG1、IgG2b、IgG2C、IgG3二抗。
1.6 小鼠血清抗体亲和力检测用pH 9.6的碳酸盐包被缓冲液稀释OVA抗原至1 μg/mL,50 μL/孔,加入96孔板中,4 ℃包被过夜。1×PBS洗涤3次,加入封闭液,100 μL/孔,37 ℃孵育1 h。1×PBST洗涤5次,加入稀释液100倍稀释后的小鼠待测血清,每个样本做1个复孔,50 μL/孔,37 ℃孵育1 h。1×PBST洗涤5次,加入8 M尿素[9],100 μL/孔,剩余孔中加入PBS作为对照,室温作用15 min。PBST洗2次后,加入HRP标记的山羊抗鼠IgG二抗,50 μL/孔,37 ℃孵育1 h。1×PBST洗涤5次,向96孔板中加入底物TMB 显色,50 μL/孔,室温避光显色15 min后上机检测,取2次结果的平均值进行统计学分析。
1.7 小鼠脾细胞OVA特异性IFN-ϒ分泌量检测通过使用小鼠IFN-γ ELISPOT试剂盒对小鼠脾淋巴细胞中IFN-γ分泌情况进行检测。1×PBS稀释IFN-γ捕获抗体,100 μL/孔,4 ℃过夜。R10洗板一次,200 μL/孔。加入封闭液(R10),200 μL/孔,室温静置2 h。调整细胞浓度至1×105/mL, 50 μL/孔,每个样本做1个复孔。向孔板中加入阴性对照(R10),肽刺激物(OVA/Pep,20 μg/mL),阳性刺激物(PMA,0.5 μg/mL;Ionomycin,0.5 μg/mL)各50 μL,剩余体积用R10补齐,37 ℃孵育24 h。去离子水洗板2次,PBST(PBS+0.05% tween20)洗板3次。加入检测抗体100 μL/孔,室温静置2 h。PBST洗板3次,加入HRP标记的酶,100 μL/孔。室温静置1 h。PBST洗板4次,1×PBS洗板2次。每孔加入100 μL底物,等待斑点显色,显色时间:5~60 min,水冲洗停止显色。室温放置96孔板干透后,上机检测,取2次结果的平均值进行统计学分析。
1.8 统计学分析采用Graphpad Prism 8软件进行数据统计分析与作图。两组间均值的比较采用t检验分析,多组间均值的比较采用单因素方差分析(One-way ANOVA)。以P<0.05判定为组间存在显著性差异。
2 结果
2.1 多次反复免疫接种过程中OVA特异性结合抗体(IgG)滴度的动态检测分析小鼠免疫结束后,我们利用ELISA方法对小鼠血清中的OVA特异性IgG抗体进行了检测。检测结果显示,免疫接种过程中,雌、雄小鼠体内OVA特异性结合抗体滴度变化趋势基本一致:经过三次免疫之后,OVA特异性结合抗体滴度升至1×104,而后续的免疫接种不能使之继续得到提高(图2)。此外,我们也注意到,尽管雌、雄小鼠的总体抗体应答趋势相似,但依然存在一些差异。例如,经过两次免疫之后,雌鼠血清中的平均OVA特异性结合抗体水平已经明显高于基线水平,而雄鼠体内OVA特异性抗体仍然维持在基线水平(图2)。再如,在第8次免疫结束6周后,雌鼠体内OVA特异性抗体滴度仍然维持在1×104倍以上,而雄鼠的抗体滴度则呈现出下降趋势(图2)。
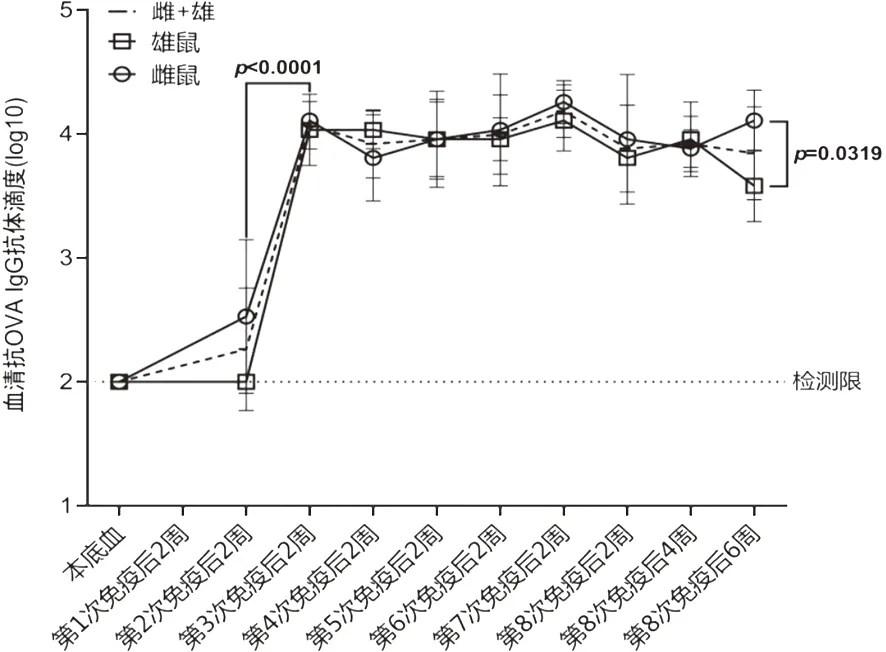
图2 重复免疫接种过程中,小鼠体内OVA特异性抗体滴度的动态检测分析(n=16)
2.2 多次重复免疫接种过程中小鼠体内OVA特异性结合抗体亲合力的动态变化分析利用尿素溶液洗脱法对OVA特异性抗体的亲合力进行了检测分析。结果显示,在1:100稀释度下,高亲合力抗体(8 M尿素洗涤后剩余的结合抗体)(图3A),特别是亲合力指数(8 M尿素洗涤后OD值/8 M尿素洗涤前OD值)(图3B),在第7次接种之前持续维持在较低水平。经过3次免疫接种后,高亲合力抗体水平较基线显著升高(图3A),并在随后的较长时间内维持稳定,直至第7次接种后再次显著升高(图3A)。而在整个接种过程中,亲合力指数的升高只出现在第7次免疫之后(图3B),第3次免疫接种未能提高OVA特异性抗体的亲合力指数。
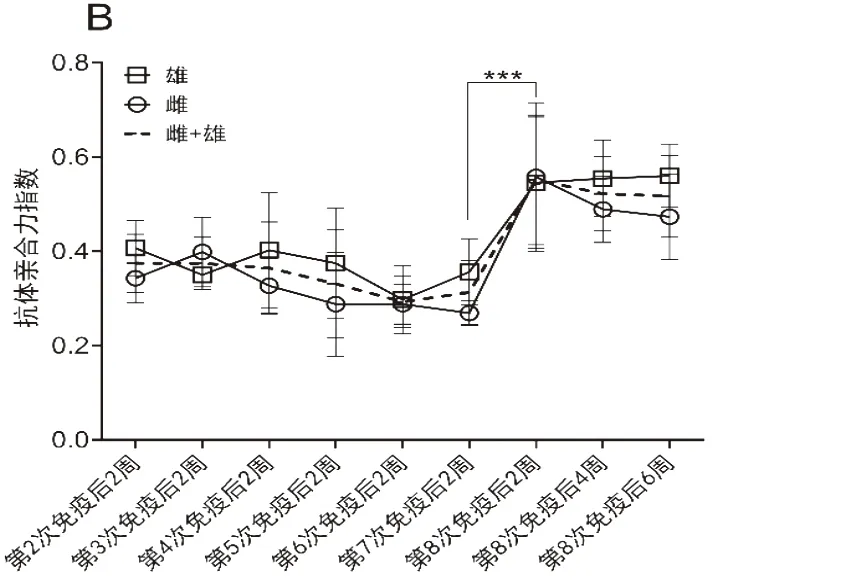
图3 小鼠体内OVA特异性抗体亲合力的动态监测
2.3 重复免疫过程中OVA特异性IgG抗体的亚类构成分析为了监测小鼠体内OVA特异性IgG在反复免疫过程中的亚类转换情况,我们选取第3次、第7次、第8次接种2周后以及第8次接种4周、6周后的血清样本进行了OVA特异性IgG亚类分析。检测结果显示,在免疫接种全程中,OVA特异性IgG的亚类构成维持稳定,并未发生亚类重大的转换。其中IgG2c应答强度最高,IgG2b次之,IgG1再次,而IgG3的应答强度始终最低(图4)。
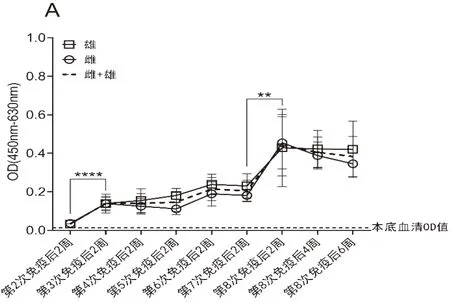
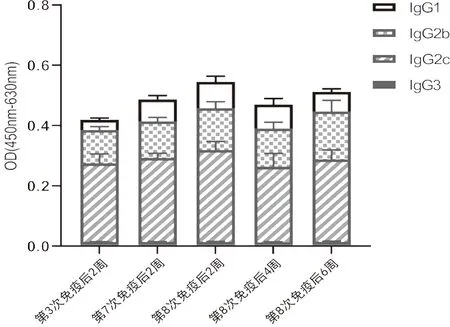
图4 小鼠血清中OVA特异性IgG的亚类构成分析(n=16)
2.4 8次免疫结束后,雌、雄小鼠之间脾细胞IFN-γ分泌量的对比分析在第8次免疫结束后6周,我们对小鼠实施安乐死并采集小鼠脾淋巴细胞进行了OVA特异性IFN-γ 分泌量的检测。IFN-γ ELISPOT检测结果显示,雌鼠脾脏中OVA特异性IFN-γ分泌细胞的频率显著高于雄鼠(图5A),其OVA特异性IFN-γ分泌量(总荧光强度)也显著高于雄鼠(图5B)。

图5 8次免疫结束后,雌、雄小鼠体内OVA特异性IFN-γ分泌量检测
3 讨论
传统疫苗主要通过诱导产生特异性抗体来发挥保护作用[10],抗体水平因而成为评估疫苗效果和优化疫苗设计的重要参考依据。为了优化疫苗的免疫效果,以往研究从疫苗剂量、接种时间安排以及疫苗佐剂等多个方面进行了优化研究[3],然而对疫苗接种次数与抗体应答之间关系的认知目前仍然比较欠缺。在研发艾滋病疫苗和疟疾疫苗的过程中,这一问题的重要性体现的尤为突出,因为按照传统疫苗经验制定的疫苗接种安排不能诱导产生高质量的抗体应答[11]。为了解决这个问题,国外研究团队于近期提出了一种抗原长时间持续递送的疫苗接种方法,并初步证实其有助于促进特异性抗体的亲和力成熟[8,12]。虽然该方法在目前尚不具备实用价值,但是从理论层面证实了持续的抗原刺激有助于诱导产生高质量特异性抗体。与上述研究不同,在本文中我们从实际应用角度出发,利用小鼠模型探讨了通过反复多次疫苗接种来改善抗体应答的可行性。
我们的研究结果显示,经过3次DNA疫苗接种之后,小鼠体内OVA特异性结合抗体(IgG)的滴度显著升高,后续的重复接种不能继续提高小鼠血清中OVA特异性结合抗体的滴度,该现象与以往研究中观察到的抗体应答上限现象一致[13]。值得注意的是,我们发现虽然雌、雄小鼠体内抗体滴度的总体变化趋势一致,但雌鼠趋向于更快地产生抗体应答,并且,在疫苗接种结束后雌鼠体内的抗体水平更稳定。
在测定OVA特异性抗体滴度的同时,我们采用尿素洗涤法测定了OVA特异性抗体的亲合力,发现抗体亲合力的提高显著滞后于抗体滴度的上升,抗体滴度在三次免疫之后显著升高,而抗体亲合力尤其是亲合力指数是在第7次免疫后显著升高。亲合力是反应特异性抗体应答质量的重要指标,我们的研究结果证明了通过间断性的、反复的抗原暴露可以有效提高特异性抗体的亲合力,为疫苗免疫方案制定提供了新依据。为了考察OVA特异性抗体亲合力的升高是否伴随着IgG亚类构成的变化,我们运用ELISA法对小鼠体内OVA特异性IgG的亚类构成进行了检测,结果显示疫苗接种全程中OVA特异性IgG的亚类构成保持稳定。有研究报道显示,在反复接种癌症疫苗的过程中,随着接种次数的增加部分癌症患者体内抗原特异性IgG的亚类构成发生变化[14]。这与我们的实验结果不一致,我们推测宿主种属(人vs小鼠)以及疫苗形式(蛋白亚单位疫苗vs DNA疫苗)的不同可能是导致差异的主要因素,但确切机制有待进一步研究。
除了观察疫苗接种次数对抗体应答的影响,鉴于性别对免疫应答的显著影响[15],在本研究的末尾,我们运用IFN-γ ELISPOT试剂盒对小鼠体内OVA特异性T细胞应答进行了检测。我们发现,尽管雌、雄小鼠抗体应答变化的总体趋势相似,但是疫苗接种结束后(第8次接种后6周)雌鼠体内OVA特异性T细胞应答水平显著高于雄鼠。需要特别指出的是,本课题得出的研究结论均是基于核酸(DNA)疫苗模型得出的,是否适用于其它形式疫苗(如灭活疫苗或蛋白亚单位疫苗)目前尚不清楚;此外,对于特异性抗体在第7次接种后陡升的机制目前也并不清楚。这些问题,我们将在后续研究中逐一解决。
尽管仍然存在未解决的问题,但是通过本研究我们证实了在重复免疫过程中,抗体亲合力成熟显著晚于抗体滴度的上升,说明通过间断的重复免疫接种能够提高特异性抗体的亲合力。这些研究将为今后的疫苗免疫规划设计提供新的理论参考。

