黄秋葵可溶性和不溶性膳食纤维的提取工艺优化
李永平 黄春容 康玉妹 马慧斐 薛珠政 朱海生

摘 要:為优化黄秋葵膳食纤维的提取工艺,以黄秋葵为原料,采用酸解法提取黄秋葵可溶性膳食纤维,以及酶解法提取黄秋葵不溶性膳食纤维,通过单因素试验和正交试验,确定黄秋葵可溶性、不溶性膳食纤维的最佳工艺条件。结果表明:酸解法提取黄秋葵可溶性膳食纤维得率的最主要影响因素为料液比,其次是pH值、提取时间、提取温度,优化最佳提取条件为料液比1∶30 (g/mL)、pH值7.0、提取温度100℃、提取时间100 min,此工艺下黄秋葵中可溶性膳食纤维得率可达13.52%;酶法提取黄秋葵不溶性膳食纤维得率影响较大的影响因素是pH和酶解温度,优化最佳提取条件为温度为60℃、pH 5.0、加酶量为0.7%、酶解时间为60 min。此工艺条件下得率可达37.82%。应用优化条件测试6个黄秋葵品种的可溶性膳食纤维得率均在13%以上,不溶性膳食纤维平均得率为36.15%。该提取优化条件的提取工艺得率较高,可为黄秋葵膳食纤维的提取提供参考。
关键词:黄秋葵;膳食纤维;提取;测定
中图分类号:S 649 文献标志码:A 文章编号:0253-2301(2021)09-0001-07
DOI: 10.13651/j.cnki.fjnykj.2021.09.001
Optimization of Extraction Process of Soluble and Insoluble DietaryFiber from Abelmoschus Esculentus
LI Yong ping HUANG Chun rong KANG Yu mei MA Hui fei XUE Zhu zheng ZHU Hai sheng
(1. Vegetable Laboratory, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350013, China;
2. Crop Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350013, China;
3. Luoyuan County Bureau of Agriculture and Rural Affairs, Fuzhou, Fujian 350699, China)
Abstract: In order to optimize the extraction process of dietary fiber from Abelmoschus esculentus, by using Abelmoschus esculentus as the raw material, the soluble dietary fiber was extracted from Abelmoschus esculentus by acid hydrolysis method and the insoluble dietary fiber was extracted from Abelmoschus esculentus by enzymatic hydrolysis method. The optimum technological conditions of the soluble and insoluble dietary fiber in Abelmoschus esculentus were determined by using the single factor experiment and orthogonal experiment. The results showed that the ratio of solid to liquid was the most important factor affecting the yield of soluble dietary fiber extracted from Abelmoschus esculentus by acid hydrolysis method, followed by the value of pH, extraction time and extraction temperature. The optimal extraction conditions were as follows: the solid liquid ratio 1∶30 (g/mL), pH 7.0 , extraction temperature 100℃, and extraction time 100 min. And the yield of soluble dietary fiber from Abelmoschus esculentus could reach 13.52 % under these conditions. PH and enzymatic hydrolysis temperature were the most influential factors on the yield of insoluble dietary fiber from Abelmoschus esculentus. The optimal extraction conditions were as follows: temperature 60℃, pH 5.0 , enzyme dosage
0.7 % and enzymatic hydrolysis time 60 min. And the yield could reach 37.82 % under these conditions. By using the optimized conditions, the yield of soluble dietary fiber in the six varieties of Abelmoschus esculentus were measured to be above 13%, while the average yield of insoluble dietary fiber was measured to be 36.15 %. The extraction yield of dietary fiber from Abelmoschus esculentus under the optimized conditions was higher, which could provide reference for the extraction of dietary fiber from Abelmoschus esculentus.
Key words: Abelmoschus esculentus; Dietary fiber; Extraction; Determination
随着人们生活水平的提高,饮食结构发生了变化,膳食纤维的摄入量逐渐降低,易引发肥胖、糖尿病、心血管疾病等问题[1] 。因为膳食纤维对于人类健康的重要性,它又被称为“第七大营养素” [2] 。膳食纤维(dietary fiber,DF),是指不能被人类的胃肠道中消化酶所消化和人体吸收利用的植物细胞壁的非α葡 聚糖多糖。它不仅能促进肠胃蠕动,帮助营养代谢吸收,还拥有超强吸水功能和吸附官能团,可将人体多余的营养和有害、有毒的物质排出体外。它分为可溶性膳食纤维(soluble dietary fiber,SDF)与不溶性膳食纤维(Insoluble dietary fiber,IDF)。可溶性膳食纤维在介入人体血液和体液循环过程中清洁血液和各个脏器;不可溶性膳食纤维可加快食物通过胃肠道的速度,减少废弃物在肠道的滞留时间,可预防便秘同时减弱细菌排出的毒素的危害。
黄秋葵AbelmoschusesculcntusL属锦葵科秋葵属。原产于非洲的东部地区,20世纪初由印度引入我国,现在种植面积逐年扩大。黄秋葵果实脆嫩多汁,滑润不腻,风味独特,富含蛋白质、维生素、矿物盐、糖聚合体等各种营养物质,是一种具有较高营养价值、保健功能的新型蔬菜[3-4] ,被誉为“植物伟哥”[5] 。膳食纤维提取方法有粗分离法、膜分离法、生物发酵法、化学法、酶化 学法和酶法等[6] 。酶法可较好的祛除淀粉、蛋白质等物质,保持较好的纤维结构,可制备高纯度的膳食纤维[7] 。秋葵荚中的膳食纤维含量丰富,韦鹭等[8] 应用酸水解提取秋葵可溶性膳食纤维中水溶性膳食纤维的得率为12.65%;王琰等[9] 应用酶重 量法测定秋葵荚中的SDF含量为8.41%,IDF含量为35.08%,其含量远高于一般植物。本研究采用酸解法提取黄秋葵SDF以及酶解法提取黄秋葵IDF,通过单因素试验和正交试验,确定最佳工艺条件以获得较高的得率,为秋葵可溶性膳食纤维、不溶性膳食纤维的提取及生产中的应用提供技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料 黄秋葵品种:绿白1号、绿箭、绿如意、台湾五星、水果秋葵、莆田长秋葵均取于福建省农业科学院作物研究所蔬菜资源库,选取绿白1号花后7 d健康果荚为优化提取工艺的材料,各品种健康的花后7 d果荚作为测定材料。
1.1.2 试验试剂与仪器 α淀 粉酶、中性蛋白酶均购自北京索莱宝科技有限公司,无水乙醇、盐酸、氢氧化钠购于国药集团化学试剂有限公司。台式低速离心机,科大中佳SC3610 高速离心机,DK8D 恒温水浴锅(上海一恒科学仪器有限公司),MP511酸度计(上海三信仪器有限公司),MM400混合冷冻混合球磨仪(德国RETSCH),RV 10 旋轉蒸发仪(德国IKA),DL1 万用电炉,DHG9145A 电热恒温鼓风干燥箱(上海一恒科学仪器有限公司),AR2140电子分析天平(美国Adventurer)。
1.2 酸解法提取黄秋葵SDF工艺优化
1.2.1 黄秋葵SDF的提取流程 选取花后7 d健康新鲜黄秋葵-烘干-粉碎过40目筛,称取5 份,每份1 g干粉,-80℃热水冲洗3~4次-酸水解(按一定料液比、调节pH值,水浴加温)-离心(3000 r·min-1 ,10 min)过滤取滤液-等电点沉淀蛋白(调节pH至4.7,静置10 min)-醇沉(4倍体积乙醇)-过滤-95%乙醇洗涤-烘干-成品[10] 。
1.2.2 黄秋葵SDF提取单因素试验设计 在相同条件(料液比1∶30、pH为7的溶液,80℃水浴100 min)下分别设置提取温度(60℃、70℃、80℃、90℃、100℃)、提取时间(90、100、110、120、130 min)、料液比(g/mL)(1∶20、1∶25、1∶30 、1∶35、1
∶40)、pH值(5.0、6.0、7.0、8.0、9.0)优化黄秋葵SDF的提取条件。
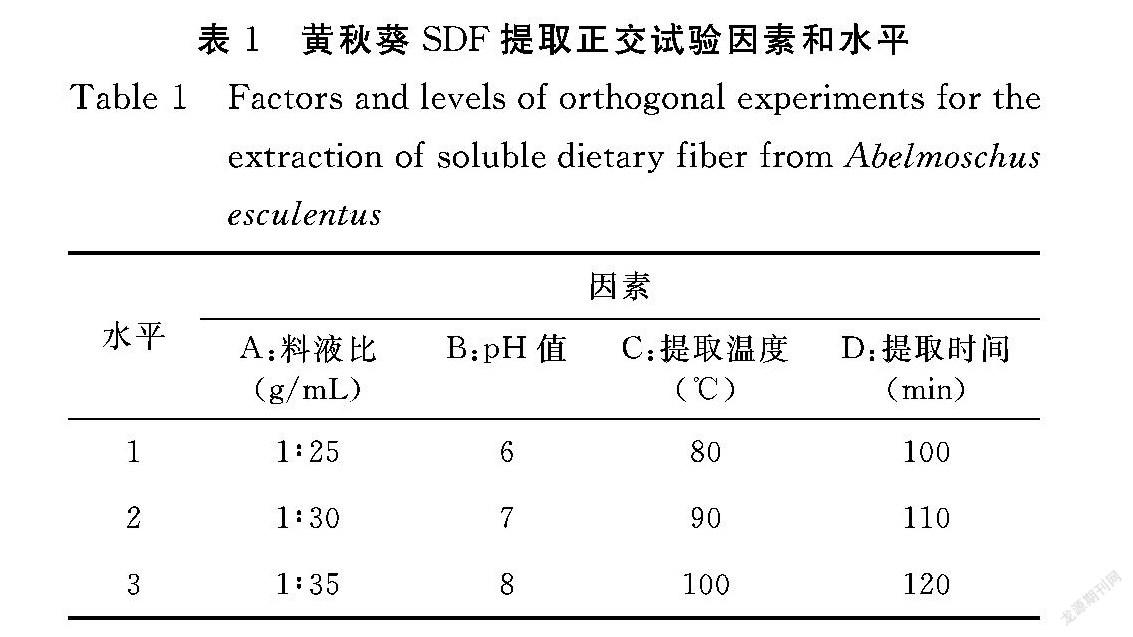
1.2.3 黄秋葵SDF提取正交试验设计 根据单因素试验结果,通过四因素三水平正交试验优化料液比、pH值、提取温度、提取时间,以得到最佳提取工艺,正交试验因素和水平见表1。
1.3 酶解法提取黄秋葵IDF工艺优化
1.3.1 黄秋葵IDF的提取流程 选择花后7 d健康新鲜黄秋葵-烘干-粉碎过筛-冲洗-酸水解-离心取滤渣-酶解(调节pH、α淀粉酶)水浴-灭酶(加入0.3%中性蛋白酶,调节pH 6.5,70℃水浴60 min,煮沸1 min)-离心(5000 r·min-1 ,15 min)-干燥-成品。
1.3.2 黄秋葵IDF提取单因素试验设计 在相同条件下分别设置α淀 粉酶浓度(0.4%、0.5%、0.6%、0.7%、0.8%)、酶解温度(40℃、50℃、60℃、70℃、80℃)、酶解时间(40、60、80、100、120 min)、pH值(4.0、5.0、6.0、7.0、8.0、9.0)对黄秋葵IDF得率的影响。
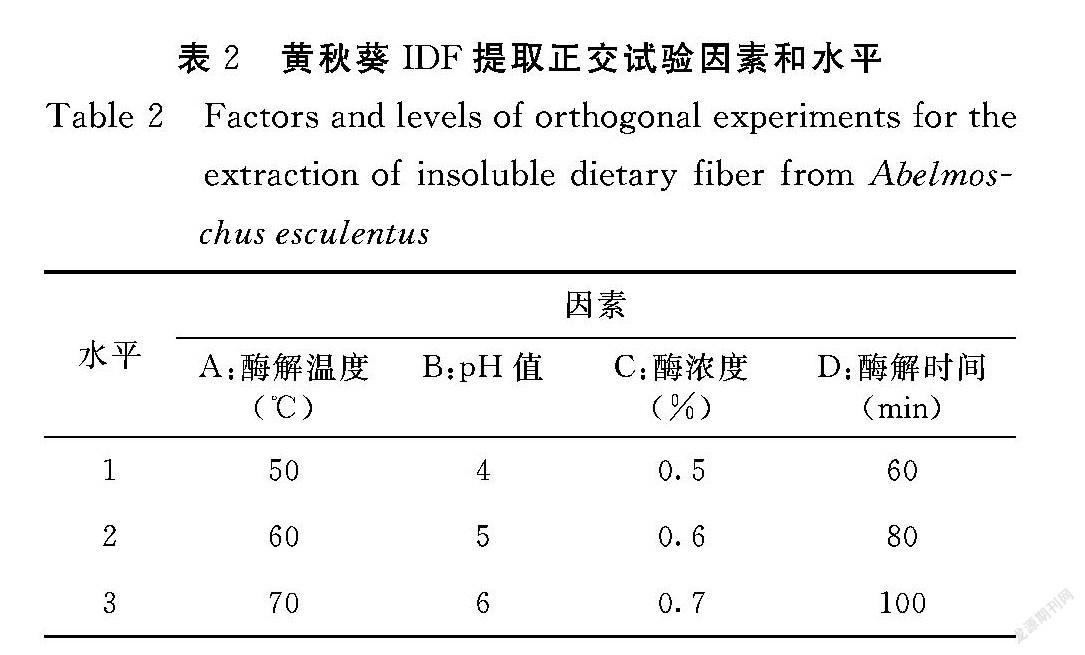
1.3.3 黄秋葵IDF提取正交试验设计 依据黄秋葵IDF单因素试验结果,通过正交试验优化提取工艺。以pH值、α淀 粉酶浓度、中性蛋白酶浓度、酶解温度为评价因素,以IDF的得率为评价指标进行四因素三水平正交试验,正交试验因素和水平见表2。
1.4 测定验证试验
用上述试验优化的提取条件,应用优化的提取工艺,测定绿白1号Lvbaiyihao、绿如意Lvruyi、台湾五星Taiwan five stars、水果秋葵Fruit Abelmoschusesculentus、绿箭Green arrow、莆田长秋葵PutianAbelmoschusesculentus等6个黄秋葵品种可溶性膳食纤维、不溶性膳食纤维,验证方法的可行性。
1.5 数据处理分析与验证
SDF得率=SDF重量/干燥后秋葵的质量×100%
IDF得率=IDF重量/干燥后秋葵的质量×100%
2 结果与分析
2.1 黄秋葵SDF酸解法提取工艺优化
2.1.1 料液比对黄秋葵SDF提取得率的影响 由图1A可知,提取液量加大,有利于黄秋葵SDF溶解,提取率也就提高;而当料液(g/mL)比大于 1∶30 时,SDF已充分溶解并且发生水解,SDF的得率开始下降。由此可知,酸提法料液比为1∶30提取率较高。
2.1.2 pH对黄秋葵SDF提取得率的影响 由图1B可知,SDF的得率呈先上升后下降趋势,峰值出现在 pH 7处。较低pH的溶液分子间氢键的作用力强,果胶分子延展度变强,溶液黏稠度增强,SDF无法充分溶出与分离[11,8] ;pH大于6.0溶液黏度迅速下降[11] ,SDF较易溶解、分离,当pH大于7.0,有部分SDF发生水解,得率有部分损失(图1B)。因此,选择pH为6.0~ 8.0作正交试验水平。
2.1.3 水浴温度对黄秋葵SDF提取得率的影响 由图1C可知,水浴温度为60~ 90℃黄秋葵SDF得率的缓慢增高,高于90℃得率减少,可能由于温度过高有部分SDF的结构发生变化水解引起的(图1C)。故选择80~ 100℃作正交试验水平。
2.1.4 提取时间对黄秋葵提取SDF得率的影响 由图1D可知,水浴时间90~ 110 min时SDF的得率逐渐上升,随后下降,可能由于长时间提取物发生水解,导致提取率下降。因此水浴时间为 110 min较合适。
2.1.5 黄秋葵SDF提取正交试验结果 由表3可知,黄秋葵中水溶性膳食纤维得率的最主要的因素为料液比,其次是pH值、提取时间、提取温度影响,最佳条件为料液比(g/mL)1∶30、pH值7.0、提取温度100℃、提取时间100 min。
2.2 黄秋葵IDF酶解法提取工艺优化
2.2.1 pH值对黄秋葵IDF提取得率的影响 α 淀粉酶的活性与溶液pH值关系密切,pH值4~5时,α淀粉酶活性迅速增强,淀粉的溶解度也增大,IDF的得率快速上升。α淀 粉酶活性在pH值大于6急劇回落(图2A)。因此酶解时最适的pH为5。
2.2.2 加酶量对黄秋葵IDF提取得率的影响 由图2B可看出,IDF的得率在酶浓度0.4%~0.5%缓慢上升,0.5%~0.6%上升速率加快,随后得率下降。
2.2.3 酶解温度对黄秋葵IDF提取得率的影响 由图2C知,不溶性膳食纤维的得率在酶解温度为40~60℃的时候快速上升,60~70℃下降较快,高于70℃变化不大。因此酶解温度60℃左右较为适宜。
2.2.4 酶解时间对黄秋葵IDF提取得率的影响 由图2D知,水浴40~80 min淀粉逐渐水解,80 min淀粉已水酶较充分,因此IDF的得率先缓慢升高,80 min时达到最高。故选择60~100 min作正交试验水平。
2.2.5 黄秋葵IDF提取正交试验结果 从正交试验结果(表4)可知,溶液pH是影响IDF提取率的最主要因素,酶解温度对提取率的影响也较大,淀粉酶浓度的影响最小。酶解法提取IDF的条件优化工艺为:含0.7%α淀 粉酶溶液,pH调至5.0,60℃水浴酶60 min。
2.3 验证试验及含量测定
用上述试验优化的提取条件,测定6个黄秋葵品种可溶性膳食纤维、不溶性膳食纤维结果如表5,6个测试品种的可溶性膳食纤维得率均在13%以上,平均为13.61%;不溶性膳食纤维平均得率为36.15%。
3 结论与讨论
膳食纤维(Dietary Fiber,DF)是一类食物中不能被人体小肠内生物酶水解的碳水化合物[12] 。膳食纤维在人体内有重要生理作用,被作为防治糖尿病、心脑血管病、便秘、癌症、肥胖的必需品[13-15] 。膳食纤维研究已是最活跃的课题之一。提取膳食纤维的方法各有优缺点, 酶法通常与化学法结合使用,此法原料利用率高,产物纯度高,在生产加工中,较为广泛的应用[16] 。韦鹭等[8] 应用酸水解法提取黄秋葵可溶性膳食纤维的得率为12.65%。王琰等[9] 应用酶重量法测试黄秋葵膳食纤维含量,结果SDF含量8.41%,IDF含量为35.08%。本研究应用酸解提取黄秋葵的可溶性纤维,酶解法提取黄秋葵的不溶性纤维。可溶性纤维的得率超过13%,不溶性纤维的得率超过36%,酸解与酶解法联合使用,有利于提高膳食纤维的提取率。
试验通过单因素和正交试验方法优化了黄秋葵膳食纤维提取工艺,酸解法提取可溶性膳食纤维优化条件为料液比(g/mL)1∶30、pH值7.0、提取温度100℃、提取时间100 min。酶法提取黄秋葵IDF的优化条件,酶解溶液pH 5.0,酶浓度0.7%,水浴温度60℃,酶解时长60 min;较韦鹭等[8] 研究得到酸水解法提取秋葵中可溶性膳食纤维的优化工艺条件为料液比(g/mL)1∶15、pH 7.0、提取温度80℃、提取时间110 min,有所不同,可能与试验选择的品种及果实的采收时间有关。不同品种和采收时间的黄秋葵的胶物质及纤维含量不同[17-18] 。胶状物质含量多,需提取液的体积较大才可使原料在溶液中充分溶胀,与提取液较完全的接触,有利于提取出的可溶性膳食纤维。若提取液不足,秋葵中的胶状成分与水结合活化能增大,果胶流动的阻力加大,流动性降低,溶液变得更加黏稠,SDF难分离,造成得率较少[11] 。
参考文献:
[1]董文成.柑橘果实膳食纤维物化特性及其性能表征研究[D]. 杭州:浙江大學,2015.
[2]丁晓波,张华,刘世尧,等.柑橘果品营养学研究现状[J]. 园艺学报,2012,39(9):1687-1702.
[3]卢隆杰,苏浓,岳森.菜药花兼用型植物——黄秋葵[J].蔬菜,2004(10): 36.
[4]单承莺,马世宏,张卫明.保健蔬菜黄秋葵的应用价值与前景[J]. 中国野生植物资源,2012,31(2): 68-71.
[5]王君耀, 周峻, 汤谷平. 黄秋葵抗疲劳作用的研究[J]. 中国现代应用药学, 2003, 20(4): 316-317.
[6]郑建仙,高孔荣.论膳食纤维[J].食品与发酵工业,1994,13 (4): 32-38.
[7]KOROSKENYI B,MCCARTHY S P.Microwave assisted solvent free or aqueous based synthesis of biodegradable polymers[J]. Journal of Polymer and The Environment,2002,10(11):93-104.
[8]韦鹭,谭强,谢文佩.秋葵中水溶性膳食纤维提取工艺研究[J].中国酿造,2016,35(9):141-144.
[9]王琰,王英锋.应用酶-重量法测定秋葵荚中的膳食纤维[J].食品研究与开发,2012,33(4):155-157.
[10]韦琴,黄婉星.胡萝卜膳食纤维提取工艺研究[J].安徽农业科学,2014,42(19):6379-6381.
[11]李加兴,石春诚,马浪,等.黄秋葵果胶理化特性的研究[J].食品科学,2015,36(17):104-108.
[12]ZHANG W J,LI D F,LIU L,et al.The effects of dietary fiber level on nutrient digestibility in growing pigs[J]. Journal of Animal Science and Biotechnology,2013,4(4):309-315.
[13]黄凯丰,杜明凤.膳食纤维研究进展[J].河北农业科学,2009,13(5):53-55.
[14]闵锐,何云海,姚晓敏.膳食纤维研究的现状与展望[J].上海师范大学学报(自然科学版),1998(3):68-75.
[15]权美平,侯云云.膳食纤维的生理保健功能及其提取工艺的研究进展[J].保鲜与加工,2013,13(1):49-51.
[16]孙海燕, 杨梦凡, 郝丹青,等. 膳食纤维的研究现状[J]. 保鲜与加工, 2019, 19 (6) :238-242.
[17]郑云云,郑黄楠,周红玲,等.黄秋葵果荚中多糖的提取及其累积规律[J].福建农业学报,2016,31(1):27-30.
[18]刘剑波.黄秋葵的化学成分及抗氧化活性分析[D].杭州:浙江农林大学,2012.
(责任编辑:柯文辉)

