miR-222在膀胱癌组织中的表达及其对膀胱癌细胞增殖与迁移的影响
孙双权,陈立新,唐春华,李慧,杨谊
上海市松江区中心医院泌尿外科,上海 201600
膀胱癌是人类最常见的恶性肿瘤之一,对患者的生理、心理及社会生活质量均造成了严重的不利影响[1]。约75%的膀胱尿路上皮癌患者表现为非肌层浸润性膀胱癌,25%的患者表现为肌层浸润性膀胱癌。对于非肌层浸润性膀胱癌患者,手术切除术后常规行膀胱灌注治疗,但效果并不理想。临床上迫切需要更为有效的治疗方法来降低非肌层浸润性膀胱癌患者的手术后复发率。目前新的研究方向包括免疫抑制治疗,针对长链非编码RNAs、micro RNAs或肿瘤干细胞的靶向治疗方法等[2]。
微小核糖核酸(MicroRNA)是由19~25个核苷酸组成的非编码的单链RNA,其与肿瘤细胞的增殖、分化、迁移及凋亡密切相关。通过与mRNA的3'UTR结合,miRNA可以导致翻译抑制或mRNA降解。单个miRNA可以靶向多个mRNAs,而单个mRNA的3'UTR也可能包含多个miRNAs的识别信号。microRNA-222(miR-222)属于miR-221/222家族。研究发现,miR-222在膀胱癌组织中的表达水平明显高于相应的癌旁组织,其高表达与肿瘤分级和分期显著相关[3],而且miR-222的过度表达对TaT1期患者的短期复发和进展有较好的阳性预测价值[4],其有可能成为一种膀胱癌早期发现进展或复发的随访标记物,甚至是治疗膀胱癌患者的有用靶点[5]。
CDKN1B基因编码一种细胞周期蛋白依赖激酶抑制剂(p27),与CDK抑制剂CDKN1A/P21具有相似性,其参与了多种肿瘤的发生过程。CALLEGARI等[6]通过免疫印迹分析发现,在鼠肝癌模型中,miR-221的表达上调同时伴随有CDKN1B/p27和CDKN1C/p57表达的显著抑制。在很多人类的癌细胞中,miR221/222可能通过靶向调控CDKN1B的表达,促进癌细胞的增殖,包括胰腺癌、肝癌及非小细胞肺癌[7-9]。本研究定量检测了膀胱尿路上皮癌组织及癌旁组织中miR-222及CDKN1B(p27)的表达差异,观察miR-222对膀胱癌T24细胞增殖、迁移及凋亡的影响,并对miR-222的可能靶点CDKN1B进行了双荧光素酶报告基因检测。
1 材料与方法
1.1 材料
1.1.1 细胞、临床组织样本 人膀胱癌细胞株T24购自上海中科院细胞库;收集2018年1月至2019年6月45例在上海市松江区中心医院确诊并行经尿道膀胱肿瘤电切术的膀胱尿路上皮癌患者的膀胱癌组织标本及配对癌旁组织。本研究通过本院伦理委员会批准,所有患者签署知情同意书,标本采用液氮保存。
1.1.2 仪器及实验试剂 DMEM细胞培养液和胎牛血清、双抗、PBS缓冲液从美国GIBCO公司买入。CDKN1B抗体购自Abcam公司,Lip2000试剂从美国Invitrogen公司购买;MTT检测试剂盒购自南京凯 基,miR-222 inhibitor NC、miR-222 inhibitor和miR-222 mimic均由上海吉玛生物公司合成;高速冷冻离心机购自Sigma公司,紫外分光光度计购自Beckman公司,CFX384多重实时荧光定量PCR仪购自美国Bio-Rad公司。TRIzol®Plus RNA Purification Kit(货号:12183-555)购自Invitrogen公司,RNase-Free DNase Set(货号:79254)购自Qiagen公司,Super-ScriptTMⅢReverse Transcriptase(货号:18080085)购自Thermo fisher公司和PowerUpTMSYBRTMGreen Master Mix(货号:A25779)购自Applied Biosystems公司,引物miR-222和U6均由华大基因合成。
1.2 方法
1.2.1 Real time PCR检测miR-222表达水平 总RNA抽提:取50 mg的样本组织,加1 mL Trizol研磨匀浆,加1/2 Trizol体积的氯仿提取,并用异丙醇或纯酒精沉淀RNA后用DEPC水溶解,用紫外分光光度计定量并检测纯度;PCR扩增:取1μg RNA用Super-ScriptTMⅢReverse Transcriptase反转录试剂盒将RNA反转录成cDNA,用SYBR Green染料法进行扩增检测miR-222的相对表达量。逆转录茎环引物序列miR-222(基因序列号为MIMAT0004569):ATTCGCACTGGATACGACGGTCAG;用Primer Premier 6.0设计PCR引 物,miR-222-F:CGCGCTCAGTAGCCAGTGTA,SNORD48(内参)-F:GATGATGACCCCA-GGTAACTCT,反向通用引物micro-R为:AGTGCAGGGTCCGAGGTATT。反应体系为:在20μL的体系中加Power SYBR®Green Master Mix 10μL,10μmol/L Forward Primer 0.5μL,10μmol/L micro-R 0.5μL,SDW 8μL,CDNA 1.0μL,用DEPC水定容到总体积20μL。反应条件:95℃,1 min,1个循环;95℃,15 s,60℃,25 s,40个循环,收集荧光在60℃处;55℃~95℃绘制溶解曲线。每个样品重复三次,用2-ΔΔct法统计分析基因的相对表达量。
1.2.2 细胞培养、分组及转染膀胱癌T24细胞株 使用DME培养基+10%胎牛血清+1%双抗,于5%CO2、37℃的无菌环境中常规培养。2~3 d换液一次,4~5 d传代一次,将对数生长期细胞接种铺板在6孔板里面,24 h后进行细胞转染。细胞实验分组:control组(空白膀胱癌T24细胞株)、miR-222 inhibitor NC组、miR-222 inhibitor组和miR-222 mimic组,共四组。细胞转染:将miR-222 inhibitor NC、miR-222 inhibitor和miR-222 mimic,按照15 nmol/mL加入到250μL培养液里面,同时取10μL Lip2000加入到250μL培养液里面,静置5 min,前两者混合在一起,miRNA溶液与脂质体混和均匀,室温静置20 min,培养板上的细胞弃去培养基,用磷酸盐缓冲液(PBS,pH=7.4)洗涤细胞1~2次。每孔细胞加500μL miRNA/脂质体混合物,轻轻摇晃混匀后,置于细胞培养箱37℃、5%CO2条件下培养6 h。取出培养板,小心吸去miRNA/脂质体混合物,每孔加500μL新鲜的含血清DMEM培养基,37℃、5%CO2继续培养48 h,收集细胞进行后期检测。
1.2.3 MTT法检测细胞增殖 将上述处理完成的细胞,进行胰酶消化,吹打变成单细胞悬液,按照每空1万个细胞,终体积为100μL,接种到96孔板内,并且设置了空白孔,每组4重复,进行培养1D、2D、3D后,加入20μL MTT(5 mg/mL)溶液,继续孵育4 h,扔掉孔内上清液,加入150μL DMSO,摇床震荡培养直至结晶物溶解完成,酶标仪挑取合成的程序,OD490nm读值,最后用软件制作生长曲线。
1.2.4 细胞迁移实验 将所有细胞培养试剂和Transwell小室置于37℃恒温水浴箱温育。收集对数生长期细胞,消化细胞后用无血清培养基混匀细胞,计数后,调整浓度为每毫升10个细胞。在下室(即24孔板底部)加入600μL含20%血清的培养液。上室加入单细胞悬液150μL,37℃、5%CO2饱和湿度条件下继续培养24 h。实验结束后用镊子小心夹出小室,吸干上室液体,甲醇室温固定30 min。取出小室,吸干上室固定液,结晶紫染液室温染色15~30 min,PBS冲洗多次,用自制脱脂棉棒轻轻吸去上室残留液体,并取掉底膜残留细胞,完成后取出小室,底膜晾干,然后封片,显微镜下拍照并计数随机细胞视野5个,SPSS统计分析。
1.2.5 Annexin V-FITC细胞凋亡实验 收集的细胞用PBS重悬细胞并计数。取1×106万细胞,1 000 r/min离心5 min后丢掉上清液,加入500μL的Annexin V-FITC结合液轻轻混匀细胞,再加入5μL Annexin V-FITC探针,轻轻混匀,25℃,避光孵育10 min。1 000 r/min离心5 min,丢掉上清,加入10μL碘化丙啶染色液,轻轻混匀,冰浴避光放置。流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.2.6 MiR-222与CDKN1B的结合关系测定 采用双荧光素酶报告实验,利用生物信息预测网站(miRbase.org,Targetscan.org)预测miR-222与CDKN1B的结合片段。将扩增的CDKN1B 3'-UTR序列插入到pMIR-Report Luciferase质粒位点当中,分别构建pGL3-CDKN1B-3'UTR WT和pGL3-CDKN1B-3'UTR Mut的荧光素酶报告载体(pMIR-Report Luciferase),将上述荧光素酶报告载体及突变载体与miR-222 NC、miR-222 mimic、miR-222 inhibitor共同转染至T24细胞,Dual Luciferase报告基因试剂盒检测荧光素酶活性,分析miR-222与CDKN1B的结合关系。
1.2.7 Western blot检测蛋白表达 取适量细胞,用冰PBS洗涤3次。取适量的裂解液,在使用前数分钟内加入PMSF,比例为1:100,在冰上裂解20 min。11 000 r/min的速度离心10 min,取上清。测定和调节蛋白浓度,保持每孔的加样量在30μg。将准备好的样品和蛋白质marker(10~180 kD),分别上样电泳直至电泳完全。然后将蛋白从凝胶转至NC膜上,5%脱脂奶粉室温封闭1 h,加入稀释好的一抗抗体,4℃过夜。二抗室温1 h振荡孵育,最后ECL化学发光曝光显色。
1.2.8 免疫组化染色 膀胱癌及癌旁组织固定、脱水、包埋、切片,除去内源性的过氧化氢酶,抗原修复高压锅修复:立即投入柠檬酸缓冲液,等到沸腾,浮子升起,计时2 min,自然冷却至室温;血清封闭、加入稀释好的一抗抗体,4℃过夜。二抗室温1 h振荡孵育。加DAB显色剂,苏木素复染后,封片、显微镜下拍照,数据分析。
1.3 统计学方法 每组实验均安排重复三次,采用SPSS21.0软件进行数据分析,计量资料符合正态分布,以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组比较采用t检验,进一步两两比较采用Dunnet-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-222在膀胱癌和癌旁组织中的表达差异 45例手术后病理证实为膀胱尿路上皮癌的标本经Real time PCR检测结果显示:膀胱癌组织组miR-222基因表达量为2.31±0.27,癌旁组织组miR-222基因表达量为0.92±0.04,膀胱癌组织miR-222基因表达量约为癌旁组织的2.2倍,差异有统计学意义(t=-5.481,P<0.05)。
2.2 MTT法检测细胞增殖 为了研究miR-222对膀胱癌细胞增殖的影响,将miR-222模拟物(miR-222 mimic)、抑制剂(miR-222 inhibitor)及其阴性对照物(miR-222 inhibitor NC)转染T24细胞,从以下生长曲线可以看出,control组与miR-222 inhibitor NC组生长基本持平,差异无统计学意义(P>0.05),但miR-222 inhibitor组和miR-222 mimic组显示出明显的生长差异,miR-222 inhibitor组明显低于其余组,而miR-222 mimic组明显高于miR-222 inhibitor组和其他两组,差异有统计学意义(P<0.05),见图1。
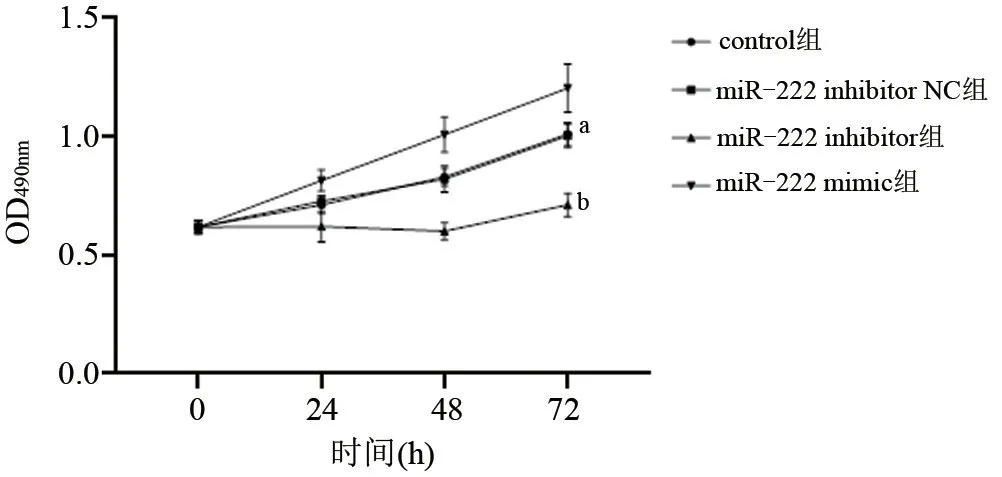
图1 各组T24细胞的生长曲线
2.3 细胞迁移实验结果 细胞迁移实验结果显示,miR-222 mimic组的细胞迁移数量为(220±26)个,明显多于miR-222 inhibitor组的(90±15)个,差异有统计学意义(t=8.263,P<0.01),control组细胞迁移数量多于miR-222 inhibitor组,但是低于miR-222 mimic组,差异有统计学意义(P<0.05),见图2和图3。

图2 不同处理组细胞的迁移数量(×100)

图3 各组T24细胞的迁移数量结果
2.4 Annexin V-FITC细胞凋亡实验结果 流式结果显示,miR-222 mimic组的凋亡率明显低于抑制了miR-222表达的miR-222 inhibitor组,差异有统计学意义(P<0.01),也低于正常的control组和miR-222 inhibitor NC组,差异均具有统计学意义(P<0.05),见图4和图5。
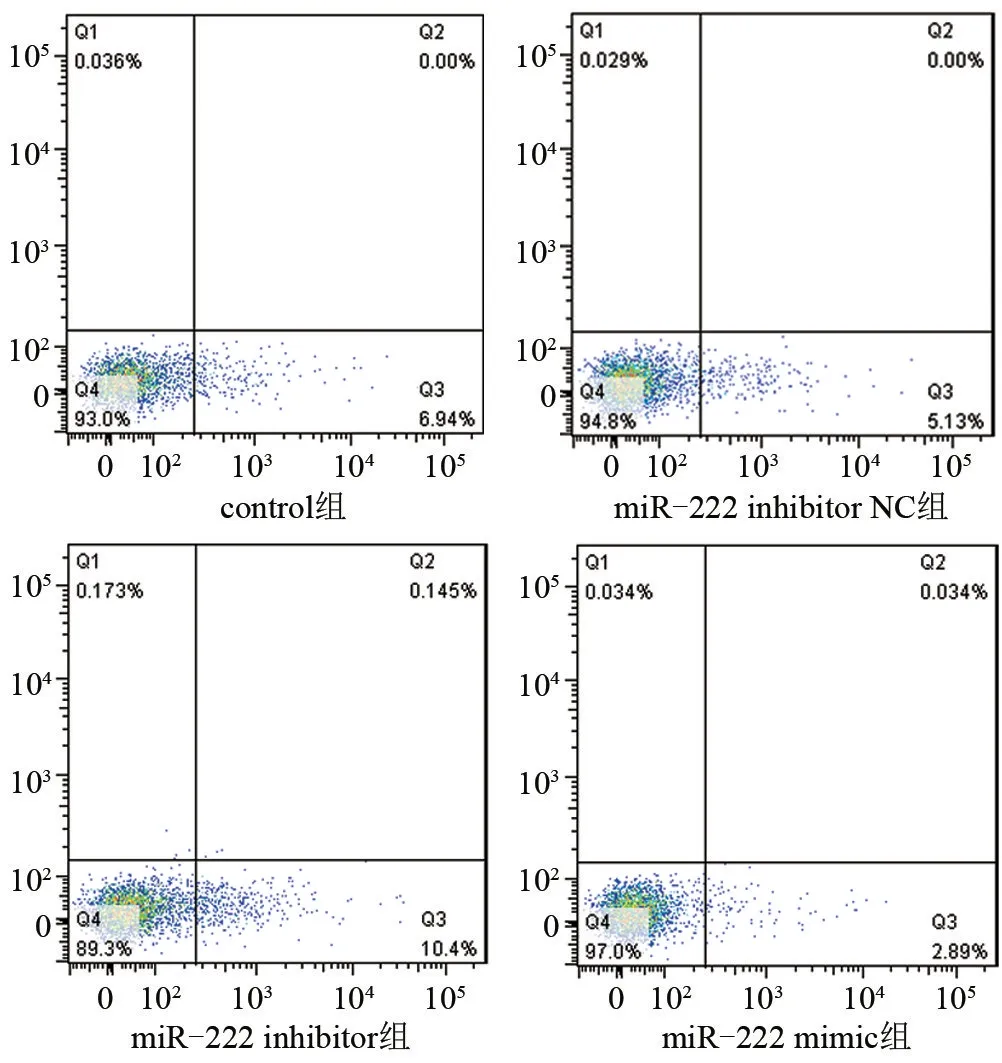
图4 各组T24细胞流式凋亡图片

图5 各组T24细胞流式凋亡结果比较
2.5 MiR-222与CDKN1B的结合关系测定及Western blot分析 采用生物信息学预测到miR-222与CDKN1B mRNA 3'UTR存在结合位点,见图6A;荧光素酶活性报告分析显示,与miR-222 NC组相比,miR-222组WT细胞的荧光活性表达量显著降低,MUT细胞的荧光活性表达量不受影响,见图6B;Western blot结果显示:与control组相比,miR-222 mimic组T24细胞中CDKN1B(p27)蛋白表达量显著降低,与miR-222 inhibitor NC组相比,miR-222 inhibitor组T24细胞中CDKN1B(p27)蛋白表达量明显升高,见图6C、6D,各组差异均有统计学意义(P<0.05)。
2.6 组织免疫组化染色结果 为了证明CDKN1B(p27)蛋白在细胞中的分布与表达差异,对膀胱癌组织和癌旁组织进行了免疫组织化学染色,结果显示:CDKN1B(p27)蛋白主要定位于细胞质,阳性染色为棕黄色。结果表明,与癌旁组织相比,CDKN1B(p27)蛋白在膀胱癌组织中的表达明显降低,差异有统计学意义(P<0.05),见图7和图8。

图8 膀胱癌和癌旁组织中的CDKN1B(p27)蛋白的表达量
3 讨论
膀胱肿瘤的发生和发展是一个复杂的多基因调控过程。miRNA通过诱导降解或阻断翻译来抑制基因表达,从而参与肿瘤的发生发展过程。miR-221与miR-222在结构和功能上具有较大的相似性,在多种人类肿瘤中发挥了重要作用,如膀胱癌、前列腺癌、胃癌及甲状腺癌等[10-13]。研究发现,miR-222在膀胱肿瘤组织中的表达水平明显高于相应的非癌组织[14],高级别尿路上皮癌比低级别尿路上皮癌组织中miR-222水平高,肌层浸润性膀胱癌(T2-T4)比浅表性膀胱癌(TaT1)组织中miR-222水平高,过度表达miR-222的患者在治疗后短期复发和进展的风险更大[4]。本实验用荧光定量PCR法检测了miR-222在膀胱癌组织和癌旁组织中的表达差异,结果表明,miR-222在膀胱癌组织中的表达远高于癌旁组织中的表达。在体外细胞学实验中,转染miR-222 mimic使miR-222在膀胱癌T24细胞中表达上调可使细胞增殖及迁移能力增强,并抑制癌细胞的凋亡,而下调miR-222则明显降低了膀胱癌T24细胞增殖和迁移能力,促进癌细胞的凋亡。这些研究表明,在体外,miR-222具有促进膀胱癌发生发展的作用。
细胞周期的进展需要细胞周期蛋白依赖激酶(CDK)的特异性激活。CDK抑制因子包括两个家族:CDK4家族和CIP/KIP家族(激酶抑制蛋白),后者包括p21、p27(CDKN1B)和p57。CDKN1B基因定位于12号染色体短臂,编码p27蛋白。p27是由198个氨基酸组成的蛋白质,是一种关键的细胞周期调节因子,可以通过其N末端结构域与细胞周期蛋白和CDK亚单位相互作用来抑制细胞周期蛋白D、E和B-CDK复合物的催化活性,参与细胞分化、增殖和凋亡[15-16]。p27增加2~3倍可以完全抑制G1~S期细胞周期蛋白CDK,阻止细胞周期从G期进展到S期。CDKN1B(p27)在表达水平和亚细胞定位上都受到调控。研究发现,CDKN1B参与了许多肿瘤的发生过程,如多发性内分泌肿瘤、急性淋巴细胞白血病、黑色素瘤、视网膜母细胞瘤等[17],其表达的缺失或下降与许多肿瘤的侵袭行为有关,包括乳腺癌、结肠癌、前列腺癌及肺癌等[18]。在本研究中,通过膀胱癌组织和癌旁组织免疫组化染色发现,CDKN1B(p27)在膀胱癌组织中的表达与癌旁组织相比显著降低,证实CDKN1B参与了膀胱癌的发生发展过程。目前的研究表明,多种信号转导途径参与调控CDKN1B的表达和分布。PI3K-AKT途径通过转录因子调控CDKN1B蛋白的表达,而泛素-蛋白酶体水解是CDKN1B转录后调控的主要途径,Ras-MAKP通路是参与这一过程最可能的信号通路。CDKN1B还与许多细胞内和细胞外的分子存在相互作用,如Ras、Spy1、SKP2及CRM1等。
很多肿瘤抑制因子是miR-221和miR-222在癌症中的靶点,包括细胞周期蛋白依赖性激酶抑制剂CDKN1B/p27和CDKN1C/p57[19],14磷酸肌醇3激酶途径磷酸酶和张力蛋白同系物(PTEN)的抑制剂、促凋亡蛋白B细胞淋巴瘤2-修饰因子(BMF)等。在肝癌细胞中,miR-221和miR-222的可能作用靶点包括p27、p57、BBC3及TIMP3等[20]。在高侵袭性胰腺导管腺癌中,miR-222的表达明显增高,其可以通过抑制PPP2R2A激活AKT,促进p27磷酸化,增强癌细胞侵袭和增殖能力[7]。在人类卵巢癌细胞中,p27是miR-222的直接靶点,上调miR-222能够促进卵巢癌细胞增殖[21]。研究发现,CDKN1B基因的3'UTR有两个位点与miR-222种子序列相匹配,miR-222可能调节p27mRNA的翻译及蛋白质表达水平,但并不影响mRNA的水平,仅在CDKN1B3'UTR的一个靶位点中修饰不足以阻断miR-222的功能。在本研究中,通过双荧光素酶报告基因检测分析表明,在膀胱癌T24细胞中,CDKN1B可能是miR-222的直接靶点之一,miR-222对其具有负向调控的作用,导致p27表达下降,细胞周期进展,促进肿瘤细胞的增殖与迁移。Western blot分析也进一步证实,与对照组相比,增加miR-222的表达能明显抑制p27的表达,而抑制miR-222的表达则能明显增加p27的表达。但是,p27可能并不是miR-222的唯一靶点,其也可以通过靶向编码p27蛋白降解的基因来间接参与p27蛋白水平的调节,其具体的分子机制仍需进一步深入的研究。
总之,本研究证实了miR-222在膀胱癌组织中的表达明显上调,下调miR-222可以明显抑制膀胱癌细胞的增殖和迁移能力,并且促进膀胱癌细胞的凋亡;miR-222可能通过负向调控抑癌基因CDKN1B表达来发挥作用,其可能作为膀胱癌检测与治疗的一个潜在靶点。

