基于Nrf2/HO-1通路探讨藏红花酸对高血脂合并冠心病大鼠心肌损伤的改善作用及对心电图的影响*
李志坤,王希柱,宋巧凤
(唐山市人民医院,河北 唐山 063000)
冠心病是因冠状动脉粥样硬化或冠状动脉功能改变引起的心肌缺血缺氧性心脏病,具有较高的发病率,成为造成人类死亡的主要疾病之一。高血脂是冠心病的独立危险因素之一,其造成的血脂代谢障碍可加速动脉粥样硬化的发展,引起冠状动脉管腔堵塞或狭窄,进而发生心肌缺血、缺氧性坏死[1]。因此,改善血脂代谢、抑制心肌损伤是临床重要治疗措施。藏红花酸是藏红花的重要活性成分,具有抗氧化、改善微循环、抗凋亡等作用[2]。研究证实,藏红花酸能够改善大鼠局灶性脑缺血缺氧性损伤[3]。目前,关于藏红花酸对缺血再灌注损伤方面的相关研究较多,在高血脂造成的心血管疾病方面研究较少。因此,本研究通过建立高血脂合并冠心病大鼠模型,分析藏红花酸对大鼠心肌改善作用及对心电图的影响,并探讨其机制,以期为高血脂引起的冠心病治疗提供更多选择。
1 材料与方法
1.1 实验动物4周龄SPF级雄性SD大鼠55只,体质量180~220 g,购自广州相观生物科技有限公司,生产许可证号:SCXK(粤)2018-0043,在清洁级条件下(室温22~24℃,相对湿度50%~70%,自由饮水进食)喂养1周后建立高血脂合并冠心病模型。本研究在实施前已经唐山市动物伦理委员会批准,实验操作符合动物伦理委员会要求,伦理批号:20190212。
1.2 药物与试剂 藏红花酸(济南浩化实业有限责任公司,纯度>98%,批号:190106);消心痛(硝酸异山梨酯片,天津太平洋制药有限公司,5 mg/片);NRF2抑制剂ML385(上海泽叶生物有限公司,批号:181216);兔抗大鼠核因子E2相关因子2(nuclear factor-erythroid 2,Nrf2)多克隆抗体(批号:MA5-32116)、血红素氧合酶1(heme oxygenase-1,HO-1,批号:MA5-32042)、B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)多克隆抗体(批号:MA5-33119)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体(批号:MA5-36172)、辣根过氧化物酶标记的羊抗兔二抗(批号:PA1-18329)(赛默飞世尔科技中国)。
1.3 主要仪器XR-RM-6280小动物心电图机(上海欣软信息科技有限公司);OLympus光学显微镜(日本OLympus株式会社)。
1.4 造模与分组 参照文献[4]建立高血脂合并冠心病大鼠模型,45只大鼠以高脂饲料(江苏省协同医药生物工程有限责任公司)连续喂养8周,间隔24 h后予以腹腔注射垂体后叶素,30U/kg,1次/d,连续3次。末次腹腔注射后12 h进行心电图检查,以出现ST段移位或T波高耸为冠心病建模成功。心电图检测后采集眶静脉血,离心分离血清,以生化分析仪检测总胆固醇(total cholesterol,TC)和(或)甘油三酯(triacylglyceride,TG)显著升高为高血脂,同时符合高血脂及冠心病诊断者为建模成功。另10只大鼠正常普通饲料喂养8周,间隔24 h以0.9%氯化钠溶液腹腔注射,10 mL/kg,1次/d,连续3次,作为对照组。建模成功大鼠随机分为模型组(11只)、消心痛组(10只)、藏红花酸组(10只)、藏红花酸+ML385组(10只)。
1.5 实验给药 垂体后叶素末次腹腔注射后24 h,藏红花酸组大鼠给予藏红花酸灌胃,50 mg/kg;藏红花酸+ML385组大鼠给予藏红花酸(50 mg/kg)+ML385(30 mg/kg)灌胃;消心痛组大鼠给予消心痛灌胃,2.5 mg/kg;对照组、模型组大鼠分别以0.5%羧甲基纤维素纳灌胃,10 mL/kg,1次/d,连续4周,干预期间改为普通饲料饲养。
1.6 观察指标
1.6.1 心电图检查 于末次给药后6 h,大鼠以20%乌拉坦(5 mg/kg)腹腔注射麻醉,实施心电图检测,观察肢体Ⅱ导联心电图,记录各组大鼠ST段偏移幅度(mV)。
1.6.2 血脂指标检测 心电图检测后,剪去心前区被毛,碘酒消毒,沿正中线切开胸部,暴露心脏,抽取4 mL血液,3 000 r/min离心5 min,离心半径10 cm,分离血清后使用生化分析仪及配套试剂检测血脂[TC、TG、高密度脂蛋白胆固醇(hight density cipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density cipoprotein-cholesterol,LDL-C)]。
1.6.3 TUNEL染色观察大鼠心肌细胞凋亡情况 抽血完毕后,各组选取5只大鼠过量麻醉处死,自上腔静脉注入4%多聚甲醛至心脏变白,摘取心脏以4%多聚甲醛固定,石蜡包埋、切片,细胞通透液通透,加入TUNEL反应液及DAPI染色,封片,光镜下观察心肌细胞凋亡情况,凋亡细胞褐色或棕黄色,随机选取5个非重叠400倍视野,计算凋亡指数(AI),AI(%)=(凋亡细胞数/细胞总数)×100%。
1.6.4 Western blotting检测心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白相对表达量 心肌组织研磨匀浆,BCA法检测蛋白浓度。30 μg蛋白样品上样于SDS-PAGE凝胶进行电泳,后转移PVDF膜,加入1%牛血清白蛋白室温封闭1 h,洗膜后加入一抗,4℃封闭过夜,加入二抗室温孵育60 min,加入曝光液,凝胶成像系统中曝光,Quantity One软件分析电泳条带灰度值,以灰度值与内参β-actin灰度值比值表示蛋白相对表达量。
1.7 统计学方法 采用SPSS 25.0统计软件分析处理数据,计量资料采用“均数±标准差”(s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠心电图ST段偏移幅度比较 模型组大鼠心电图ST段偏移幅度高于对照组(P<0.05);消心痛组、藏红花酸组大鼠心电图ST段偏移幅度均低于模型组(P<0.05),藏红花酸+ML385组大鼠心电图ST段偏移幅度与模型组比较,差异无统计学意义(P>0.05);藏红花酸组大鼠心电图ST段偏移幅度高于消心痛组(P<0.05);藏红花酸+ML385组大鼠心电图ST段偏移幅度高于藏红花酸组(P<0.05)。(见表1)
表1 各组大鼠心电图ST段偏移幅度比较±s,mV)
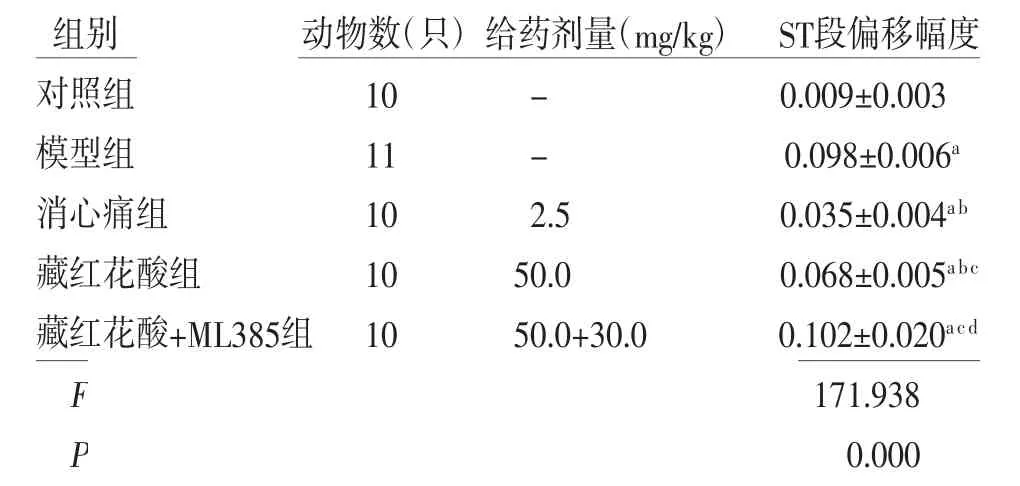
表1 各组大鼠心电图ST段偏移幅度比较±s,mV)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与消心痛组比较,cP<0.05;与藏红花酸组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)ST段偏移幅度对照组 10 - 0.009±0.003模型组 11 - 0.098±0.006a消心痛组 10 2.5 0.035±0.004ab藏红花酸组 10 50.0 0.068±0.005abc藏红花酸+ML385组10 50.0+30.0 0.102±0.020acd F 171.938 P 0.000
2.2 各组大鼠血脂指标比较 模型组大鼠血清中TG、TC、LDL-C水平均高于对照组,而HDL-C水平低于对照组(P<0.05);消心痛组、藏红花酸组大鼠血清中TG、TC、LDL-C水平均低于模型组,而HDL-C水平均高于模型组(P<0.05);藏红花酸+ML385组大鼠血清中TG、TC、HDL-C、LDL-C水平与模型组比较,差异均无统计学意义(P>0.05);藏红花酸组大鼠血清中TG、TC、LDL-C水平均高于消心痛组,而HDL-C水平低于消心痛组(P<0.05);藏红花酸+ML385组大鼠血清中TG、TC、HDL-C水平高于藏红花酸组,而HDL-C水平低于藏红花酸组(P<0.05)。(见表2)
表2 各组大鼠血脂指标比较s,mmol/L)
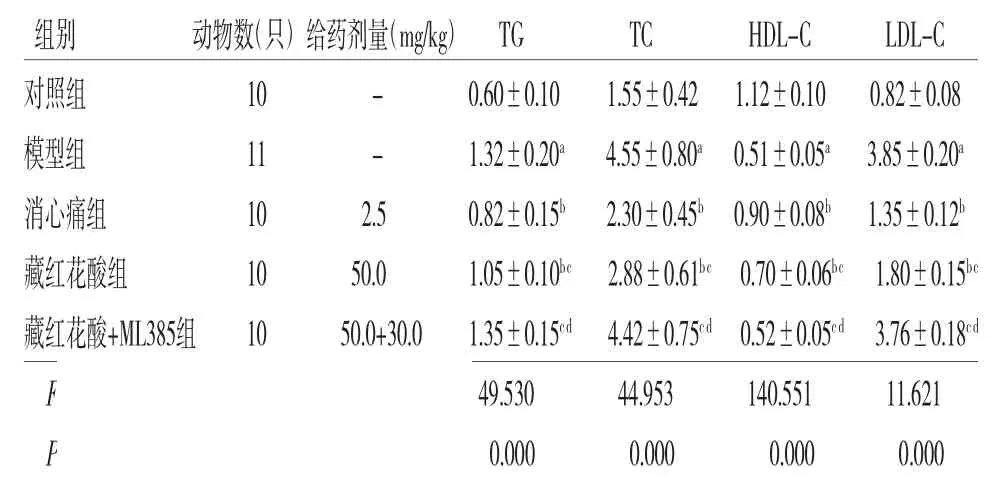
表2 各组大鼠血脂指标比较s,mmol/L)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与消心痛组比较,cP<0.05;与藏红花酸组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)TG TC HDL-C LDL-C对照组 10 - 0.60±0.10 1.55±0.42 1.12±0.10 0.82±0.08模型组 11 - 1.32±0.20a 4.55±0.80a 0.51±0.05a 3.85±0.20a消心痛组 10 2.5 0.82±0.15b 2.30±0.45b 0.90±0.08b 1.35±0.12b藏红花酸组 10 50.0 1.05±0.10bc 2.88±0.61bc 0.70±0.06bc 1.80±0.15bc藏红花酸+ML385组 10 50.0+30.0 1.35±0.15cd 4.42±0.75cd 0.52±0.05cd 3.76±0.18cd F 49.530 44.953 140.551 11.621 P 0.000 0.000 0.000 0.000
2.3 各组大鼠心肌细胞凋亡情况比较 模型组大鼠心肌细胞AI高于对照组(P<0.05);消心痛组、藏红花酸组大鼠心肌细胞AI均低于模型组(P<0.05);藏红花酸+ML385组大鼠心肌细胞AI与模型组比较,差异无统计学意义(P>0.05);藏红花酸组大鼠心肌细胞AI高于消心痛组(P<0.05);藏红花酸+ML385组大鼠心肌细胞AI高于藏红花酸组(P<0.05)。(见表3、图1)
表3 各组大鼠心肌细胞AI比较s,%)

表3 各组大鼠心肌细胞AI比较s,%)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与消心痛组比较,cP<0.05;与藏红花酸组比较,dP<0.05
组别 细胞数(个) 心肌细胞AI对照组 25 5.01±1.20模型组 25 40.32±3.35a消心痛组 25 12.32±2.41b藏红花酸组 25 16.87±3.00b c藏红花酸+ML385组 25 39.35±3.20c d F 863.757 P 0.000
2.4 各组大鼠心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白相对表达量比较 模型组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量均低于对照组,而Bax蛋白相对表达量高于对照组(P<0.05);消心痛组、藏红花酸组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量均高于模型组,而Bax蛋白相对表达量均低于模型组(P<0.05);藏红花酸+ML385组大鼠心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白相对表达量与模型组比较,差异均无统计学意义(P>0.05);藏红花酸组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量低于消心痛组,而Bax蛋白相对表达量高于消心痛组(P<0.05);藏红花酸+ML385组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量低于藏红花酸组,而Bax蛋白相对表达量高于藏红花酸组(P<0.05)。(见表4、图2)
表4 各组大鼠心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白相对表达量比较)
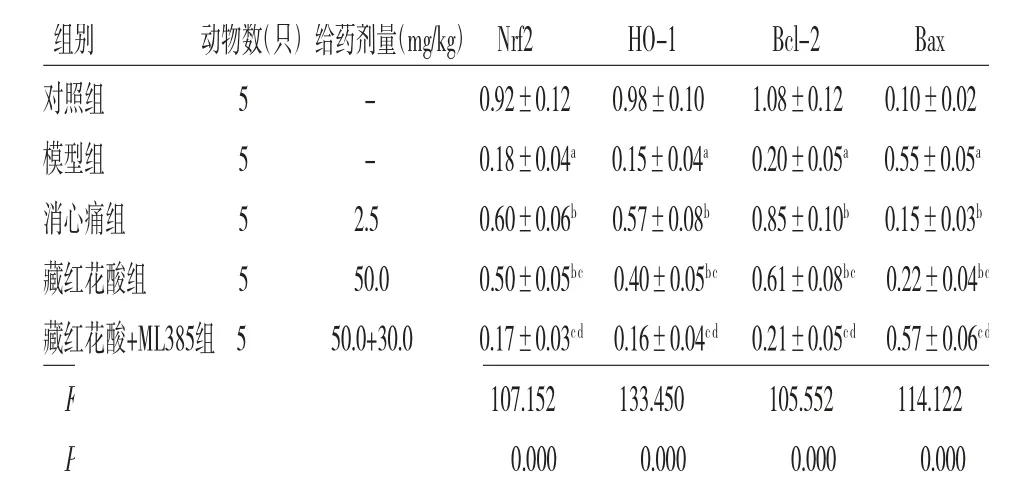
表4 各组大鼠心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白相对表达量比较)
注:与对照组比较,aP<0.05;与模型组比较,bP<0.05;与消心痛组比较,cP<0.05;与藏红花酸组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)Nrf2 HO-1 Bcl-2 Bax对照组 5 - 0.92±0.12 0.98±0.10 1.08±0.12 0.10±0.02模型组 5 - 0.18±0.04a 0.15±0.04a 0.20±0.05a 0.55±0.05a消心痛组 5 2.5 0.60±0.06b 0.57±0.08b 0.85±0.10b 0.15±0.03b藏红花酸组 5 50.0 0.50±0.05bc 0.40±0.05bc 0.61±0.08bc 0.22±0.04bc藏红花酸+ML385组5 50.0+30.0 0.17±0.03cd 0.16±0.04cd 0.21±0.05cd 0.57±0.06cd F 107.152 133.450 105.552 114.122 P 0.000 0.000 0.000 0.000
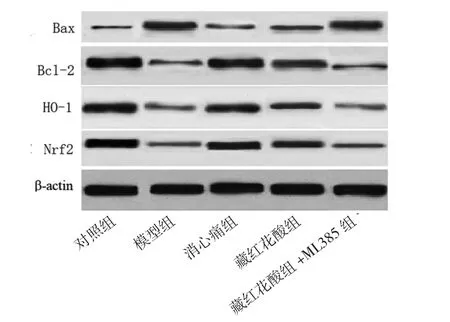
图2 各组大鼠心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白表达图
3 讨 论
高血脂主要是因脂质代谢紊乱,引起内皮细胞、白细胞表面特异性改变,造成血管内皮损伤,血管腔逐渐变硬、狭窄,阻碍心肌供血,进而发生缺血、缺氧性坏死,可造成心绞痛、心肌梗死、缺血性心力衰竭及猝死,对患者的健康及生命安全均造成极大威胁[5]。因此,改善血脂代谢水平、抑制心肌细胞缺血缺氧性坏死成为冠心病的重要治疗原则。
藏红花酸是从鸢尾科植物番红花花柱的上部及柱头中提取的类胡萝卜素物质,具有多不饱和共轭烯酸结构,有改善血脂、抗血小板聚集、抗细胞凋亡及改善血液循环等多种作用,能保护视网膜神经上皮细胞和肺细胞[6-7]。研究发现,藏红花酸能抑制巨噬细胞源性泡沫细胞的形成,降低氧化低密度脂蛋白水平,发挥抗动脉粥样硬化的作用[8]。另有研究发现,藏红花酸可改善视网膜、胃和全脑缺血再灌注损伤,抑制细胞凋亡[9]。上述研究说明藏红花酸有改善血脂代谢、抗动脉粥样硬化和减轻缺血性细胞损伤的作用。本研究结果表明,模型组大鼠ST段偏移幅度,TG、TC、LDL-C水平,以及心肌细胞AI均高于对照组,HDL-C水平低于对照组,提示模型组存在高血脂及冠心病表现;消心痛组、藏红花酸组大鼠心电图ST段偏移幅度,血清中TG、TC、LDL-C水平,以及心肌细胞AI低于模型组,HDL-C水平高于模型组;藏红花酸+ML385组大鼠心电图ST段偏移幅度,血清中TG、TC、LDL-C、HDL-C水平,以及心肌细胞AI与模型组比较,差异均无统计学意义(P>0.05)。藏红花酸组大鼠心电图ST段偏移幅度,血清中TG、TC、LDL-C水平,以及心肌细胞AI均高于消心痛组,HDL-C水平低于消心痛组;藏红花酸+ML385组大鼠心电图ST偏移幅度,血清中TG、TC、LDL-C水平,以及心肌细胞AI均高于藏红花酸组,HDL-C水平低于藏红花酸组,证实藏红花酸可改善高血脂合并冠心病大鼠血脂代谢,减轻心肌损伤,改善心电图结果,抑制心肌细胞凋亡。
Nrf2是氧化应激反应的中枢调节因子,被激活后可向核内转移启动下游信号通路,发挥抗氧化应激作用[10]。HO-1是血红素加氧酶的同工酶,能被各种氧化应激因子激活,增强细胞的抗氧化应激损伤能力,发挥抗炎、抗凋亡的作用[11]。研究证实,在氧化应激作用下,Nrf2被激活可诱导下游HO-1通过抗氧化应激作用抑制细胞凋亡,发挥心血管保护作用[12]。Bcl-2与Bax是同源二聚体的细胞凋亡调节基因,Bax位于细胞浆中,具有促进细胞凋亡作用。Bcl-2位于线粒体膜上,能通过维持线粒体膜的稳定性,抑制细胞凋亡,并与Bax形成二聚体抗Bax的凋亡作用[13-14]。刘中等[15]研究发现Bcl-2的表达上调及Bax表达下调可改善缺血预处理诱导的外泌体对心肌细胞低氧/复氧损伤修复作用。模型组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量均低于对照组,Bax蛋白相对表达量高于对照组;消心痛组、藏红花酸组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量均高于模型组,而Bax蛋白相对表达量低于模型组;藏红花酸+ML385组大鼠心肌组织Nrf2、HO-1、Bcl-2、Bax蛋白相对表达量与模型组比较,差异均无统计学意义(P>0.05);藏红花酸组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量低于消心痛组,而Bax蛋白相对表达量高于消心痛组;藏红花酸+ML385组大鼠心肌组织Nrf2、HO-1、Bcl-2蛋白相对表达量低于藏红花酸组,而Bax蛋白相对表达量高于藏红花酸组,提示藏红花酸可能通过激活Nrf2/HO-1通路,发挥改善高血脂合并冠心病大鼠的血脂代谢和心电图结果,抑制心肌损伤与凋亡的作用。
综上所述,藏红花酸能改善高血脂合并冠心病大鼠的血脂代谢水平,减轻心肌损伤,改善心电图检查结果,抑制心肌细胞凋亡,其机制可能与Nrf2/HO-1通路的激活有关。藏红花酸对高血脂合并冠心病引起的心肌损伤有明显的保护作用。

