青霉菌P1处理染料废水*
刘江红,苏会敏,薛 健,魏晓航
(1.东北石油大学 化学化工学院,黑龙江 大庆 163318;2.西安凯立新材料股份有限公司,陕西 西安 710201)
随着染料生产和印染工业的发展,染料废水的排放量急剧增加,全球印染染料产量超过100万t/a,约有5%~10%的染料随废水排放出去[1-2]。染料废水是一种难处理的工业废水,对环境造成严重污染,破坏生态平衡,威胁人体健康。传统的物理法和化学法具有成本高、效率低、易产生二次污染的缺点,而生物法具有成本低、安全、无污染、环境友好等优点。到目前为止,已经发现了多种可以脱色染料的微生物,主要包括真菌、细菌和藻类等[3],生物法具有广阔的应用前景[4]。作者从染料废水中筛选出一株青霉菌,用以脱色亚甲基蓝染料废水,探究不同因素对青霉菌脱色亚甲基蓝的影响。
1 实验部分
1.1 原料、试剂与仪器
菌种:实验所用染料降解菌来自于染料废水样品,筛选出的菌株于实验室冰箱中冷藏保存。
亚甲基蓝:天津博迪化工股份有限公司;蔗糖:生物试剂,氯化钙:分析纯,天津市耀华化工厂;磷酸氢二钾、硫酸镁、硫酸铵、磷酸二氢钾:分析纯,天津市塘沽鹏达化工厂。
电热恒温培养箱:SYQ-DSX-280B,南京晓晓仪器设备有限公司;台式恒温振荡培养箱:HZQ-X100,常州恒隆仪器有限公司;pH计:pHS-3C,济南光耀医疗设备有限公司;可见分光光度计:722E,北京瑞青橙仪器仪表有限公司;紫外-可见分光光度计:T6,华威科创(武汉)科技有限公司;傅里叶红外光谱仪:Nicolet 6700,美国热电公司。
1.2 实验方法
1.2.1 培养基的处理
(1)真菌驯化培养基:NaNO32.0 g,MgSO4·7H2O 0.5 g,K2HPO41 g,FeSO4·7H2O 0.01 g,蒸馏水1 000 mL,KCl 0.5 g,蔗糖30 g,pH=7,121 ℃灭菌20 min。
(2)染料降解培养基(MSM):(NH4)2SO42.0 g,MgSO4·7H2O 0.2 g,CaCl2·2 H2O 0.01 g,KH2PO41.5 g,K2HPO41.0 g,FeSO4·7H2O 0.01 g,蔗糖10 g,蒸馏水1 000 mL,pH=7.0,121 ℃高压蒸汽灭菌 25 min。
1.2.2 微生物的驯化
驯化实验在250 mL锥形瓶中进行(培养液体积50 mL),摇床转速120 r/min,t=35 ℃。采用逐步提升染料浓度的驯化方法,驯化期约30 d,具体驯化流程见图1。

图1 高效染料降解菌筛选、分离、纯化流程
1.2.3 血球计数法配制孢子悬液
在超净工作台上,将少量w(NaCl)=0.9%的生理盐水倒入覆盖着青霉菌孢子的固体培养基中,缓慢摇晃,然后倒入250 mL锥形瓶中。重复几次可获得高浓度的青霉菌孢子悬液,在摇瓶中加适量w(NaCl)=0.9%的生理盐水至100 mL,振荡一段时间使孢子呈均匀分散状态。将盖玻片置于镜检后的血球计数板上,摇匀孢子悬液,用灭菌后的胶头滴管吸取1滴,沿盖玻片边缘滴入计数室,对计数室内的孢子个数进行3次计数,取平均值[5-7]。孢子悬液浓度计算见公式(1)。
(1)
式中:孢子悬液浓度,个/mL;N为平均10个格内孢子数,个。
取250 mL锥形瓶,加入100 mL染料降解培养基,用灭菌后的移液管移取孢子悬液,将φ(青霉菌孢子)=1%的接种悬液(浓度为107个/mL)置于生长培养基中,即接种后培养基中孢子浓度为105个/mL,留置备用。
1.2.4 脱色效率的测定
取上清液3 mL,n=9 000 r/min离心10 min,于亚甲基蓝最大吸收波长(660 nm)下测定吸光度(At),以未被处理的青霉菌处理亚甲基蓝溶液的吸光度(A0)为对照,空白染料降解培养基为参比,亚甲基蓝的脱色效率见公式(2)[8-10]。

(2)
1.2.5 不同因素对亚甲基蓝脱色效率的影响
考察青霉菌P1脱色亚甲基蓝的过程中,各因素对亚甲基蓝脱色效率的影响。亚甲基蓝的脱色实验在初始亚甲基蓝浓度、青霉菌孢子悬液接种量、pH值(通过滴加0.1 mol/L HCl或0.1 mol/L NaOH溶液进行调节)、时间和盐度等不同条件下进行。
1.2.6 青霉菌脱色亚甲基蓝的机理探究
1.2.6.1 青霉菌脱色亚甲基蓝前、后机理的实验探究
取4个250 mL锥形瓶,分别标记1#、2#、3#和4#。用移液管移取ρ(亚甲基蓝)=1 g/L的母液2 mL,使最终溶液ρ(亚甲基蓝)=20 mg/L,将φ(真菌孢子)=3%的悬液接种染料降解培养基中,n=120 r/min恒温35 ℃培养,分别进行以下实验操作。(1)1#瓶经n=7 000 r/min离心5 min,每隔24 h测定吸光度值,计算脱色效率。(2)2#瓶培养超过48 h,直至溶液颜色由蓝色变为白色,并不再发生变化后取出。n=8 000 r/min高速离心脱色菌体,上清液即为粗酶液。取整瓶粗酶液,加入亚甲基蓝原溶液,使最终溶液ρ(亚甲基蓝)=20 mg/L,n=150 r/min恒温培养超过48 h,每隔24 h测定一组吸光度值,直至吸光度值不再发生变化为止。(3)3#瓶和4#瓶分别培养24和48 h之后取出,经121 ℃高压灭菌20 min,致菌体死亡,测定吸光度值并计算脱色效率。
1.2.6.2 青霉菌脱色亚甲基蓝前、后的紫外分析
在染料降解培养基中以ρ(亚甲基蓝)=20 mg/L、悬液接种量φ(青霉菌孢子)=3%为条件,在培养前(0 h)和亚甲基蓝完全脱色后(72 h)分别取10 mL混合液通过离心(9 000 r/min,5 min)的方式去除菌体,并利用紫外-可见分光光度计的扫描功能分析混合液上清液的紫外谱图变化。
1.2.6.3 亚甲基蓝脱色前、后红外光谱分析
将φ(青霉菌孢子)=3%的悬液接种至染料降解培养基中,n=120 r/min恒温培养72 h,通过离心制备青霉菌粗酶液100 mL,通过移液管向青霉菌粗酶液中加入ρ(亚甲基蓝)=1 g/L的溶液2 mL,使最终溶液中的ρ(亚甲基蓝)=20 mg/L,恒温振荡48 h,溶液中亚甲基蓝无残留,由于青霉菌产生的还原物质和酶的共同作用使亚甲基蓝全部断链,进而被脱色。在用压片机给KBr压片后,分别滴加脱色前ρ(亚甲基蓝)=20 mg/L溶液和脱色后ρ(亚甲基蓝)=20 mg/L溶液进行红外光谱分析(FTIR)。
2 结果与讨论
2.1 真菌筛选结果与鉴定
2.1.1 不同菌株对亚甲基蓝脱色效率的对比
不同菌株对ρ(亚甲基蓝)=20 mg/L溶液的脱色效率见图2。

t/h图2 不同菌株对亚甲基蓝的脱色效率
由图2可知,t=72 h,菌株1的亚甲基蓝脱色效率为85.21%,t=96、120 h的脱色效率变化不大。t=72 h,菌株2的亚甲基蓝脱色效率为55.41%,t=96、120 h的脱色效率为67.23%、72.13%,仍有继续增长的趋势,考虑亚甲基蓝的脱色时间和脱色效率2个因素,所以选用菌株1作为后续研究菌株。
2.1.2 菌株1的16S rDNA的分子鉴定
菌株1的形态和生理模式显示了与青霉菌的高度相似性。菌株的16S rDNA序列与NCBI GenBank和RDP数据库对比,可鉴定该序列为青霉菌(PencillumexpansumKU162972,简称P1),基因同源性相似度达99%。菌株的系统发育树见图3。

图3 P1的系统发育树
2.2 不同因素对亚甲基蓝脱色效率的影响
2.2.1 初始ρ(亚甲基蓝)对亚甲基蓝脱色效率的影响
青霉菌P1在初始ρ(亚甲基蓝)=0、20、40、60、80和100 mg/L的培养基中培养5 d后,对不同ρ(亚甲基蓝)溶液的脱色效率见图4。
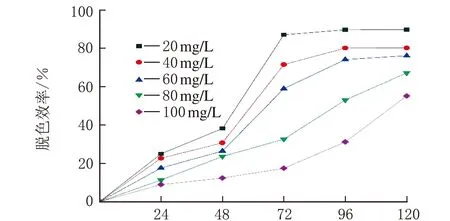
t/h图4 初始ρ(亚甲基蓝)对亚甲基蓝脱色效率的影响
由图4可知,随着ρ(亚甲基蓝)逐渐升高,脱色效率逐渐降低。ρ(亚甲基蓝)=40~100 mg/L,脱色效率明显下降。分析原因可能是ρ(亚甲基蓝)过高对青霉菌P1产生了一定的毒性,抑制青霉菌P1的正常生长,从而导致亚甲基蓝脱色效率的下降。
2.2.2φ(青霉菌P1孢子)对亚甲基蓝脱色效率的影响
φ(青霉菌P1孢子)对亚甲基蓝脱色效率的影响见图5。
由图5可知,φ(青霉菌P1孢子)=1%~3%,脱色效率随着φ(青霉菌P1孢子)的增加而增加,而φ(青霉菌P1孢子)=4%~5%,脱色效率变化很小,分析原因可能是在特定的反应体系中,营养物质有限度,微生物不能无限繁殖,随着微生物代谢产物的增加和营养物的消耗,导致脱色效率不再升高。因此,在后续的实验中,最佳接种量选择φ(青霉菌P1孢子)=4%。
φ(青霉菌P1孢子)/%图5 φ(青霉菌P1孢子)对亚甲基蓝脱色效率的影响
2.2.3 pH值对亚甲基蓝脱色效率的影响
pH值对亚甲基蓝脱色效率的影响见图6。

pH图6 pH值对亚甲基蓝脱色效率的影响
由图6可知,pH=1~3,亚甲基蓝的脱色效率逐渐上升;pH=4,脱色效率达到最大值94.95%;pH=5~7,脱色效率逐渐下降;pH=8~9,亚甲基蓝的脱色效率仅为26.52%和13.26%,呈下降趋势。酸性条件下对亚甲基蓝的脱色效率明显高于碱性,青霉菌P1很有可能是一种嗜酸菌,在酸性条件下更有利于生长。pH=8~9,溶液呈碱性,影响了青霉菌P1的生长,导致亚甲基蓝的脱色效率明显下降。因此,青霉菌最适宜的降解亚甲基蓝染料选择pH=4。
2.2.4 时间对亚甲基蓝脱色效率的影响
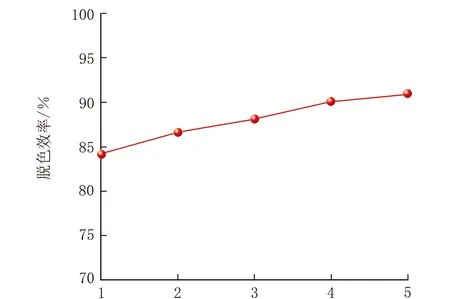
脱色时间是影响微生物脱色能力的重要因素,适宜的反应时间不仅能使微生物充分发挥作用,还能节约反应时间及成本,对实际工程应用有很大的影响,时间对亚甲基蓝脱色效率的影响见图7。
由图7可知,青霉菌P1在培养t=4~20 h,亚甲基蓝脱色效率呈快速上升趋势;在培养t=24、28 h,脱色效率分别为93.09%、95.37%,呈缓慢上升趋势。因此在后续实验过程中,考虑实验时间和实验成本,青霉菌P1脱色亚甲基蓝的最适宜脱色时间选择24 h。

t/h图7 时间对亚甲基蓝脱色效率的影响
2.2.5 盐度对亚甲基蓝脱色效率的影响
染料废水通常具有较高的含盐量。在实际染料废水处理过程中,研究盐度对青霉菌P1生长和染料脱色的影响具有重要意义。盐度对亚甲基蓝脱色效率的影响见图8。
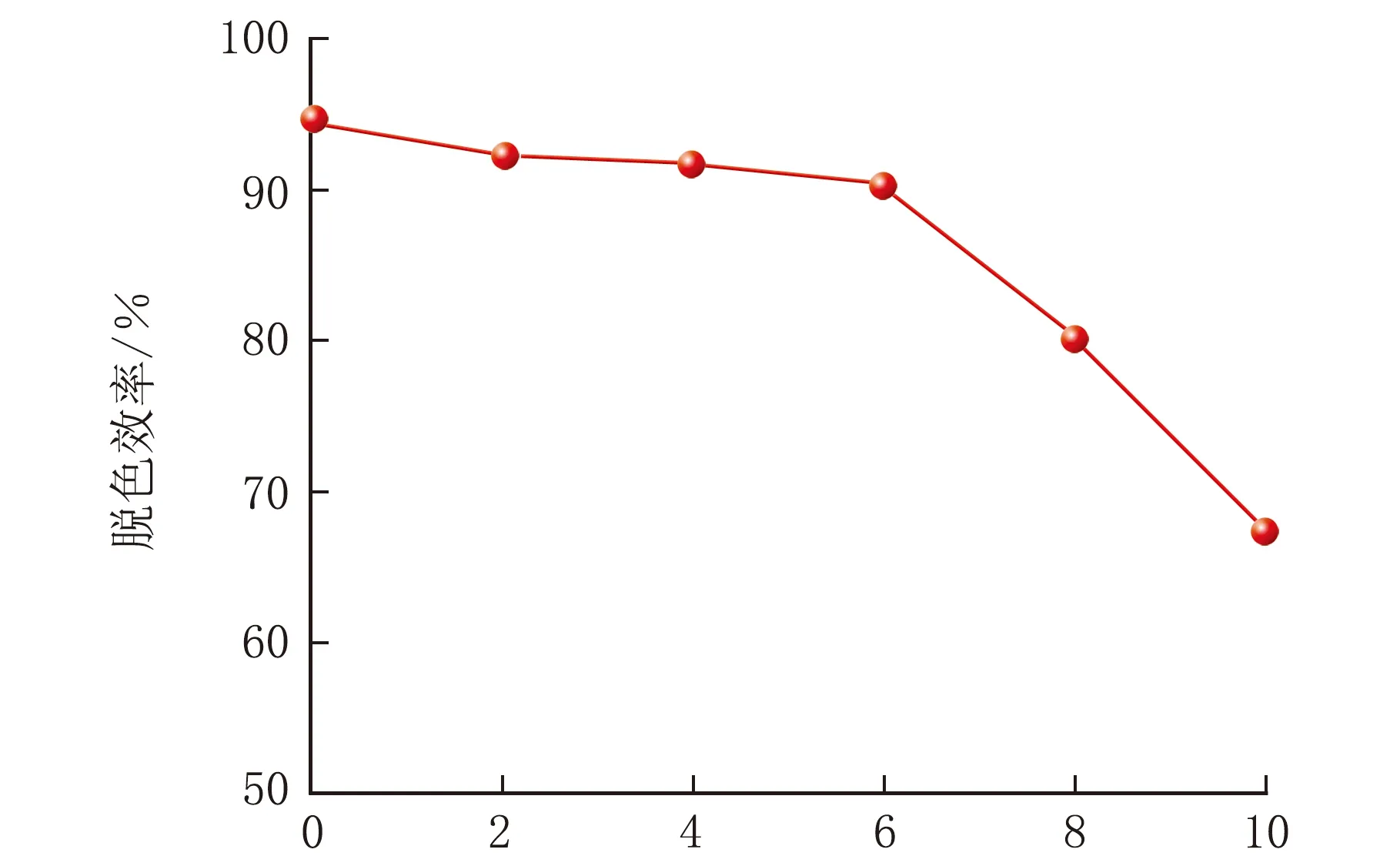
w(盐度)/%图8 盐度对亚甲基蓝脱色效率的影响
由图8可知,随着盐度的逐渐升高,青霉菌对亚甲基蓝的脱色效率逐渐降低,下降趋势明显,说明盐度可能抑制青霉菌P1对亚甲基蓝的脱色作用。盐度w(NaCl)=6%,脱色效率为90.3%,说明青霉菌P1具有耐受高盐度的能力,在实际处理染料废水的过程中具有应用价值[11-12]。
2.3 青霉菌P1脱色亚甲基蓝的机理探究
2.3.1 青霉菌P1脱色亚甲基蓝的实验机理探究
青霉菌P1脱色亚甲基蓝的实验机理探究结果见表1。

表1 青霉菌P1脱色亚甲基蓝前、后机理的实验探究
由表1可知,1#瓶随着时间的增加,青霉菌P1孢子不断增长,对亚甲基蓝的脱色效率也逐渐增加;2#瓶表明这些酶类确实能使亚甲基蓝脱色。结合1#瓶、3#瓶和4#瓶,48 h两者的差值为青霉菌P1吸附亚甲基蓝的效率20.27%。说明在该脱色过程中,亚甲基蓝的脱色是生物降解和生物吸附共同作用的结果。
2.3.2 青霉菌脱色亚甲基蓝前、后的紫外图谱分析
青霉菌P1脱色亚甲基蓝前、后的紫外谱图见图9。

λ/nm图9 青霉菌P1脱色亚甲基蓝前、后的紫外谱图
由图9可知,未处理的亚甲基蓝染料分别在波长为291和660 nm有特征吸收峰(其中660 nm为最大吸收波长),经过5 d脱色处理后,660 nm的吸收峰明显下降。由文献可知[13],微生物脱色亚甲基蓝的方式有生物吸附和生物降解2种,生物吸附过程中紫外谱图的吸收峰具有同步降低的现象,生物降解过程中紫外谱图会具有主吸收峰的消失并出现新吸收峰的现象。青霉菌P1脱色亚甲基蓝的紫外谱图有明显波形变化,并且有新的吸收峰出现,可以判断脱色过程是由降解作用引起的。由青霉菌P1脱色亚甲基蓝前、后的紫外谱图对比,可以看出亚甲基蓝的分子峰发生蓝移,具有减色效应,660和291 nm的2个明显的吸收峰分别对应发色基团(—S—)吸收峰和苯环(吩噻嗪结构)吸收峰。由此猜测,在降解过程中,发色基团断链,降解后中间产物的苯环数相对于亚甲基蓝的苯环数有所增加,或中间产物具有吩噻嗪结构[14-15]。
2.3.3 青霉菌脱色亚甲基蓝前、后的红外谱图分析
青霉菌脱色亚甲基蓝前、后的红外谱图分析见图10。

σ/cm-1图10 青霉菌P1脱色前、后代谢物的红外谱图

3 结 论
实验从染料废水中筛选出青霉菌P1(PencillumexpansumKU162972),探究不同因素对青霉菌脱色亚甲基蓝脱色效率的影响,并且利用紫外分光光度计和傅里叶红外光谱探究青霉菌P1对亚甲基蓝的脱色机理。
(1)考察不同因素对青霉菌P1脱色亚甲基蓝脱色效率的影响,在ρ(亚甲基蓝)=20 mg/L、接种量φ(青霉菌孢子)=4%、pH=4和盐度w(NaCl)=2%条件下,亚甲基蓝的脱色效率可达92.33%;
(2)由紫外光谱分析可知,青霉菌脱色亚甲基蓝的紫外谱图有明显波形变化并且有新的吸收峰出现,可判断脱色过程具有生物降解作用;
(3)由红外光谱分析可知,亚甲基蓝和代谢物红外光谱的差异表明亚甲基蓝的结构部分发生了转化,与之前实验探究机理和紫外光谱分析相同,说明亚甲基蓝脱色过程是生物降解和生物吸附共同作用的结果。

