工程酵母助力真菌嵌合萜类合酶的快速系统挖掘
范震,潘海学,唐功利
(1 中国科学院大学杭州高等研究院,化学与材料科学学院,浙江 杭州 310024;2 中国科学院上海有机化学研究所,生命有机化学国家重点实验室,上海 200032)
萜类是自然界中数量最庞大的一类天然产物,至今已有超过10 万种[1-2]。萜类存在于所有生命领域中,在植物、真菌和海洋无脊椎动物中最为普遍,萜类化合物在防御、调节和信息交流等方面发挥着重要作用,并被广泛用作药物、香料和调味品等[3-4]。尽管萜类数量庞大且结构多样,但所有的萜类天然产物骨架都由五碳结构单元二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)和异戊烯基焦磷酸(isopentenyl pyrophosphate,ⅠPP)缩合形成,因此萜类也被称为类异戊二烯类化合物[2]。五碳结构单元DMAPP和ⅠPP在异戊烯基转移酶(PT)的催化下,以常规的头尾连接的方式缩合成不同长度聚异戊二烯基焦磷酸,如FPP(farnesyl diphosphate)、GPP(geranyl diphosphate)、GGPP(geranylgeranyl diphosphate)、GFPP(geranylfranesyl diphosphate)(图 1)[2]。除此之外,PT 还可以催化非常规类型的类异戊二烯焦磷酸的缩合,如以非头尾连接方式的碳链缩合[5],顺式(Z型)双键的碳链缩合[6]等,因评论的工作中不涉及该类PT,本文对此不做过多的评述。萜类合酶(TS)利用PT 合成的链状前体合成萜类的基本骨架,在萜类化合物的形成和萜类结构的多样性中发挥了至关重要的作用[2]。PT 和TS 负责形成的萜类基本骨架,再经过各种修饰,如氧化、官能团引入等,最终生成更加多样的萜类产物。
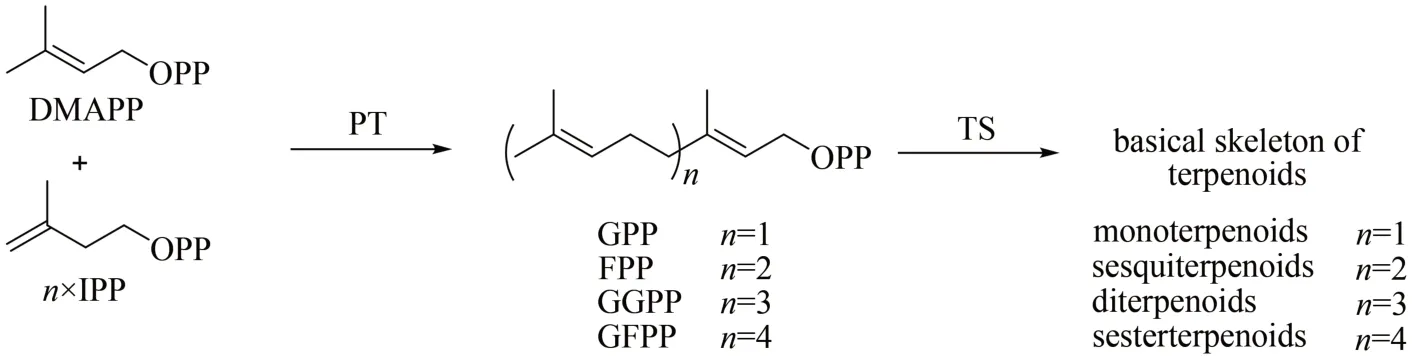
图1 异戊烯基转移酶(PT)和萜类合酶(TS)催化萜类基本骨架形成的简略过程Fig.1 Formation of terpenoid skeletons through the catalysis by isopentenyl transferase(PT)and terpene synthase(TS)
TS 催化萜类基本骨架形成过程中,首先形成高活性的碳正离子中间体,从而引发环化串联反应,该环化串联反应也是自然界中最复杂的反应之一[2]。根据TS起始引发碳正离子形成策略的不同,将TS 分为Ⅰ型和Ⅱ型[2]。Ⅰ型萜类合酶含有富含天冬氨酸(Asp)和与金属阳离子配位的两个保守基序DDXXD/E和(N,D)XX(S,T)XXXE,金属离子通过结合聚异戊二烯基焦磷酸链状前体的焦磷酸基团来固定底物,同时促进前体烯丙基焦磷酸基的C—O 键的电离,从而产生高活性的碳正离子中间体,进而引发环化串联反应[图2(a)]。而Ⅱ型萜类合酶通常仅含有呈酸性的DXDD 保守基序,通过其中的Asp 残基将异戊二烯基中的双键质子化,生成引发环化反应的碳正离子中间体[图2(b)][7-9]。

图2 Ⅰ型和Ⅱ型萜类合酶(TS)催化环化的过程的两例Fig.2 Two cases for cyclization catalyzed by TypeⅠand TypeⅡterpene synthases(TSs)
通常情况下TS和PT单独行使其功能,但在一些酶中两个(TS 和PT/TS)活性结构域同时存在,构成可连续反应的两个独特活性位点,因此赋予这些酶双功能性[10]。目前发现的双功能萜类合酶有:Ⅰ型TS+Ⅱ型TS 酶,Ⅱ型TS+PT 酶,Geosmin合成酶,以及Ⅰ型 TS+PT 酶(图 3)[10]。在理论上,这些双功能酶两个活性位点空间上是相互接近的,因此具有增加产物量的优势[10-12]。

图3 4种嵌合萜类合酶催化反应范例Fig.3 Catalytic reactions of 4 chimeric terpene synthases
真菌特有的嵌合萜类合酶(PTTS)指的是Ⅰ型TS+PT 酶,包括一个C 端PT 结构域和一个N 端Ⅰ型TS 结构域。这些PTTS 可以直接利用ⅠPP和DMAPP 作为共底物形成二萜和二倍半萜骨架[10,13]。自嵌合二萜合酶 PaFS 和嵌合二倍半萜合酶 AcOS 发现 以来[14-15], 仅有 约 20 个 PTTS 被报道,并且PTTS 催化生成的化合物大多具有新颖的碳骨架。根据其催化环化的机制,可将PTTS 分为A 型和 B 型,A 型是在 GFPP 的 C1-C11/C10-C14 之间环化(C1-Ⅳ-Ⅴ),形成5~15环系统,B型是在GFPP 或 GGPP 的 C1-C15/C14-C18 处环化 (C1-Ⅲ-Ⅳ),而生成5~11环系统(图4)[13]。
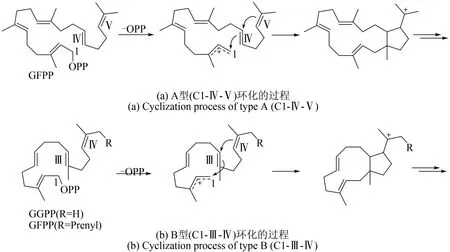
图4 PTTS催化的两种环化类型Fig.4 Two cyclization reactions catalyzed by PTTS
随着基因组测序技术的发展,需要功能鉴定的PTTS 数量不断增加,对PTTS 研究产生了一些有待回答的问题,如PTTS 在真菌中是广泛分布的还是局限于某些特定的群体,以及哪些机制控制着PTTS 的功能进化等,回答这些问题需要对大量的 PTTS 进 行 功 能 表 征[16]。 虽 然 米 曲 霉(Aspergillus oryzae)已经被广泛应用于真菌基因的异源表达,且该体系表征过多种丝状真菌来源的PTTS[17-18],然而受限于米曲霉复杂的遗传操作、较长的培养周期,这个系统不适合大量未知PTTS功能的快速验证。高效萜类前体供给的大肠杆菌和酿酒酵母底盘,为法尼烯、紫杉二烯和青蒿酸[19-21]等的大量生产提供了有效的途径。此外,以代谢工程改造的酵母来进行药物核心结构骨架的生产,随后经过简单的化学后修饰可合成最终药品,极大简化了药物化学合成的过程(图5)[22-23]。最近武汉大学刘天罡教授课题组与美国田纳西大学陈峰教授课题组合作,使用高产萜类前体的酵母系统和高通量自动化平台实现了对PTTS 功能的快速验证[16]。
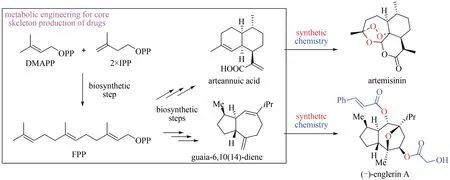
图5 代谢工程结合化学合成的方法合成青蒿素和(-)-englerin AFig.5 Synthesis of artemisinin and(-)-englerin A by metabolic engineering combined with synthetic chemistry
首先,合作团队系统分析了NCBⅠ和UniProt数据库中所有真菌来源的基因以及JGⅠ数据库中已经测序的477 种真菌的基因组,共找到了227 个PTTS 同源基因,其中包括已经鉴定功能的20 个PTTS基因。对这227个PTTS同源基因的生物信息学分析发现,PTTS 基因只存在于双核菌亚界(Dikarya),其中224 个分布在子囊菌(Ascomycota)中, 另外 3 个 PTTS 基因存在于担子菌(Basidiomycota)的一个种中。由此作者推测,PTTS 基因起源于双核菌亚界,担子菌中PTTS 基因的缺失,很可能是在进化过程中经历了频繁的基因丢失导致的;另一种可能性是PTTS 基因起源于子囊菌,担子菌中某些菌含有的PTTS 基因是通过基因的水平转移获得的。为了进一步了解这些基因进化的关联性,研究者对227 个PTTS 基因进行了系统的进化分析。前期研究报道,PTTS 可分为 6 个分支(A~F)[10],处于 A、E 和 F 亚家族中的基因形成CladeⅠ,催化GFPP的A型(C1-Ⅳ-Ⅴ)环化,其余亚家族的基因形成Clade Ⅱ,催化GGPP 或 GFPP 的 B 型(C1-Ⅲ-Ⅳ)环化[10]。考虑到之前研究PTTS 数量较少,信息不够全面,作者对得到的PTTS 做了更全面的进化分析,结果显示支持前期研究结果。并且进化分析的结果显示,在A~F 这6 个PTTS 亚家族中,每个亚家族都有90%以上的PTTS 基因功能是未知的,表明对PTTS生化功能认识上还存在很大的不足[16]。
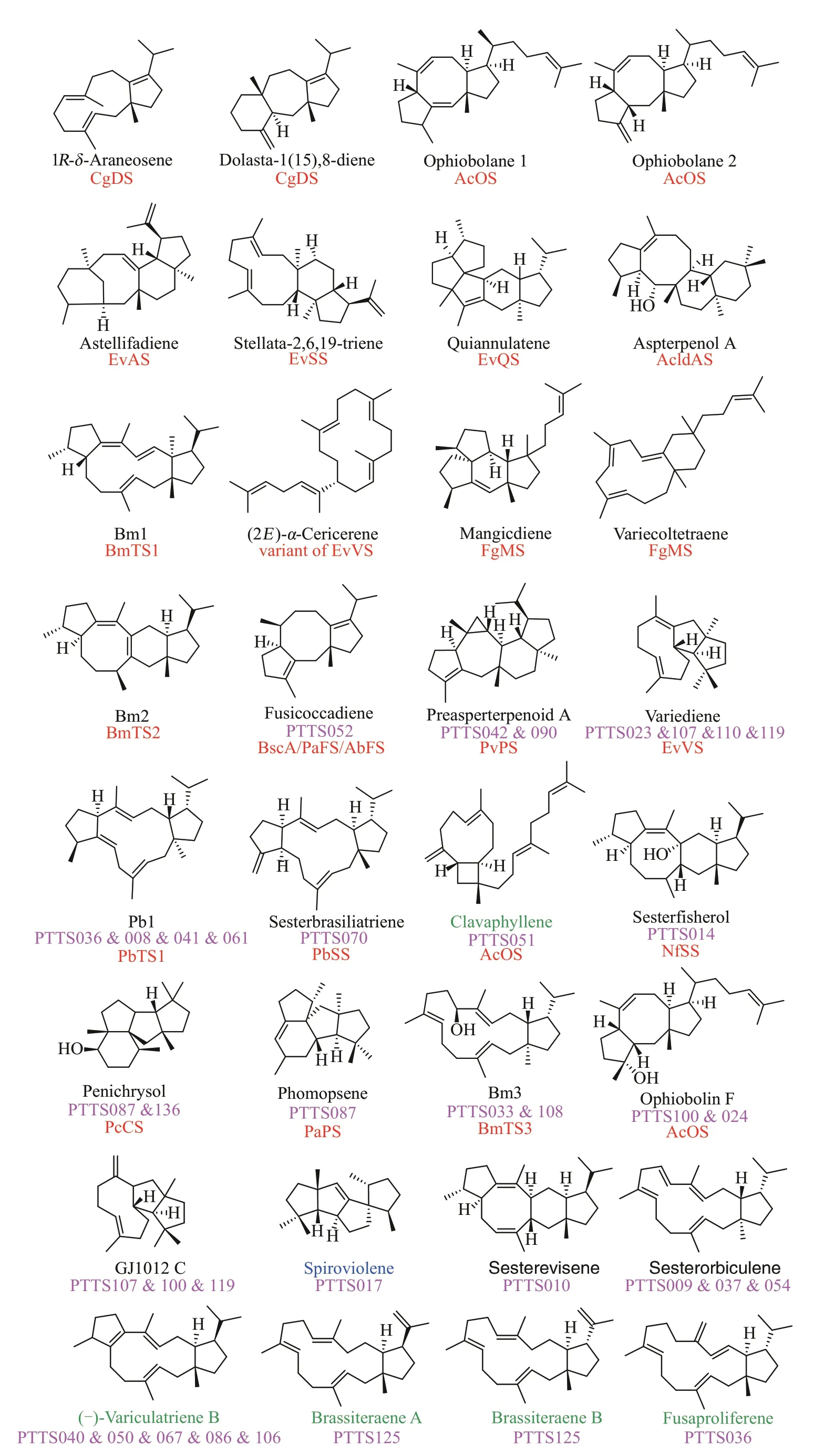
为了获得更多的PTTS 催化功能信息,合作团队对上述PTTS 进行了功能鉴定。首先依据氨基酸(aa)序列长度(约700 aa)、序列相似性(<80%)、TS 结构域 DDXXD/E 和 NSE/DTE 以及 PT 结构域DDXXD/N 的保守序列这些特征,对PTTS 进行了筛选,从中选出了74 个PTTS。因已报道的20 个PTTS 主要催化二倍半萜的产生,因此研究者在实验室前期构建的高产萜类化合物的酿酒酵母Saccharomyces cerevisiaeYZL141 的基础上[11],又过量表达了GFPP 合成酶和PTTS,构建了一个高产二倍半萜的酵母底盘。该底盘一方面增加了GFPP 的代谢通量,使得嵌合的二倍半萜合酶的功能可得到快速鉴定,另一方面有助于释放嵌合的二萜合酶利用GFPP 的潜力,使得嵌合的二萜合酶在合成二萜的同时还可合成二倍半萜。此外,他们利用高通量自动化平台批量构建了74个PTTS的酵母工程菌株,该平台的应用大大加快了PTTS 功能鉴定的进程。利用上述代谢工程策略,合作团队成功鉴定34个新的有功能的PTTS(图6),鉴定的PTTS 的数量超过了目前已知功能PTTS 的总数。从34 个PTTS 的酵母工程菌株中共鉴定了24 个二萜和二倍半萜产物(图6),其中2个是结构新颖的二倍半萜 sesterevisene 和 sesterorbiculene。24 个产物中有11个是已报道的PTTS的产物(图6),这表明这类酶在功能上进化的一致性。有5个产物是已报道的植物来源二倍半萜合酶的产物(图6),有1 个产物是链霉菌(Streptomyces violens)来源的二萜合酶产物(图6),显示了真菌、植物和细菌的基因功能趋同进化的特征。54 种活性PTTS 共产37 种不同的萜类产物(图6),以及新化合物的发现和链状产物的产生(图6)都表明PTTS 在进化过程中蛋白质序列的变化导致其功能多样性。

图6 54个PTTS催化合成的萜类化合物及其结构Fig.6 Terpenoids and their structures synthesized under the catalysis of 54 PTTSs
采用酵母底盘细胞对PTTS 的起源和功能进化进行的系统研究,为读者清晰地呈现了真菌特有的这类PTTS 在真菌中存在和进化的基本样貌,描述了这类酶催化功能的多样性,并且大大扩充了这类酶家族成员的数量以及萜类产物库,为后续的萜类合成生物学研究提供了丰富的基因元件,也为相关基因簇的挖掘奠定了坚实的基础。另外,该研究不仅为以酵母为底盘进行萜类化合物的挖掘提供了一个可借鉴有效的方法策略,而且也是将天然产物的发现从原始的自然界生物材料中鉴定,转变为从网络基因信息挖掘到人为设计实现生产的一个成功范例。
——结构和生物活性

