大黄防治前列腺癌的质量标志物研究及分子对接验证
朱闽 彭杰 蒋越 买鹏宇 张禹姝


摘要 目的:基于整合藥理学和分子对接技术预测大黄防治前列腺癌可能的质量标志物。方法:通过中医药整合药理学网络计算研究平台V2.0(TCMIP V2.0),将大黄化学信息进行靶标预测,与前列腺癌疾病靶标信息进行蛋白质-蛋白质相互作用(PPI)网络构建,从而开展药物干预疾病的关键靶标富集分析。在此基础上,利用大黄的化学成分、关键靶标、疾病通路的多维网络,绘制中药“成分-靶标-通路-疾病”网络图,解析获得作用于这些关键靶标的主要成分,然后依据中药质量标志物(Q-marker)“五原则”结合已知相关文献对大黄防治前列腺癌的质量标志物进行预测分析。最后,应用AutoDock Vina分子对接软件对候选成分与关键靶点进行分子对接计算和验证。结果:筛选得到大黄防治前列腺癌的活性成分14个,关键核心靶标21个,涉及11条信号通路。分子对接表明雄激素受体(AR)与大黄蒽醌类中8个均入最佳药物油水分配系数范围的成分有较好的结合性。结论:通过TCMIP V2.0及前期文献研究基础上,分析并获得大黄防治前列腺癌可能的质量标志物为大黄蒽醌类化合物,具体成分包括大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚等,对药物和疾病的共同靶标AR产生药理作用。
关键词 大黄;前列腺癌;质量标志物;中医药整合药理学网络计算研究平台2.0;分子对接;中药
Abstract Objective:To predict the possible quality markers of Radix et Rhizoma Rhei in the prevention and treatment of prostate cancer based on integrated pharmacology and molecular docking techniques.Methods:Through the integrated pharmacology research platform V2.0(TCMIPV2.0) of traditional Chinese medicine,the chemical information of Radix et Rhizoma Rhei was predicted,and the protein interaction(PPI) network was constructed with the disease target information of prostate cancer,so as to carry out the enrichment analysis of the key targets of drug intervention.On this basis,we used the multi-dimensional network of chemical components,key targets,and disease pathways of Radix et Rhizoma Rhei,draw the network diagram of “component-target-pathway-disease” of Chinese medicinal,analyzed and obtained the main components acting on these key targets,and then base on the quality mark of traditional Chinese medicinal,the “Five Principles” of Q-marker combined with known related literature were used predict and analyze the quality markers of Radix et Rhizoma Rhei in preventing and treating prostate cancer.Finally,the AutoDock Vina molecular docking software was used to calculate and verify the molecular docking of candidate components and key targets.Results:A total of 14 active components of Radix et Rhizoma Rhei against prostate cancer,21 key core targets and 11 signal pathways were screened.Molecular docking showed that there was a good binding between AR and 8 components of Radix et Rhizoma Rhei anthraquinones which were all in the range of optimal oil-water partition coefficient.Conclusion:Based on the integration of pharmacological V2.0 platform and previous literature research,the possible quality markers of Radix et Rhizoma Rhei in the prevention and treatment of prostate cancer are Radix et Rhizoma Rhei anthraquinones,including emodin,Rhein,chrysophanol,aloe-emodin,emodin methyl ether,etc.,which have pharmacological effects on AR of the common target of drugs and diseases.
Keywords Radix et Rhizoma Rhei; Prostate cancer; Quality marker; TCMIP V2.0; Molecular docking; Chinese medicine
中图分类号:R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.20.007
大黄为蓼科植物掌叶大黄、药用大黄及唐古特大黄的干燥根和根茎,性味苦寒,归脾、胃、肝、大肠、心包经,主泻下攻积、逐瘀通经、清热泻火、凉血解毒、利湿退黄[1]。大黄又称为“将军”,逐瘀泻热、推陈致新是其主要功效,可用于治疗积滞便秘、血闭寒热、癥瘕积聚等[2]。在中医学中,前列腺癌为本虚标实之证,脏腑亏虚为本,湿热、痰浊、瘀血、气滞为标,且认为该病主要脏腑病变责之于肾和膀胱[3]。基于中医学对前列腺癌发病机制的认识,祛瘀消癥治法可广泛应用于前列腺癌疾病治疗。而大黄作为常用的祛瘀消癥药材,也经常用于治疗前列腺癌。现有相关文献报道大黄对前列腺癌有较好的治疗效果,有研究显示,从大黄中提取的大黄素能诱导人前列腺癌细胞(LNCaP)凋亡,通过雄激素受体(AR)和P53-P21线粒体途径抑制增殖,有效抑制癌细胞转移及再生,在癌细胞DNA损伤过程中起到良好的修复作用[4-5]。
尽管大黄治疗前列腺癌具有确切疗效,但作为常用的大宗药材之一,由于产地不同,大黄种植质量控制、田间管理技术及产品加工方法有差异,故市场来源不同大黄的有效成分差异较大[6]。药材品质资源混乱,其质量难以得到保证,会直接或间接影响疾病的治疗效果。为了有效整治这一现状,近年来由刘昌孝院士提出了“中药质量标志物”及其五原则概念,即通过药材成分的有效性、特有性、传递与溯源、可测性、配伍环境5个方面评价和把控药材的质量标志物[7]。目前,整合药理学已被广泛应用到中药与方剂及机体之间的药效基础、分子机制等方面,且能在一定程度上对中药质量标志物进行发掘和深入确证[8-9]。中医药整合药理学研究平台的构建,更为整合药理学“多靶点、多层次、多环节”策略提供强有力的数据基础与分析工具[10]。基于此,本研究依据中药质量标志物(Q-marker)“五原则”方法,并借助中医药整合药理学网络计算研究平台V2.0(TCMIP V2.0),结合现代药理文献对大黄防治前列腺癌的质量标志物和其活性成分与关键靶标蛋白进行模拟结合研究。
1 资料与方法
1.1 数据来源 中医百科全书数据库(http://www.ehbio.com/ETCM/)是TCMIP V2.0的数据来源[11]。本研究基于TCMIP V2.0(http://www.tcmip.cn/TCMIP/index.php/Home/)“中药材数据库”“中药靶标数据库”“中药成分数据库”及“疾病相关分子库”等数据库。其中,中药靶标预测及功能分析、疾病相关分子集及功能挖掘数据来源于“基因相关性数据库”(DisGeNET)、基因本体(Gene Ontology)数据库、“人类表型本体”(HPO)数据库、“DrugBank数据库”“治疗靶标数据库”(TTD)、OMIM(Online Mendelian Inheritance In Man)等资源数据平台。在蛋白质-蛋白质相互作用(PPI)网络信息中,TCMIP V2.0容纳了DIP、HAPPI、HPRD、In Act、MINT、OPHID、PDZ Base、Reactome等生物分子相互作用数据库。通过计算网络节点的3种拓扑结构特征值,即连接度(Degree)、介度(Betweenness)和紧密度(Closeness),筛选网络中的核心节点基因,并实现核心节点网络的可视化。在获得目标中药关键网络靶标基因集的基础上,进一步开展生物学功能及通路的富集分析。
1.2 基于“成分-靶标-通路-疾病”挖掘大黄防治前列腺癌有效成分 中药质量标志物的核心因素是“有效性”。针对药材中“成分-靶标-通路-疾病”之间的关联性,TCMIP V2.0可任意选定不同类别的节点,建立中药多维关联网络,实现对作用于核心靶标的大黄化学成分的可视化操作,进而获得与有效性相关的成分。
在TCMIP V2.0的中药材数据库中,以“大黄”为关键词进行搜索,得到关于大黄的化学成分及其相关对应的所有靶标。然后在中药靶标预测功能模块中,根据二维结构相似性(MACCS分子指纹)进行检索,对Tanimoto系数定义进行相似度打分,并与美国食品药品监督管理局(FDA)上市药物的相似度进行比对,从而获取高可信度(Similar Score≥0.8)的大黃候选靶标谱。
在TCMIP V2.0的疾病数据库中,以“Prostate Cancer”为关键词进行搜索,可得到与前列腺癌相关的靶点。
根据中药(大黄)候选靶标和目标疾病(前列腺癌)基因之间的互作信息,可建立“中药-疾病”关联网络。基于药材中“成分-靶标-通路-疾病”之间的关联性,任意选定不同类别的节点,建立有关中药的多维网络图,并进一步挖掘获得大黄防治前列腺癌的可能有效成分,初步完成大黄防治前列腺癌关键靶标及质量标志物的筛选。
1.3 基于大黄成分分析质量标志物 中药质量标志物的必备条件是“可测性”。结合已知相关文献对大黄的含量检测情况,并按照TCMIP V2.0对初步筛选出的大黄有效成分进行整理。
中药质量标志物原则之一的“特有性”主要表现为2个层次:一方面是发掘能代表与反映同种药材的共有性并有别于其他药材的特有性成分,另一方面是能深入反映同一类药材中所含成分的差异性,包括定性和定量2个层次[12]。本研究首先从大黄有别于其他药材的特征性成分即大黄蒽醌类化合物开展研究,其次从不同品种、产地、年限及部位的主要活性化合物大黄蒽醌类含量差异进行比较确定大黄的质量标志物。
1.4 基于大黄成分传递与溯源确定质量标志物 通过TCMIP V2.0中的中药成分数据库,本研究初步筛选可能作为大黄质量标志物的有效成分,整理其相关理化性质,包含平衡溶解度和油水分配系数[13],并在临床复方用药配伍及工艺研究等方面进一步证实大黄防治前列腺癌的质量标志物。
1.5 基于分子对接模拟结合关键靶标蛋白与候选质量标志物 通过PubChem网站(https://pubchem.ncbi.nlm.nih.gov/)检索获取候选质量标志物的SDF结构文件,并利用Open Babel 2.3.2软件将SDF文件转化为PDB文件,从Protein Data Bank(http://www.rcsb.org/pdb)数据库中检索获得关键靶标蛋白PD BID,利用PYMOL 2.3.4软件对关键靶标蛋白进行去水、去配体等操作。采用AutoDockTools软件对关键靶标蛋白进行加氢、平衡电荷等修饰,用Grid程序下的Grid Box命令打开Grid Option工具对关键靶标蛋白进行处理,配体结合口袋的大小由各个方向上格点的数目和格点间距共同决定,因此调整蛋白每个方向上格点的数目、结合口袋的中心以及格点的间距。首先将格点间距设为1,然后调整结合口袋体积使预对接的分子在其最伸展的状态下也能在盒子内转动,口袋中心即设定为结合位点中心,并将关键靶标蛋白和配体小分子分别转化为pdbqt格式。AutoDock Vina是由Scripps研究结构开发的开源分子对接软件,该软件采用的是拟牛顿方法进行局部优化,其打分函数结合了基于经验打分和知识打分函数的优点,将结果以一种亲和能(Affinity)的形式输出,通过计算受体-配体复合物的空间效果、排斥作用、氢键、疏水相互作用以及分子的灵活性等值综合打分,评估其亲和力,最终给出亲和能打分。这种亲和能是衡量配体是否能与受体分子有效结合的重要指标,是AutoDock Vina软件的核心参数,能值越低表示二者的结合效果越好。
2 结果
2.1 基于“成分-靶标-通路-疾病”挖掘大黄防治前列腺癌有效成分分析结果
2.1.1 药物靶标预测分析 在TCMIP V2.0中药(含方剂)靶标预测及功能分析模块中,获取高可信度(Similar Score≥0.8)的大黄及其化学成分相关对应的潜在靶标,结果得到大黄化学成分88种,主要为大黄蒽醌类、蒽酮类等。有研究显示,从大黄蒽醌类中提取的大黄素能通过下调趋化因子受体CXCR4的表达来抑制前列腺癌和肺癌细胞的侵袭和迁移[13]。动物实验结果表明,大黄素能够直接作用于前列腺癌模型裸鼠雄激素受体(AR)并促进其降解,从而对癌细胞的发生起到较好的预防作用[14]。大黄候选靶标有actⅢ、AR、ALOX5、CSNK2A1、cyp158a2、CYP1A2、CYP2C9、CYP2D6、CYP2E1、CYP3A4、CYP3A43、CYP3A5、CYP3A7、fabZ、GSTA1、GSTP1、NR1H2、NR1H3、actVA_6、KRT12、KRT2、MAPK8IP1、PTGS1、PTGS2、SCO5081等。对大黄的预测靶标进行GO和Reactome pathway分析,候选靶标基因功能分析的生物过程涉及异源代谢过程、长链脂肪酸生物合成过程、单萜类代谢过程、药物分解代谢过程等,分子功能涉及氧化还原酶活性、血红素结合、铁离子结合、单加氧酶活性、芳香化酶活性等,细胞组分主要集中在细胞器膜、内质网膜、膜结合细胞器等方面。通路富集分析结果显示,涉及通路有异生物素途径、炎症消退介质反应、细胞色素酶反应、药物代谢酶系统、核受体转录途径等。
2.1.2 疾病靶点收集分析 在疾病相关分子集及其功能挖掘模块中,获得与前列腺癌相关疾病靶标71个,包括HSP90AA1、PTGS2、MMP14、NFKB2、MCL1、SPHK2、HPSE、MMP9、MMP2、MMP3、TP53、NTSR1、MAP3K4、MAP2K7、MAP2K1、MMP13、MMP12、HDAC4、PRKCA、ALOX15、CYP1B1、VDR、GNRH1、LHCGR、FGFBP1、NTRK1、AR、EGFR、TRPV6、NCOA4、NSD1、PSCA、SLC7A1、BDKRB1、FOLH1、STEAP2、KLK3、HPN、TGFβ1、LOX、IL13RA1、IL13RA2、TMPRSS2、OR51E2、TMBIM6、RXRA、USP2、GRN、SRD5A1、SRD5A2、TNFSF4、STEAP1、ENG、CLU、BARD1、BRCA1、BRCA2、BRIP1、CHEK2、KLF6、MAD1L1、MRE11、MSR1、NBN、PALB2、PTEN、RAD50、RAD51、RAD51C、RAD51D、RNASEL。
2.1.3 “药物-疾病”靶标核心网络分析 共获得44个与前列腺癌以及药材关联的核心网络靶标,并通过PPI功能模块构建“药物-疾病”核心网络靶标分析图(图1),设置卡值并同时满足大于其节点“连接度”“介度”“紧密度”的中位数,所得关键核心靶标21个,且大部分为药物潜在靶标(Putative drug Targets),如MMP2、TGFβ1、EGFR、MAP3K4等,已知疾病靶标2条,即AR、HSP90AA1,药物与疾病共有靶标2条,即AR、HSP90AA1。
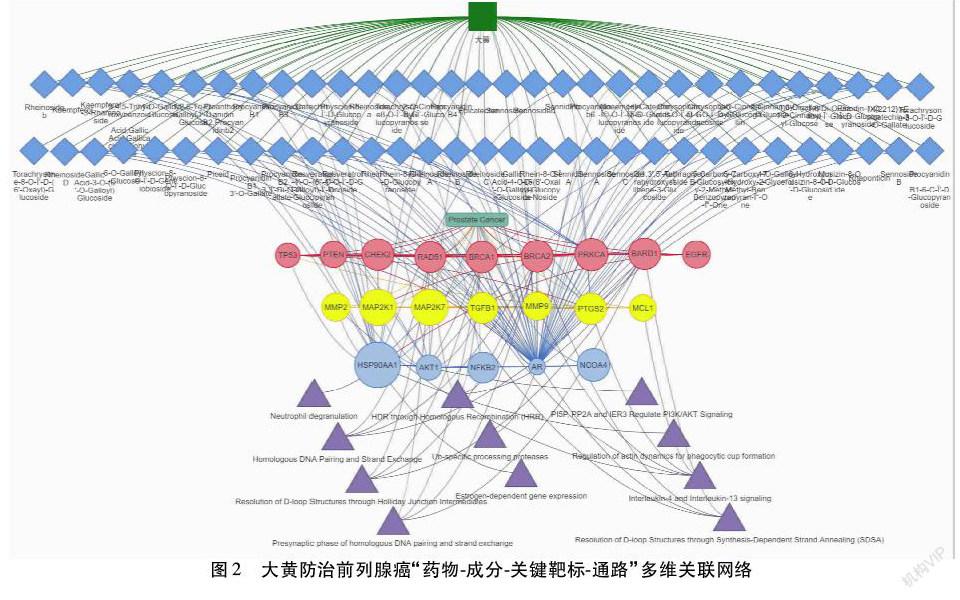
2.1.4 “药物-靶标-通路-疾病”网络可视化分析及大黄防治前列腺癌可能的质量标志物探讨 前期通过TCMIP V2.0获得大黄防治前列腺癌的关键核心靶标,可以推测大黄发挥药效的药理作用与其干预疾病的共同靶标有关,并在药物成分、药物靶标和疾病之间的关系中构建大黄防治前列腺癌“药物-成分-关键靶标-通路”多维关联网络图。由图2可知,大黄中含有多种有效成分,主要包括大黄蒽醌类,对药物和疾病的共同靶标AR产生药理作用,具体成分为RheinosideA、RheinosideB、RheinosideC、RheinosideD、Rhein-8-O-β-D-Glucopyranoside、Rhein-8-O-β-D-(6′-Oxalyl)-Glucopyra-Noside、Aloeemodin-8-O-β-D-Glucopyranoside、AnthraglycosideB、Emodin-1-O-β-D-Glucopyranoside、Chrysophanol-8-O-β-D-Glucopyranoside、Chrysophanol-1-O-β-D-Glucoside、Physcion-8-β-D-Glucopyranoside、Physcion-8-O-β-D-Gentiobioside、Physcion-8-O-β-D-Glucopyranoside,可基本归为大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚5大类(以下亦如此统称)。体内体外实验结果表明,大黄素通过上调LRP1基因对AR阳性表达下LNCaP细胞的生长产生抑制作用[15]。而大黄酸也可在AR阳性表达下激发LNCaP细胞产生S期阻滞,并显著降低cyclin A和CDK2的表达含量[16]。Lu等[17]采用大黄酚纳米囊调控细胞周期相关蛋白,包括P27、CHK1、cyclin D1、CDK1、P-AMP等活化蛋白激酶(AMPK)和P-蛋白激酶B(AKT),以防止LNCaP细胞在AR阳性表达下增殖并诱导其凋亡。芦荟大黄素通过AR阳性表达下抑制PKCα-AKT-mTORC2及其下游底物的活化,從而有效控制前列腺癌模型裸鼠体内肿瘤细胞PC3的增长趋势[18]。白凤等[19]、李斌鑫等[20]利用网络药理学方法筛选出蒙药复方协日嘎-4的有效成分大黄素和大黄素甲醚,然后对蒙药靶向调控前列腺癌AR等多个受体进行分子对接且发现结合能较低,从而有力阐明该药治疗前列腺癌的效应物质基础。
2.2 基于大黄成分探讨质量标志物的分析结果 2015年版《中华人民共和国药典》规定的大黄含量测定的成分以游离蒽醌类为主,其中有芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚[1]。刘月红等[21]运用高效液相色谱法(HPLC)同时测定了大黄中14个成分含量,主要包括大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚、番泻苷A、番泻苷B、没食子酸、儿茶素、(-)-表儿茶素-3-没食子酸酯、异莲花掌苷、4-4′-羟基苯基-2-丁酮、莲花掌苷、4′-羟基苯基-2-丁酮-4′-O-β-D-(2″-O-桂皮酰基-6″-O-没食子酰基)-葡萄糖苷,为大黄药材多成分含量的测定及质量控制提供便利。屈义虎[22]经制备型高效液相色谱纯化测定得到药用大黄主要5个游离型蒽醌单体,分别为芦荟大黄素(99.26%)、大黄酸(98.47%)、大黄素(98.65%)、大黄酚(99.75%)、大黄素甲醚(92.31%),并经与标准品比对得到药用大黄主要2个结合型蒽醌单体,分别为大黄素-8-O-β-D-葡萄糖苷(97.65%)和大黄酸-8-O-β-D-葡萄糖苷(98.32%)。说明大黄中主要活性成分大黄蒽醌类化合物具有高强度的专属性和药理活性,并易通过HPLC法测定,可将其视作大黄质量标志物。
其一,大黄含有多种有效活性成分,如游离蒽醌类、鞣质类、蒽醌苷类等[23]。大黄的主要活性成分大黄蒽醌类化合物在抗炎、抗肿瘤、抗纤维化、保护心脑血管以及多个器官组织等方面效果显著,是大黄发挥药理作用的特征性成分[24]。其二,由于大黄来源存在差别,而不同来源的大黄质量差异较大。有学者采用超高效液相色谱法(UPLC)对3个不同品种的大黄对照药材及不同产地的21批市售大黄饮片建立指纹图谱,结果发现掌叶大黄和唐古特大黄整体色谱峰具有数量多、面积大的特点,而药用大黄色谱峰较少且面积小,且其饮片成分含量也随着产地来源、采收及加工等影响而有一定差异[25]。又有学者以2015年版《中华人民共和国药典》规定的5种游离蒽醌化合物为基础,结合现有文献分析研究1、2、3年生药用大黄根、根茎、叶片中10种有效活性成分的含量和变化规律并建立HPLC图谱,结果显示同一部位大黄的多数成分含量越高,生长年限越长,且同一年份大黄叶片多数成分含量低于根或根茎,而3年生大黄根及根茎的总蒽醌含量最高(0.32%),说明大黄蒽醌类能较好适应该基地的生态环境[26]。另有研究表明,同一产地相同年限的掌叶大黄与唐古特大黄游离蒽醌含量差异较大,5年栽培大黄与野生大黄的游离蒽醌总量相近(均高于2.0%),且芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量之间均有一定差异,而3年栽培大黄的游离蒽醌总量为0.64%~1.40%,离药典标准仍有不小差距[27]。
综上所述,大黄蒽醌类中大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚可能是大黄治疗前列腺癌的质量标志物。
2.3 基于大黄防治前列腺癌质量传递与溯源的质量标志物分析结果 研究在前期TCMIP V2.0网络可视化分析中获得了大黄和前列腺癌的共同靶标AR产生药理作用的14个有效活性成分,并结合中药成分数据库,查询得到上述有关大黄蒽醌类中5个有效活性成分的常见理化性质如药物油水分配系数,具体参考数据见表1。通过该平台运用Pipeline Pilot software(version 7.5)计算获得分子溶解度(Molecular Solubility)和药物在体内的吸收水平(ADMET Absorption Level),药物油水分配系数由AlogP和logD值表示,在药物没有进行电离下,AlogP≈logD。目前公认的药物油水分配系数logP值最佳范围为-1 2.4 基于分子对接针对关键靶标与候选质量标志物分析结果 为了进一步验证前列腺癌中大黄靶点的候选质量标志物,利用AutoDock Vina 1.1.2软件对关键靶标蛋白AR(PDBID:5V8Q)与以上8个配体小分子(AnthraglycosideB、Emodin-1-O-β-D-Glucopyranoside、Chrysophanol-1-O-β-D-Glucoside、Chrysophanol-8-O-β-D-Glucopyranoside、RheinosideB、Aloeemodin-8-O-β-D-Glucopyranoside、Physcion-8-O-β-D-Glucopyranoside、Physcion-8-β-D-Glucopyranoside,以下分别对应简称01~08配体小分子)分别进行分子对接验证。图3A.AR与01配体小分子之间的结合模式,氨基酸残基Thr755、Trp751、Glu681与01配体小分子形成氢键相互作用,氨基酸残基Pro801、Phe804、Pro682、Gly683、Gln711、Val684、Arg752与01配体小分子形成疏水相互作用。图3B.AR与02配体小分子之间的结合模式,氨基酸残基Glu678、Glu681、Trp751、Gly683、Gln711与02配体小分子形成氢键相互作用,氨基酸残基Val684、Pro682、Pro801、Lys808、Arg752、Ala748与02配体小分子形成疏水相互作用。图3C.AR与03配体小分子之间的结合模式,氨基酸残基Val685、Gly683、Glu678、Trp751与03配体小分子形成氢键相互作用,氨基酸残基Pro682、Glu681、Leu805、Pro801、Phe804、Arg752、Tyr763、Pro766、Val684与03配体小分子形成疏水相互作用。图3D.AR与04配体小分子之间的结合模式,氨基酸残基Gly683、Glu681、Trp751、Thr755与04配体小分子形成氢键相互作用,氨基酸残基Val684、Gln711、Pro682、Phe804、Pro801、Ala748、Arg752与04配体小分子形成疏水相互作用。图3E.AR与05配体小分子之间的结合模式,氨基酸残基Thr755、Trp751、Glu681、Gln711与05配体小分子形成氢键相互作用,氨基酸殘基His714、Val715、Pro682、Gly683、Lys808、Phe804、Arg752、Val684与05配体小分子形成疏水相互作用。图3F.AR与06配体小分子之间的结合模式,氨基酸残基Trp751、Thr755、Glu681、Gln711、Gly683与06配体小分子形成氢键相互作用,氨基酸残基Val685、Val684、Pro682、Ala748、Arg752、Phe804、Pro801与06配体小分子形成疏水相互作用。图3G.AR与07配体小分子之间的结合模式,氨基酸残基Glu678、Trp751与07配体小分子形成氢键相互作用,氨基酸残基Glu681、Pro682、Gly683、Val684、Pro766、Tyr763、Arg752与07配体小分子形成疏水相互作用。图3H. AR与08配体小分子之间的结合模式,氨基酸残基Tyr763、Gly683、Glu678、Trp751与08配体小分子形成氢键相互作用,氨基酸残基Val684、Pro682、Glu681、Leu805、Pro801、Phe804、Thr755、Arg752、Pro766与08配体小分子形成疏水相互作用。本研究选择关键靶标蛋白AR是因为在“药物-成分-关键靶标-通路”多维关联网络中处于关键位置,同时它参与了多条重要通路,提示其在前列腺癌对大黄化合物的反应中可能起关键作用。分子对接结果分析见表2,靶蛋白和对应的化合物分子的得分小于-7,表明靶蛋白和化合物分子之间结合点位较好,同时根据分子对接分析成功地预测了大黄蒽醌类中8个均入最佳药物油水分配系数范围的化合物与该被测靶蛋白AR亦具有较好的结合性。总体表明,这些结果进一步证明AR在前列腺癌中作为大黄蒽醌类化合物的治疗靶点。
3 討论
前列腺癌是指前列腺发生的上皮恶性肿瘤,常见于60岁以上老年男性。尽管我国前列腺癌的发病率与西方国家相比较低,但随着生活水平的提高和生存环境的改善,最新流行病学统计显示近年来呈增长趋势[30]。前列腺癌的发病机制尚不明确,转移途径可经局部、淋巴和血行,目前临床治疗方法主要包括药物治疗、手术治疗、化学治疗、放射治疗、冷冻治疗等,但每种治疗方法都存在其局限性,因此寻找新的治疗药物和手段具有积极意义[31]。中医药在前列腺癌的诊治方面颇具特色,不良反应率低,具有一定的临床安全性,如健脾利湿化瘀方对人前列腺癌C4-2细胞抑制增殖作用显著,且大黄在复方中起着化瘀消癥的功效[32]。然而中医药具有“多靶点、多层次、多环节”的作用,即各种化学成分联合起效的特点,故其治疗疾病的具体分子机制和质量标志物难以被分析挖掘。本研究通过TCMIP V2.0平台预测大黄防治前列腺癌的有效成分及其潜在作用靶标,并依据中药质量标志物“五原则”结合文献对大黄防治前列腺癌的质量标志物进行预测分析,以求进一步探索前列腺癌与宿主的关系。
研究发现,大黄防治前列腺癌的质量标志物可能以大黄蒽醌类化合物为主。根据中药多维关联网络图分析,关于药物与疾病的共有靶标为AR和HSP90AA1,发现多数化学成分作用于前者,且前列腺癌与雄激素受体联系密切[33]。因此,作用于核心靶标AR的大黄化学成分可能是大黄发挥药理作用的有效活性成分,并且大部分为大黄蒽醌类化合物,具体可归为大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚5大类。本研究又根据确定质量标志物的其他原则,深入挖掘并确认大黄防治前列腺癌的质量标志物可能为大黄蒽醌类化合物AnthraglycosideB、Emodin-1-O-β-D-Glucopyranoside、Chrysophanol-8-O-β-D-Glucopyranoside、Chrysophanol-1-O-β-D-Glucoside、RheinosideB、Aloeemodin-8-O-β-D-Glucopyranoside、Physcion-8-β-D-Glucopyranoside、Physcion-8-O-β-D-Glucopyranoside,这些化合物均涉及以上5大类。这与现有的有关大黄的文献报道一致,或许是大黄防治前列腺癌质量标志物筛选的重要依据[34-35]。与此同时,本研究通过分子对接技术来探讨大黄关键靶标AR和成分治疗前列腺癌的物质基础和作用机制,为进一步开展的实验研究提供了参考和线索。但是,鉴于中药化学成分并不是简单相加、中药成分含量及浓度会影响药效、中药成分与靶点的作用类型多样化等复杂特点,后续仍需要对大黄的具体药效成分群和候选靶标开展进一步的体内外验证与临床转化研究,以期开发出更适用于临床治疗前列腺癌的有效天然化学成分。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:23.
[2]于巾越,孟静岩.浅析大黄“将军”之用[J].天津中医药大学学报,2013,32(2):116-117.
[3]朱首伦.探索制定《晚期前列腺癌中西医结合诊疗指南》的研究[D].广州:广州中医药大学,2016.
[4]Yu CX,Zhang XQ,Kang LD,et al.Emodin induces apoptosis in human prostate cancer cell LNCaP[J].Asian J Androl,2008,10(4):625-634.
[5]张晓倩.大黄素诱导前列腺癌细胞凋亡和对相关基因表达的影响[D].济南:山东大学,2006.
[6]黄凤,蒋桂华.大黄栽培研究进展[J].中药材,2019,42(1):230-234.
[7]刘昌孝,陈士林,肖小河,等.中药质量标志物(Q-Marker):中药产品质量控制的新概念[J].中草药,2016,47(9):1443-1457.
[8]周琦,孙慧娟,陈宁.中医药治疗前列腺癌的作用机制研究进展[J].中国实验方剂学杂志,2021,27(13):207-214.
[9]许海玉,侯文彬,李珂,等.基于整合药理学的中药质量标志物发现与应用[J].中国实验方剂学杂志,2019,25(6):1-8.
[10]许海玉,刘振明,付岩,等.中药整合药理学计算平台的开发与应用[J].中国中药杂志,2017,42(18):3633-3638.
[11]Xu HY,Zhang YQ,Liu ZM,et al.ETCM:an encyclopaedia of traditional Chinese medicine[J].Nucleic Acids Res,2019,47(D1):D976-D982.
[12]张铁军,白钢,刘昌孝.中药质量标志物的概念、核心理论与研究方法[J].药学学报,2019,54(2):2,187-196.
[13]Ok S,Kim SM,Kim C,et al.Emodin inhibits invasion and migration of prostate and lung cancer cells by downregulating the expression of chemokine receptor CXCR4[J].Immunopharmacol Immunotoxicol,2012,34(5):768-778.
[14]邱林,查岱龙,温勇,等.大黄素通过抑制雄激素受体表达抑制前列腺癌细胞生长的体内实验研究[J].癌症进展,2005,3(3):265-269,264.
[15]Masaldan S,Iyer VV.Exploration of effects of emodin in selected cancer cell lines:enhanced growth inhibition by ascorbic acid and regulation of LRP1 and AR under hypoxia-like conditions[J].J Appl Toxicol,2014,34(1):95-104.
[16]刘玥.大黄酸抑制前列腺癌细胞增殖的机理[D].哈尔滨:哈尔滨工业大学,2012.
[17]Lu L,Li K,Mao YH,et al.Gold-chrysophanol nanoparticles suppress human prostate cancer progression through inactivating AKT expression and inducing apoptosis and ROS generation in vitro and in vivo[J].Int J Oncol,2017,51(4):1089-1103.
[18]Liu K,Park C,Li S,et al.Aloe-emodin suppresses prostate cancer by targeting the mTOR complex 2[J].Carcinogenesis,2012,33(7):1406-1411.
[19]白凤,李斌鑫,董玉,等.蒙药复方协日嘎-4的网络药理学研究[J].北京中医药大学学报,2018,41(2):140-147.
[20]李斌鑫,董玉,白凤,等.蒙药协日嘎-4的分子对接研究[J].内蒙古大学学报:自然科学版,2018,49(2):169-173,225-227.
[21]刘月红,黄政海,董玲,等.高效液相色谱法同时测定大黄中14种成分的含量[J].中国中药杂志,2017,42(23):4514-4519.
[22]屈义虎.药用大黄成分分析及结合型蒽醌生物转化研究[D].汉中:陕西理工大学,2019.
[23]李洋.HPLC法同时对大黄3类药理活性物质质量控制及指纹图谱初步研究[D].成都:西南交通大学,2010.
[24]王亦君,冯舒涵,程锦堂,等.大黄蒽醌类化学成分和药理作用研究进展[J].中国实验方剂学杂志,2018,24(13):227-234.
[25]杜清涛,温金莲,严优芍,等.不同品种不同产地大黄UPLC指纹图谱研究[J].中药材,2013,36(5):725-731.
[26]李欢,黑小斌,李依民,等.HPLC分析不同年限药用大黄不同部位中10种成分的积累特征[J].中草药,2019,50(7):1690-1697.
[27]敬勇,李敏,齐景梁,等.大黄游离蒽醌含量与产地及生长年限的相关性研究[J].中药材,2012,35(10):1568-1571.
[28]冯改丽,罗璟,袁欢,等.CBUA-NO平衡溶解度和表观油水分配系数的测定[J].中国医院药学杂志,2018,38(11):1166-1168,1172.
[29]郭辉.大黄附子汤血清药物化学研究[D].南京:南京中医药大学,2013.
[30]Zhu Y,Wang HK,Qu YY,et al.Prostate cancer in East Asia:evolving trend over the last decade[J].Asian J Androl,2015,17(1):48-57.
[31]Wang N,Xu L,Wang JS,et al.Traditional Chinese medicine on treating pain caused by prostate cancer:A systematic review and meta-analysis[J].Medicine(Baltimore),2019,98(44):e17624.
[32]牟睿宇,賈英杰,孙彬栩,等.健脾利湿化瘀方对人前列腺癌C4-2细胞雄激素非依赖性生长的影响[J].中医杂志,2019,60(11):964-968.
[33]Hwang JH,Seo JH,Beshiri ML,et al.CREB5 promotes resistance to androgen-receptor antagonists and androgen deprivation in prostate cancer[J].Cell Rep,2019,29(8):2355-2370.e6.
[34]王玉,杨雪,夏鹏飞,等.大黄化学成分、药理作用研究进展及质量标志物的预测分析[J].中草药,2019,50(19):4821-4837.
[35]梁寒峭,田婧,冯瑞章,等.主成分分析和聚类分析用于中药大黄药材和提取物的质量评价[J].时珍国医国药,2019,30(5):1036-1040.
(2020-12-01收稿 责任编辑:魏庆双,徐颖)

