葡萄炭疽病病原鉴定及防治药剂筛选
罗 跃,刘阿丽,刘旭东,韩 磊,姚小龙,胡安龙,吴小毛
(1 贵州大学作物保护研究所,贵阳,550025;2 贵州省山地农业病虫害重点实验室,贵阳,550025;3 贵州大学农学院,贵阳,550025)
葡萄炭疽病又名晚腐病、苦腐病,是葡萄近成熟期的主要真菌病害之一[1]。我国葡萄种植区内炭疽病普遍发生,尤其在南方产区、北方环渤海产区等,西北产区基本不发生[2-3]。当前研究表明,引起葡萄炭疽病的病原菌主要有胶孢炭疽菌Colletotrichumgloeosporioides和尖孢炭疽菌Colletotrichumacutatum,但如壳皮炭疽菌Colletotrichumcrassipes、Colletotrichumfructicola等一些新的致病菌种也在不断被发现报道[4-5]。胶孢炭疽菌属半知菌亚门(Deuteromycotina)、黑盘孢目(Melanconiales)、炭疽菌属(Colletotrichum)[6]。葡萄炭疽病主要在转色期至成熟期的果实上发生,当前报道中不同病原侵染后引发的病症描述较为相近,病原菌侵染果实后起初在表面形成褐色斑点,病斑扩大后中心转黑凹陷并产生轮纹状黑点,环境湿度大时病部生出粉色黏状物,最终导致果实皱缩腐烂[2,7]。
近年来,随着贵州省农业产业结构调整及脱贫攻坚工作的推动,葡萄产业发展迅速,贵阳市花溪区为贵州省的葡萄主要产区之一,炭疽病随着种植面积不断扩大而在葡萄上的危害日益严重,高温多雨季节最有利于其发生[8],每年造成葡萄产业的损失达10%~20%,严重时可达30%以上,对葡萄的品质和产量影响较大[9]。化学药剂仍是当前防治炭疽病的主要措施[10],但化学农药长期单一及不合理使用,导致葡萄炭疽病病原菌对部分药剂产生了不同程度的抗药性[11-12]。如邓维萍等[13]发现烯唑醇和腈菌唑在不合理使用情况下,使得炭疽病菌产生抗药性;叶佳等[14]研究表明,浙江葡萄炭疽病病菌对甲基硫菌灵已产生了严重抗药性,防治效果明显降低。引起葡萄发生炭疽病的病原菌种类不一,不同病原对同种药剂的敏感性存在差异的可能较大,且病原菌的抗药性存在时空差异,因此,明确贵阳市花溪区葡萄炭疽病的病原种类,筛选出具有针对性的高效防治药剂,并将作用机理不同的药剂进行混配,选出共毒系数较高的组合供生产上施药参考,对当地葡萄炭疽病的防治和延缓病原抗药性的产生具有十分重要的意义。
1 材料与方法
1.1 供试材料
供试分离物:葡萄品种为巨玫瑰,葡萄炭疽病病样采于贵阳市花溪区葡萄基地。
7种供试杀菌剂原药:97%苯醚甲环唑(江苏耕耘有限责任公司);98%吡唑醚菌酯(湖北康宝泰精细化工有限公司);98%肟菌酯、95%啶氧菌酯、98%双苯菌胺、95%唑菌酯、96%丁香菌酯(沈阳化工研究院有限公司)。
1.2 试验方法
1.2.1 葡萄炭疽病病原鉴定
采用组织分离法[15]进行分离。在葡萄果皮表面病健交界处剪取适当大小组织块放在无菌滤纸上,用75%乙醇表面消毒35 s,无菌水冲洗3次,置于PDA培养基上,28 ℃恒温培养3 d后,挑取菌落边缘菌丝进行纯化,重复纯化直至得到单一菌株,将纯化后的菌株转接于PDA试管斜面4 ℃保存。
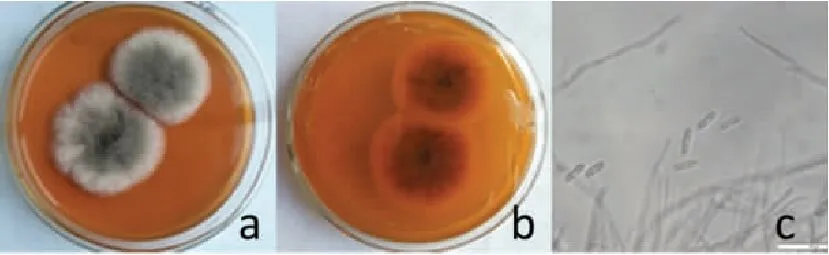
观察记录PDA平板上该病原菌菌落的形态、颜色等特征。黑光灯照射产孢培养后,在光学显微镜下观察分生孢子的大小形态并拍照。
根据柯赫氏法则进行回接试验,测定分离菌株的致病性。采用注射法将孢子悬浮液接种在葡萄果实上。将接种后的葡萄果实置于含滤纸和脱脂棉的保鲜盒中保湿培养,控制培养的温度和湿度条件,观察发病症状。
参照陈吉良等[16]的方法提取病原菌DNA。利用真菌通用引物ITS4和ITS5对病原菌rDNA的ITS区域进行PCR扩增。25 μLPCR反应体系包括:正反向引物各1.0 μL;DNA模板1.0 μL;ddH2O 9.5 μL;2×PCR Master Mix (含2xTaq DNA Polymerase,2×PCR Buffer,2xdNP)12.5 μL。PCR反应扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火40 s,72 ℃延伸90 s,共35个循环;最后72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后送至生工(上海)生物工程股份有限公司测序,用Chromas软件分析序列并上传到GenBank核酸数据库中,通过BLAST进行同源序列比对分析,采用MEGA6.0软件构建系统发育树。
1.2.2 防治药剂筛选
采用菌丝生长速率法[17]进行药剂毒力测定。将7种药剂都配制成母液后,将母液稀释成至少5个浓度梯度,然后以体积比1∶9加入PDA培养基中,充分摇匀后制成含药平板。使用直径5 mm的打孔器打出菌饼接种于含5个浓度供试药剂的9 cm PDA平板中央,以等量无菌水与PDA混匀制成平板作为空白对照,每个处理重复3次,28 ℃恒温培养。3~5 d后,采用十字交叉法测量各平板的菌落直径,运用DPS 13.0数据处理系统计算各药剂对葡萄炭疽病菌菌丝生长抑制的回归方程、EC50值。
菌丝生长抑制率=
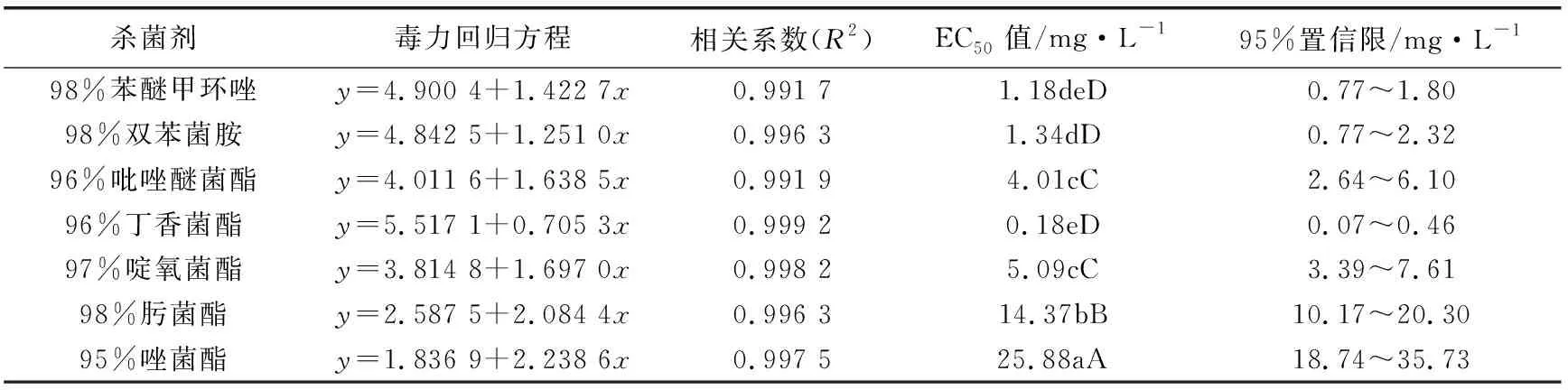
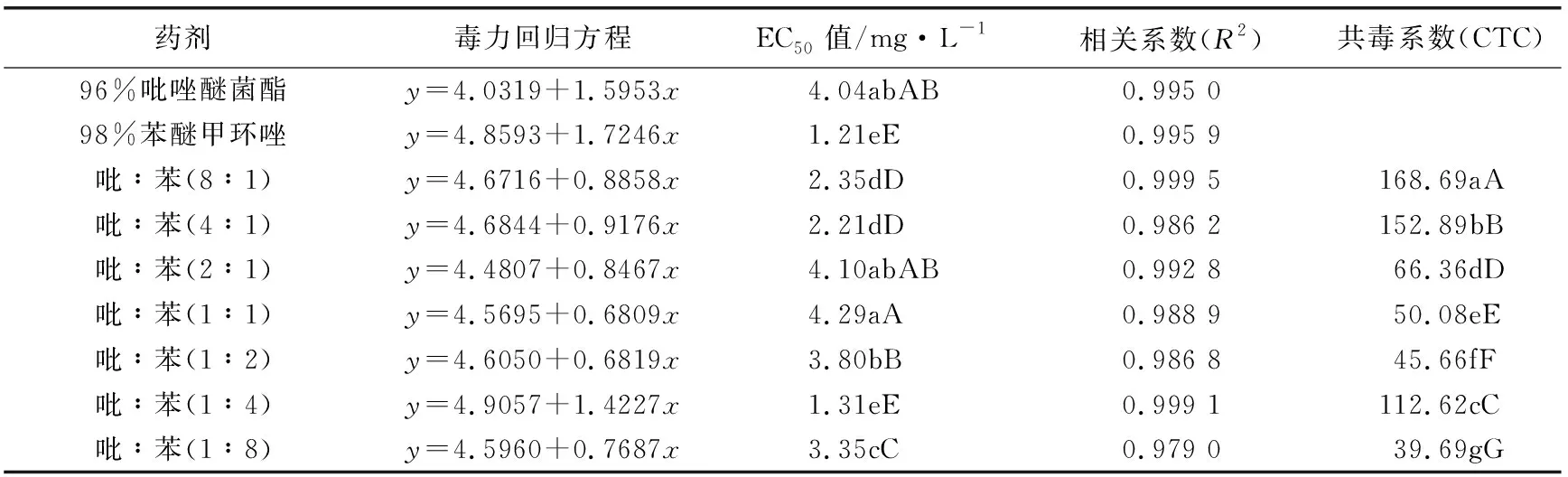
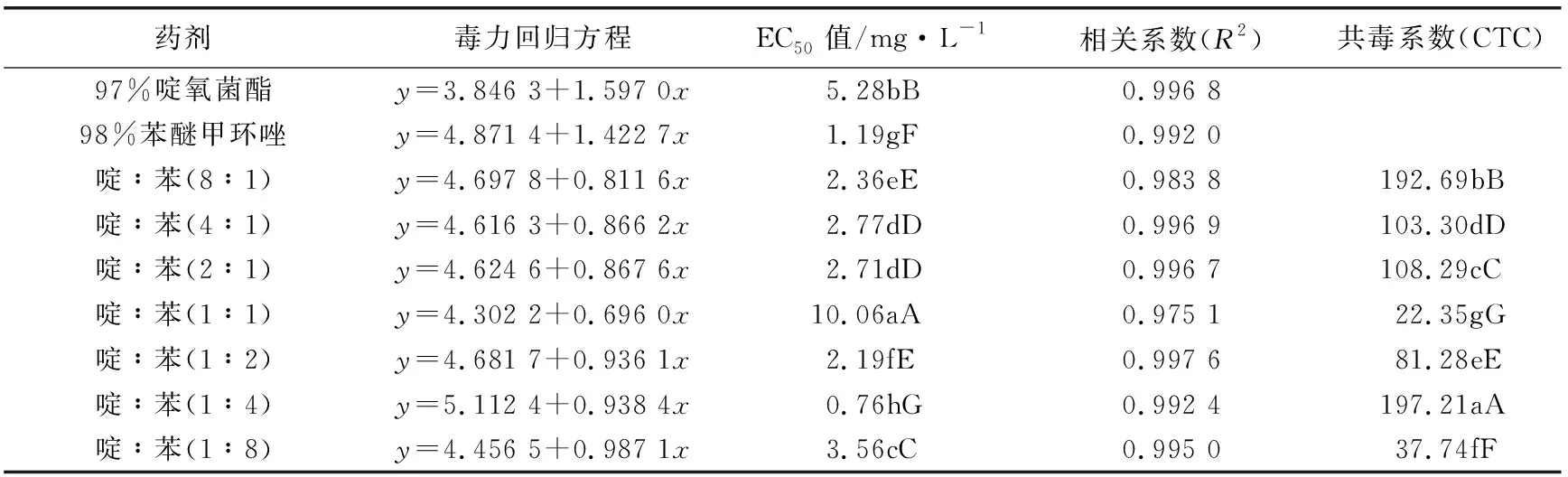
将苯醚甲环唑与吡唑醚菌酯,苯醚甲环唑与啶氧菌酯进行组合配比,按质量浓度8∶1、4∶1、2∶1、1∶1、1∶2、1∶4、1∶8等不同比例混合并稀释到试验所需要的各浓度处理,分别以混合的单剂作为对照,并设空白对照,每个处理重复3次,求得各配比的毒力回归方程及其EC50值。根据共毒系数法求出毒力指数、理论毒力指数、实际毒力指数及混剂的共毒系数CTC值,并以此进行综合评价,CTC>120表示增效作用,80 实测药剂毒力指数(ATI)= 混剂的理论毒力指数(TTI) =(药剂A的毒力指数×Ax) +(药剂B的毒力指数×Bx) Ax—药剂A在混剂中的百分含量;Bx—药剂B在混剂中的百分含量。 2.1 葡萄炭疽病病原鉴定结果 试验结果看出,病原菌在PDA平板上的菌落呈圆形,菌落边缘平整,菌丝为白色或灰白色,绒状或絮状(如图1a、图1b)。光学显微镜观察发现,该菌株分生孢子椭圆形,无色、单孢,有隔,具1~2个油球,圆筒形,两端钝圆,大小为(13.1~17.2) μm×(3.4~4.8)μm(如图1c)。分生孢子萌发时产生的附着孢深褐色,为球形或椭圆形。 注:a、b为菌落形态,c为分生孢子。 用注射法将孢子悬浮液回接到健康的葡萄果实上,症状与自然发病的炭疽病无异。根据柯赫氏法则,将发病果实重新进行组织分离,纯化培养,其菌落形态特征与接种菌株一致。 对供试菌株的基因组rDNA-ITS进行PCR扩增,扩增产物经测序获得大小为566 bp的DNA片段,琼脂糖凝胶电泳结果如图2a所示。将其与GenBank中已有序列进行同源性比对,发现该菌株rDNA-ITS序列与胶孢炭疽菌的同源性达100%。采用MEGA6.0构建系统发育树(如图2b),菌株与胶孢炭疽菌有较高的支持率聚在一支,鉴定结果表明该病原菌为胶孢炭疽菌。 注:a中1表示DNA marker (D2000),2为对照,3表示分离菌株PCR扩增产物。 2.2 防治葡萄炭疽病化学药剂筛选结果 试验结果看出,7种供试药剂对菌株均有一定的抑制作用,但敏感性存在差异。从药剂的EC50值来看,丁香菌酯的抑制作用最强,EC50值为0.18 mg/L;其次为苯醚甲环唑和双苯菌胺,EC50值分别为1.18 mg/L和1.34 mg/L;吡唑醚菌酯和啶氧菌酯也较敏感,EC50值分别为4.01 mg/L和5.09 mg/L;而肟菌酯和唑菌酯的敏感性相对较低,其EC50值分别为14.37 mg/L和25.88 mg/L(见表1)。 表1 不同杀菌剂对病原菌菌丝生长的抑制作用 试验结果看出,吡唑醚菌酯与苯醚甲环唑不同比例组合对供试菌株的菌丝生长抑制差异明显。吡唑醚菌酯与苯醚甲环唑的质量比为8∶1和4∶1时CTC>120,CTC值分别为168.69和152.89,表现为增效作用,增效效果显著。吡唑醚菌酯与苯醚甲环唑的质量比为1∶4时,其CTC值为112.62,表现为相加作用。此外,当质量比为2∶1、1∶2、1∶1和1∶8时,表现为拮抗作用(见表2)。 表2 吡唑醚菌酯与苯醚甲环唑混配抑制效果 试验结果看出,啶氧菌酯和苯醚甲环唑不同比例组合对供试菌株表现出不同程度的抑制效果。其中啶氧菌酯与苯醚甲环唑的质量比为8∶1和1∶4时,增效作用最好,CTC值分别为192.69和197.21,明显大于120,增效效果显著。啶氧菌酯与苯醚甲环唑的质量比为4∶1、2∶1时,其CTC值分别为103.30和108.29,表现为相加作用。此外,当质量比为1∶1、1∶2和1∶8时,表现为拮抗作用(见表3)。 表3 啶氧菌酯与苯醚甲环唑混配抑制效果 本研究对采自贵阳市花溪区葡萄基地的葡萄炭疽病病样进行病原菌的分离纯化,通过致病性测定发现,该菌株具有较强的致病能力,所分离菌株形态特征与李洋等[18]、邓维萍[5]等研究结果相一致。结合rDNA-ITs序列分析,鉴定该菌株为胶孢炭疽菌。采用菌丝生长速率法对7种杀菌剂原药进行了室内毒力测定,结果表明,7种杀菌剂对葡萄炭疽病病菌均有一定的抑制作用,其中丁香菌酯对胶孢炭疽菌菌丝生长的抑制作用最强,EC50值为0.18 mg/L,病原菌对苯醚甲环唑、双苯菌胺、吡唑醚菌酯和啶氧菌酯也较敏感,EC50值分别为1.19、1.34、4.01、5.09 mg/L,而对肟菌酯和唑菌酯的敏感性相对较低。孙行杰等[19]、杨敬辉等[12]研究表明,苯醚甲环唑和吡唑醚菌酯对葡萄炭疽病病菌菌丝具有较强的抑制作用,与本试验结果基本相一致,但本试验中苯醚甲环唑和吡唑醚菌酯的EC50值于高孙行杰等[19]、杨敬辉等[12]的研究结果,可能是由于不同地区病原菌抗药性水平差异导致。 苯醚甲环唑属三唑类杀菌剂,主要通过干扰病原菌细胞麦角甾醇的合成达到抑菌效果,而啶氧菌酯和吡唑醚菌酯是线粒体呼吸抑制剂,通过阻止病原菌细胞中细胞色素b和C1间电子传递而抑制线粒体呼吸作用。将吡唑醚菌酯与苯醚甲环唑、啶氧菌酯与苯醚甲环唑等作用机理不同的杀菌剂进行混配组合,结果表明,吡唑醚菌酯与苯醚甲环唑的质量比为8∶1和4∶1时,共毒系数(CTC)分别为168.69和152.89,表现为增效作用;啶氧菌酯与苯醚甲环唑的质量比为8∶1和1∶4时,CTC值分别为192.69和197.21,增效效果显著;其中啶氧菌酯与苯醚甲环唑质量比1∶4时,增效最明显。通过药剂间混配,不仅可以扩大协同增效药剂的杀菌谱,还可延缓葡萄炭疽病菌抗药性的产生,延长药剂的使用寿命。本研究结果表明,丁香菌酯、苯醚甲环唑、双苯菌胺、吡唑醚菌酯和啶氧菌酯对该病原菌均有较好的抑制作用,该结果可为葡萄炭疽病的田间选药防治提供一定的理论参考。
2 结果与分析

3 结论与讨论

