程序性细胞死亡配体1、端粒酶逆转录酶在皮肤瘢痕及瘢痕癌中的表达及意义
王章奇 何 伟 付凌怡 彭 享 翁锦泉
1.广东省人民医院珠海医院 (珠海市金湾中心医院)病理科,广东珠海 519040;2.广东省人民医院珠海医院(珠海市金湾中心医院)皮肤科,广东珠海 519040;3.中山大学附属肿瘤防治中心,广东广州 510000
近年来皮肤肿瘤的发生率有逐年上升趋势,某些皮肤肿瘤是从癌前病变开始慢慢演化而成的,若在其最终变成肿瘤之前对其识别并将其扼杀,可有效控制皮肤癌的发展。瘢痕的形成和发展与机体自我修复过程关系密切,是伤口愈合的最终产物[1]。而瘢痕癌的病理之一可能为机体抗肿瘤的免疫效应因瘢痕形成而被削弱,致使组织癌变的可能性升高[2]。程序性细胞死亡受体1(programmed cell death receptor 1,PD-1,CD279)及其配体 PD-L1(programmed cell death ligand 1,CD274)作为一类重要的免疫抑制分子,在机体的适应性免疫抵抗中发挥着重要作用,目前普遍认为,PD-L1 在多种肿瘤的实体组织中均可检测出其高表达。端粒酶逆转录酶(telomerase reverse transcriptase,TERT)作为端粒酶的催化亚基,与瘢痕增生、肿瘤永生化密切相关。但目前关于PD-L1、TERT在正常皮肤、皮肤病理性瘢痕及皮肤瘢痕癌中的表达及意义的研究报道极少,因此本研究对此进行探讨,为临床治疗瘢痕癌提供参考依据。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年12月人体正常皮肤组织25例为皮肤组,皮肤病理性瘢痕30例为皮肤瘢痕组,皮肤瘢痕癌35例为瘢痕癌组。所有病例均经HE染色、光镜观察并明确诊断。瘢痕癌组临床有病理性瘢痕形成史,确诊为皮肤瘢痕癌者,从瘢痕形成到癌变的时间为1~40年。皮肤瘢痕组临床有皮肤烧伤、烫伤或机械性创伤等损伤病史,形成瘢痕的时间为数月至20年。
1.2 方法
1.2.1 采用免疫组化二步法染色检测PD-L1及TERT蛋白表达水平 ①切片、脱蜡、水化:标本蜡块制备成4 μm连续切片,经脱蜡和水化,自来水冲洗并浸泡于水中。②过氧化物阻断:滴加3%过氧化氢溶液室温作用10 min,PBS 冲洗3遍,每遍5 min。③抗原修复:置于pH 6.0柠檬酸盐缓冲液中微波加热20 min进行抗原修复,自然冷却至室温,PBS冲洗3遍,每遍5 min。④一抗孵育:滴加兔抗人PD-L1或TERT多克隆抗体(英国Abcam公司,1∶200稀释),4℃孵育过夜,PBS冲洗3遍,每遍5 min。⑤二抗孵育:使用PV-6000二抗试剂盒(北京中杉金桥生物技术有限公司),每张切片滴加二抗50 μl,室温条件下孵育20 min,PBS冲洗3遍,每遍5 min。⑥DAB显色:在每张切片上滴加100 μl新鲜配制的DAB显色剂,室温下避光显色,在光学显微镜下控制显色时间,3~5 min后蒸馏水冲洗终止显色。⑦苏木素衬染及封片:苏木精复染1 min,自来水冲洗返蓝,梯度酒精脱水干燥,二甲苯透明,中性树胶封片。
1.2.2 结果判断 免疫组化切片均由2名资深病理科医师双盲独立观察评估。①PD-L1结果判定以细胞膜或细胞质出现黄色至棕褐色颗粒为阳性显色。②TERT结果判定以细胞核出现黄色至棕褐色颗粒为阳性显色。蛋白表达水平采用半定量积分法,结合染色强度和阳性细胞百分比来评定阳性表达病例。先在低倍镜下观察切片整个视野,分别随机选择5个高倍视野(×400),染色强度分级如下:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞密度分级为:阳性细胞数≤10%为1分,10%~50%为2分,>50%为3分。两项得分相乘结果≥3分为阳性表达。
1.3 观察指标
①观察PD-L1蛋白在各组组织细胞中表达情况;②观察TERT蛋白在各组组织细胞中表达情况;③比较PD-L1、TERT蛋白在各组组织细胞中的表达水平(阳性面积)及强度(平均光密度);④采用Spearman相关性分析PD-L1、TERT表达水平的相关性。
1.4 统计学方法
采用SPSS19.0软件对数据进行统计学分析,计量资料用()表示,组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验,采用Spearman相关性分析PD-L1、TERT表达水平的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 PD-L1蛋白在各组组织细胞中表达情况
阳性表达出现在细胞膜或细胞质,呈黄色至棕褐色为阳性,皮肤组、瘢痕组及瘢痕癌组分别为阴性、弱阳性以及强阳性(图1)。
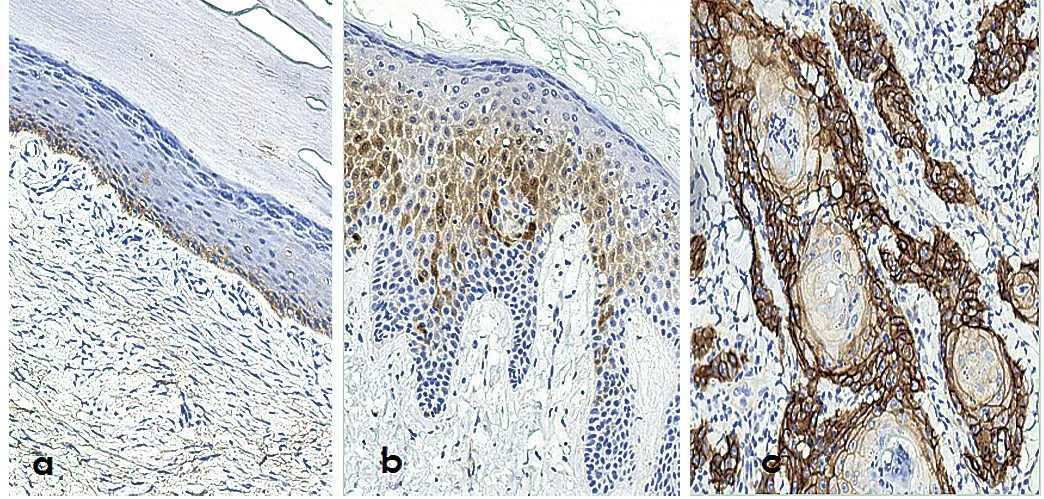
图1 PD-L1蛋白在皮肤组、瘢痕组及瘢痕癌组细胞中表达情况
注:a.PD-L1在正常皮肤表皮中呈阴性表达(IHC×400);b.PD-L1在病理性瘢痕上皮中呈弱阳性表达(IHC ×400);c.PD-L1在瘢痕癌组织中呈强阳性表达(IHC×400)
2.2 TERT蛋白在各组组织细胞中表达情况
阳性表达位于细胞核,出现黄色至棕褐色颗粒为阳性显色,皮肤组、瘢痕组及瘢痕癌组分别为阴性、弱阳性以及强阳性(图2)。
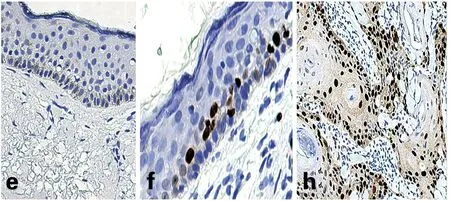
图2 TERT蛋白在皮肤组、瘢痕组及瘢痕癌组细胞中表达情况
2.3 PD-L1、TERT蛋白在各组组织细胞中的表达水平及强度比较
PD-L1的表达水平与表达强度,三组之间比较差异有统计学意义(P<0.05);即瘢痕组与皮肤组比较PD-L1蛋白表达水平差异无统计学意义(P>0.05),瘢痕癌组与皮肤组、瘢痕组两两比较,PD-L1蛋白表达水平差异均有统计学意义(P<0.05)。TERT的表达水平与表达强度,三组之间比较差异有统计学意义(P<0.05);即瘢痕组与皮肤组比较,TERT蛋白表达水平差异无统计学意义(P>0.05),瘢痕癌组与皮肤组、瘢痕组两两比较,TERT蛋白表达水平差异均有统计学意义(P<0.05)。见表1。
表1 PD-L1、TERT蛋白在各组组织细胞中的表达水平及强度比较(± s)

表1 PD-L1、TERT蛋白在各组组织细胞中的表达水平及强度比较(± s)
组别 n PD-L1 TERT阳性面积(PA) 平均光密度(AOD) 阳性面积(PA) 平均光密度(AOD)皮肤组 25 0.04±0.02 0.18±0.03 0.06±0.03 0.18±0.02瘢痕组 30 0.05±0.02 0.20±0.03 0.09±0.05 0.21±0.03瘢痕癌组 35 0.14±0.04 0.26±0.02 0.17±0.05 0.28±0.04 F值 110.796 76.324 48.529 78.160 P值 0.000 0.000 0.000 0.000 t瘢痕组与皮肤组比较值 1.846 2.462 2.629 4.269 P瘢痕组与皮肤组比较值 0.070 0.017 0.011 0.000 t瘢痕癌组与皮肤组比较值 11.496 12.401 9.798 14.505 P瘢痕癌组与皮肤组比较值 0.000 0.000 0.000 0.000 t瘢痕癌组与瘢痕组比较值 11.176 9.607 6.431 7.871 P瘢痕癌组与瘢痕组比较值 0.000 0.000 0.000 0.000
2.4 PD-L1、TERT蛋白表达水平相关性
经过Spearman相关性分析,PD-L1蛋白的表达水平与TERT蛋白表达程度水平(r=0.662,P=0.000)呈正相关。
3 讨论
3.1 PD-L1与皮肤瘢痕癌
PD-1是一种Ⅰ型跨膜糖蛋白,是维持机体免疫耐受的重要因子,正常情况下,广泛表达于活化的CD4+T细胞、B细胞、CD8+T细胞、单核细胞以及DC表面[3]。PD-L1是PD-1的配体,作为一种免疫抑制分子表达于肿瘤细胞表面,肿瘤环境下,与PD-1结合形成PD-1/PD-L1信号通道,灭活肿瘤特异性的T细胞,是免疫应答被阻断,从而肿瘤细胞发生免疫逃逸,导致机体对肿瘤细胞的攻击和杀伤能力被减弱甚至丧失[4-7]。本研究显示,在瘢痕癌中,PD-L1呈强阳性表达,其在瘢痕癌组的表达水平以及表达强度均明显高于正常皮肤组与瘢痕组,差异均有统计学意义(P<0.05),说明PD-L1高表达可能与皮肤瘢痕癌的发生关系密切。肿瘤组织中PD-L1异常增高,使瘢痕上皮细胞中的PD-1与之结合,致瘢痕上皮组织T细胞失活,阻断免疫应答,形成了肿瘤免疫逃逸,从而促使瘢痕癌的发生,促进其发生以及导致预后不良[8]。同时有相关研究发现,PD-L1还影响肿瘤的增殖、迁移和侵袭能力等,上调癌组织中的PD-L1表达,其生物活性亦随之下降,上调则上升[9-11]。在正常人体中PD-L1还可在抗原提呈细胞和内皮细胞中表达,而在健康皮肤与病理性皮肤瘢痕上皮中,PD-L1的表达水平(平均面积)并无差异,但瘢痕上皮中PD-L1表达强度(平均光密度)大于健康皮肤,由此可见PD-L1可能对正常细胞的增殖具有促进作用。
3.2 TERT蛋白与皮肤瘢痕癌
TERT作为端粒酶核心的组成部分,在端粒酶的活性调节中起关键作用。本研究结果显示TERT在皮肤、瘢痕及瘢痕癌组分别为阴性、弱阳性以及强阳性;TERT的表达水平与表达强度,三组之间有差异,两两比较,也均存在差异,表达水平与表达强度均为正常皮肤组<瘢痕组<瘢痕癌组。同时相关研究认为,端粒酶可在肿瘤癌前病变组织中呈阳性表达,在肿瘤细胞中更是表达上调,而在正常的细胞中却几乎检测不到,因此,推测端粒酶是细胞转变成肿瘤细胞的一个关键因子[12]。结合本研究结果,TERT不仅与肿瘤的发生有着密切关系,与瘢痕的发生也存在密切关系。端粒酶的活性程度,可对癌细胞分化程度进行客观反应,在临床上是肿瘤复发和预后等方面的重要指标[13]。有研究显示,端粒酶的高表达可导致机体部分组织产生过度增生,比如肿瘤细胞增殖、瘢痕增生等[14-15]。而TERT作为端粒酶的逆转录酶,只有TERT的激活以及表达水平增高可进一步促进端粒酶的表达增高,在端粒酶的活性调节中起到关键作用,因此在肿瘤细胞和瘢痕上皮细胞中亦呈现高表达状态。
3.3 皮肤瘢痕癌中PD-L1与TERT表达相关性
皮肤瘢痕癌中PD-L1与TERT蛋白显示高表达,两种蛋白呈正相关,说明两种蛋白在皮肤瘢痕癌发生过程中可能发挥着协同作用。TERT蛋白通过调节端粒酶活性,使细胞过度分化,从而促进PD-L1的表达,两者协同作用促进细胞的增殖甚至恶性转化。
3.4 本研究局限性
PD-L1、TERT在多数恶性肿瘤都可表达,但在瘢痕癌的表达情况研究甚少,本研究通过文献检索分析,仅对PD-L1、TERT于瘢痕与瘢痕癌的发生机制相关性进行了讨论。本研究并未对两种蛋白实际对瘢痕及瘢痕癌的发展、转移等影响以及PD-L1与TERT表达相关性机制进行研究,因此还需进一步深入研究,为治疗瘢痕癌提供更有利的研究数据。
综上所述,PD-L1、TERT蛋白高表达可能与皮肤瘢痕癌发生密切相关,同时也可能造成病理性瘢痕发生癌变。通过阻断PD-1/PD-L1通路,使两种蛋白不能结合,能够增强肿瘤状态下T细胞对肿瘤细胞的杀伤力,以防止发生病变,同时通过对TERT蛋白表达基因的调控,可抑制细胞过度增殖和肿瘤细胞增殖,降低恶性肿瘤的发生。

