基于PINK1/Parkin信号通路研究细叶远志皂苷对AD模型小鼠脑组织线粒体自噬的影响
陆晓华 金桂芳 余河汉 杨红

中圖分类号 R322.81;R965 文献标志码 A 文章编号 1001-0408(2021)22-2748-07
DOI 10.6039/j.issn.1001-0408.2021.22.11
摘 要 目的:探讨细叶远志皂苷(TEN)对阿尔茨海默病(AD)模型小鼠脑组织线粒体自噬的影响。方法:将50只雄性APP/PS1双转基因小鼠随机分为模型组、TEN中剂量+3-甲基腺嘌呤(3-MA)组[TEN 40 mg/(kg·d)+自噬抑制剂3-MA 30 mg/(kg·d)]和TEN低、中、高剂量组[20、40、80 mg/(kg·d)],每组10只;另将10只同系野生型小鼠作为正常对照组。各给药组小鼠灌胃相应药液,正常对照组和模型组小鼠灌胃0.3%羧甲基纤维素钠溶液,每天给药1次,给药体积为0.01 mL/g,连续给药3个月。末次给药后,检测神经元内微管相关蛋白1轻链3(LC3)的阳性表达水平[以积分光密度(IOD)计],脑组织线粒体中LC3、泛素结合蛋白p62、Cathepsin D、Rab7、人第10号染色体缺失的磷酸酶及张力蛋白同源基因诱导的假定激酶1(PINK1)、E3泛素连接酶(Parkin) mRNA的表达量和LC3、p62、PINK1、Parkin蛋白的表达量。结果:与正常对照组比较,模型组小鼠神经元内LC3的IOD值和脑组织线粒体中LC3、p62、PINK1、Parkin mRNA及其蛋白的表达量均显著升高(P<0.05或P<0.01),Cathepsin D、Rab7 mRNA的表达量均显著降低(P<0.05或P<0.01)。与模型组比较,TEN低、中、高剂量组小鼠神经元内LC3的IOD值(除TEN低、中剂量组外)和脑组织线粒体中LC3、Cathepsin D、Rab7、PINK1(除TEN低剂量组外)、Parkin(除TEN低剂量组外) mRNA的表达量以及LC3(除TEN中剂量组外)、PINK1(除TEN高剂量组显著降低外)、Parkin(除TEN低剂量组显著降低外)蛋白的表达量均显著升高(P<0.05或P<0.01),p62 mRNA(除TEN低剂量组外)及其蛋白的表达量均显著降低(P<0.05或P<0.01)。与TEN中剂量组比较,TEN中剂量+3-MA组小鼠上述指标的变化均被显著抑制(P<0.05或P<0.01)。结论:TEN可通过激活PINK1/Parkin信号通路来诱导AD模型小鼠脑组织线粒体自噬,增强溶酶体功能。
关键词 细叶远志皂苷;阿尔茨海默病;PINK1/Parkin信号通路;线粒体自噬;APP/PS1双转基因小鼠
Study on the Effects of Tenuifolin on Brain Mitochondrial Autophagy in AD Model Mice Based on PINK1/Parkin Signaling Pathway
LU Xiaohua1,JIN Guifang2,YU Hehan1,YANG Hong1(1. School of Life Sciences and Biopharmaceutics, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2. School of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China)
ABSTRACT OBJECTIVE: To investigate the effects of tenuifolin (TEN) on brain mitochondrial autophagy in Aizheimers disease (AD) model mice. METHODS: Totally 50 male APP/PS1 double transgenic mice were randomly divided into model group, TEN medium-dose+3-MA group [TEN 40 mg/(kg·d)+autophagy inhibitor 3-MA 30 mg/(kg·d)] and TEN low-dose, medium-dose and high-dose groups [20, 40, 80 mg/(kg·d)], with 10 mice in each group. In addition, 10 wild-type homologous mice were included in normal control group. Administration groups were intragastrically given corresponding drug solution; normal control group and model group were intragastrically given 0.3% sodium carboxymethyl cellulose solution, once a day, 0.01 mL/g, for consecutive 3 months. After last administration, positive expression [measured by integrated optical density (IOD)] of microtubule associated protein 1 light chain 3 (LC3) in neuron was detected; mRNA expressions of LC3, ubiquitin-binding protein p62, Cathepsin D, Rab7, phosphatase and tensin homolog deleted on chromosome ten gene-induced putative kinase 1 (PINK1) and E3 ligase (Parkin) as well as protein expressions of LC3, p62, PINK1 and Parkin were detected in brain mitochondria. RESULTS: Compared with normal control group, IOD value of LC3 in neuron as well as mRNA and protein expressions of LC3, p62, PINK1 and Parkin in brain mitochondria were all increased significantly in model group (P<0.05 or P<0.01), while mRNA expressions of Cathepsin D and Rab7 were decreased significantly (P<0.05 or P<0.01). Compared with model group, IOD values of LC3 (except for TEN low-dose and medium-dose groups) in neuron, mRNA expressions of LC3, Cathepsin D, Rab7, PINK1 (except for TEN low-dose group) and Parkin (except for TEN low-dose group) in brain mitochondria as well as protein expressions of LC3 (except for TEN medium-dose group), PINK1 (except for TEN high-dose group decreased significantly) and Parkin (except for TEN low-dose group decreased significantly) were increased significantly in TEN low-dose, medium-dose and high-dose groups (P<0.05 or P<0.01); mRNA (except for TEN low-dose group) and protein expressions of p62 were decreased significantly (P<0.05 or P<0.01). Compared with TEN medium-dose group, the changes of above indexes were inhibited significantly in TEN medium-dose+3-MA group (P<0.05 or P<0.01). CONCLUSIONS: TEN can induce mitophagy in brain tissue of AD model mice by activating PINK1/Parkin signaling pathway and improve lysosome function.
KEYWORDS Tenuifolin; Alzheimers disease; PINK1/Parkin signaling pathway; Mitochondrial autophagy; APP/PS1 double transgenic mice
阿尔茨海默病(AD)是一种主发于老年人的慢性中枢神经系统退行性疾病,其主要病理特征包括:神经元外以β淀粉样蛋白(Aβ)沉积为核心而形成的老年斑,细胞内以超磷酸化的Tau为核心而形成的神经原纤维缠结以及神经元丢失等[1-3]。已有研究表明,神经元内自噬途径受损会阻碍受损线粒体的清除,受损线粒体累积会导致Tau蛋白聚集,而聚集的Tau蛋白又会进一步加重线粒体自噬障碍,导致腺苷三磷酸生成受阻,最终引起脑内神经元的死亡[4]。此外,Aβ聚集多发生在神经元外部,亦可进入细胞内,并能在线粒体内沉积,从而损伤线粒体的形态结构和功能,诱发细胞凋亡,反之线粒体形态结构、功能异常也可进一步加剧Aβ聚集[5]。自噬诱导剂雷帕霉素可通过抑制哺乳动物雷帕霉素靶蛋白(mTOR)而诱导和促进线粒体自噬,减少Aβ和Tau蛋白聚集,保护神经元[6]。由此可见,AD的发生和发展可能与线粒体自噬障碍密切相关。
线粒体自噬是指以线粒体为靶细胞器的自噬过程,是通过自噬体与自噬启动蛋白等相关因子共同作用来清除受损线粒体以维持生物体内线粒体的稳态,在维持细胞正常生命活动中起着重要的作用,被认为是保护神经元的关键要素[7-9]。在哺乳动物中,参与线粒体自噬的主要信号通路有人第10号染色体缺失的磷酸酶及张力蛋白同源基因诱导的假定激酶1(PINK1)/E3泛素连接酶(Parkin)蛋白信号通路、FUN14结构域蛋白1(FUNDC1)信号通路、B细胞淋巴瘤2/腺病毒E1B相互作用蛋白3(BNIP3)/NIP3样蛋白X(NIX)信号通路等,其中神经系统线粒体自噬主要受PINK1/Parkin信号通路的影响,应激诱导的线粒体自噬被触发后会通过PINK1/Parkin信号通路介导的相关途径来消除受损的线粒体,从而维持细胞的正常生命活动[10]。Lutz等[11]的研究结果表明,在Parkin或PINK1缺失的人神经母细胞瘤SH-SY5Y细胞中,线粒体动力相关蛋白1的表达量增加,代表线粒体分裂增加,而Parkin和PINK1可能有调节线粒体分裂的作用。
远志Polygalae Radix为远志科植物远志(又名细叶远志)Polygala tenuifolia Willd.或卵叶远志(又名宽叶远志)Polygala sibirica L.的干燥根,主要药用成分为远志皂苷,具有中枢神经系统保护作用[12-14]。细叶远志皂苷(tenuifolin,TEN)是远志总皂苷经碱水解减毒后的主要次级皂苷成分,相较于远志皂苷元,TEN的性质更稳定,且溶血等毒副作用大大降低[15]。有研究表明,远志的皂苷类化合物可增加正常小鼠脑神经元自噬标志物微管相关蛋白1轻链3(LC3)的表达,减少自噬选择性底物泛素结合蛋白p62的表达,提高小鼠的学习与记忆能力[16]。远志可通过激活腺苷一磷酸活化蛋白激酶(AMPK)/mTOR信号通路来诱导线粒体自噬,从而减少SH-SY5Y细胞中Aβ蛋白的分泌,进而发挥抗AD的作用[17-18]。本研究拟通过动物实验,基于PINK1/Parkin信号通路研究TEN对AD模型小鼠脑组织线粒体自噬的影响,旨在为深入研究TEN的抗AD机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括CFX Connect型荧光定量聚合酶链反应(PCR)仪(美国Bio-Rad公司),Eclipse E100型正置光学显微镜、DS-U3型成像系统(日本Nikon公司),H1650-W型台式微量高速离心机(长沙湘仪离心机仪器有限公司),GeneGnome XRQ型凝胶成像仪(英国Syngene公司),NanoDrop Lite型超微量分光光度计(美国Thermo Scientific公司)等。
1.2 主要药品与试剂
TEN对照品(货号A1023AS,纯度>98%)购自大連美仑生物技术有限公司;自噬抑制剂3-甲基腺嘌呤(3-MA)对照品(货号S2767,纯度99.97%)购自美国Selleck Chemicals公司;组织线粒体分离试剂盒(批号C3606)、苯甲基磺酰氟(PMSF)裂解液(批号ST505)、二喹啉甲酸(BCA)蛋白定量分析试剂盒(批号P0010S)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒(批号P0012A)均购自上海碧云天生物技术有限公司;Trizol试剂购自宝生物工程(大连)有限公司;通用型显色试剂盒(小鼠/兔聚合物法检测系统)(批号PV-6000)、二氨基联苯胺(DAB)显色剂(批号ZLI-9019)、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(供免疫组化用,批号PV-9000)均购自北京中杉金桥生物技术有限公司;柠檬酸钠抗原修复液(批号YJ0023)、内源性过氧化氢酶阻滞剂3%双氧水(批号YJ0036)、免疫组化封闭液(批号YJ0054)、苏木精染色剂(批号YJ0058)均购自广州永津生物科技有限公司;ECL显色液(批号CW0049S)购自康为世纪生物科技有限公司;PrimeScriptTM RT Master Mix(Perfect Real Time)预混液(批号RR047A)、SYBR? Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(批号RR820A)均购自日本Takara公司;兔源β-肌动蛋白(β-actin)多克隆抗体(批号bs-0061R)、HRP标记的山羊抗兔IgG二抗(供Western blot用,批号bs-40295G-HRP)均购自北京博奥森生物技术有限公司;兔源LC3多克隆抗体(批号ab48394)、兔源p62多克隆抗体(批号ab109012)、兔源PINK1多克隆抗体(批号ab23707)、兔源Parkin多克隆抗体(批号ab15954)均购自英国Abcam公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 实验动物
本研究所用实验动物为SPF级雄性B6C3-Tg(APPswePSEN1dE9)/Nju系APP/PS1双转基因小鼠(简称“APP/PS1小鼠”)50只和SPF级雄性同系野生型小鼠10只,3~4月龄,均购自南京大学模式动物研究所,动物生产许可证号为SCXK(苏)2015-0001。所有小鼠均饲养于广东药科大学实验动物中心SPF级动物房(温度22~26 ℃,相对湿度40%~70%,光照/黑暗时间12 h/12 h)中,自由进食、饮水。本研究相关实验操作均严格遵守广东药科大学《实验动物伦理委员会章程》的相关规定。
2 方法
2.1 分组与给药
将50只APP/PS1小鼠随机分为模型组,TEN低、中、高剂量组[20、40、80 mg/(kg·d),剂量均按本课题组前期研究结果设置],TEN中剂量+3-MA组[TEN 40 mg/(kg·d)+3-MA 30 mg/(kg·d),剂量均按本课题组前期研究结果设置],每组10只。另将10只同系野生型小鼠作为正常对照组。各给药组小鼠灌胃相应剂量的药液[溶剂均为0.3%羧甲基纤维素钠(CMC-Na)溶液],模型组和正常对照组小鼠灌胃0.3%CMC-Na溶液,每天给药1次,给药体积为0.01 mL/g,连续给药3个月后进行后续实验。
2.2 取样方法
小鼠末次给药后禁食12 h,脱颈椎处死,快速于冰上分离脑组织并置于-80 ℃冰箱中保存,备用。每组随意选取3只小鼠的脑组织适量,用4%多聚甲醛溶液固定24 h,对脑组织进行脱水处理、经石蜡包埋后切片(厚度约4 μm),用于免疫组化染色。按照组织线粒体分离试剂盒说明书方法操作,分离提取每组剩余7只小鼠脑组织的线粒体并置于-80 ℃冰箱中保存,用于相关mRNA和蛋白检测。
2.3 小鼠神经元内LC3阳性分布的检测
采用免疫组化染色法进行检测。取“2.2”项下各组小鼠脑组织切片,用二甲苯脱蜡,对抗原进行修复、封闭后,加入LC3一抗(稀释比例为1 ∶ 100),于4 ℃下孵育过夜;用磷酸盐缓冲液(PBS,pH 7.2)洗涤5 min×5次,加入HRP标记的山羊抗兔IgG二抗,于37 ℃下孵育20 min;用PBS洗涤5 min×5次,以DAB显色剂显色,用PBS终止反应,并以苏木精复染,经乙醇梯度洗脱、二甲苯透明后,用中性树胶封片。使用成像系统成像,并于正置光学显微镜下观察各组小鼠神经元内LC3的阳性分布(阳性显棕黄色),使用Image J v1.8.0软件计算其积分光密度(IOD)。
2.4 小鼠脑组织线粒体中LC3、p62、Cathepsin D、Rab7、PINK1、Parkin mRNA表达的检测
采用实时荧光定量PCR法进行检测。取“2.2”项下冻存的各组小鼠脑组织线粒体(Cathepsin D、Rab7 mRNA的检测不考虑TEN中剂量+3-MA组),經PMSF裂解后,用Trizol试剂提取总RNA,取样品2 μL测定RNA浓度,按照PrimeScriptTM RT Master Mix(Perfect Real Time)预混液说明书方法进行cDNA反转录,取cDNA按照SYBR? Premix Ex TaqTM(Tli RNaseH Plus)试剂盒说明书方法进行PCR。反应体系(10 μL)如下:2×Ultra SYBR Mixture 5 μL,上、下游引物各0.2 μL,cDNA模板1 μL,ddH2O 3.6 μL。扩增条件如下:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸32 s,共40个循环。每组设3个复孔,采用2-ΔΔCt法以GraphPad Prism 8.0软件进行分析,以β-actin为内参,计算目标基因的表达量,并以正常对照组为参照进行归一化处理。引物由生工生物工程(上海)股份有限公司设计、合成,引物序列和产物片段长度见表1。
2.5 小鼠脑组织线粒体中LC3、p62、PINK1、Parkin蛋白表达的检测
采用Western blot法进行检测。取“2.2”项下冻存的各组小鼠脑组织线粒体,经PMSF裂解后提取总蛋白,用BCA法测定浓度后,于100 ℃下加热10 min使变性。取变性蛋白样品进行SDS-PAGE分离、转膜后,用5%脱脂奶粉于室温下封闭,加入LC3、p62、PINK1、Parkin、β-actin一抗(稀释比例均为1 ∶ 1 000),于4℃下孵育过夜;用TBST缓冲液洗涤10 min×3次,加入HRP标记的山羊抗兔IgG二抗(稀释比例为1 ∶ 5 000),于室温下孵育1.5 h,用TBST缓冲液洗涤10 min×3次,用ECL显色液曝光并置于凝胶成像仪上成像。使用Image J v1.8.0软件进行分析,以目标蛋白与内参蛋白(β-actin)的灰度值比值作为目标蛋白的表达量。实验重复3次。
2.6 统计学方法
采用GraphPad Prism 8.0软件对数据进行统计分析。数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
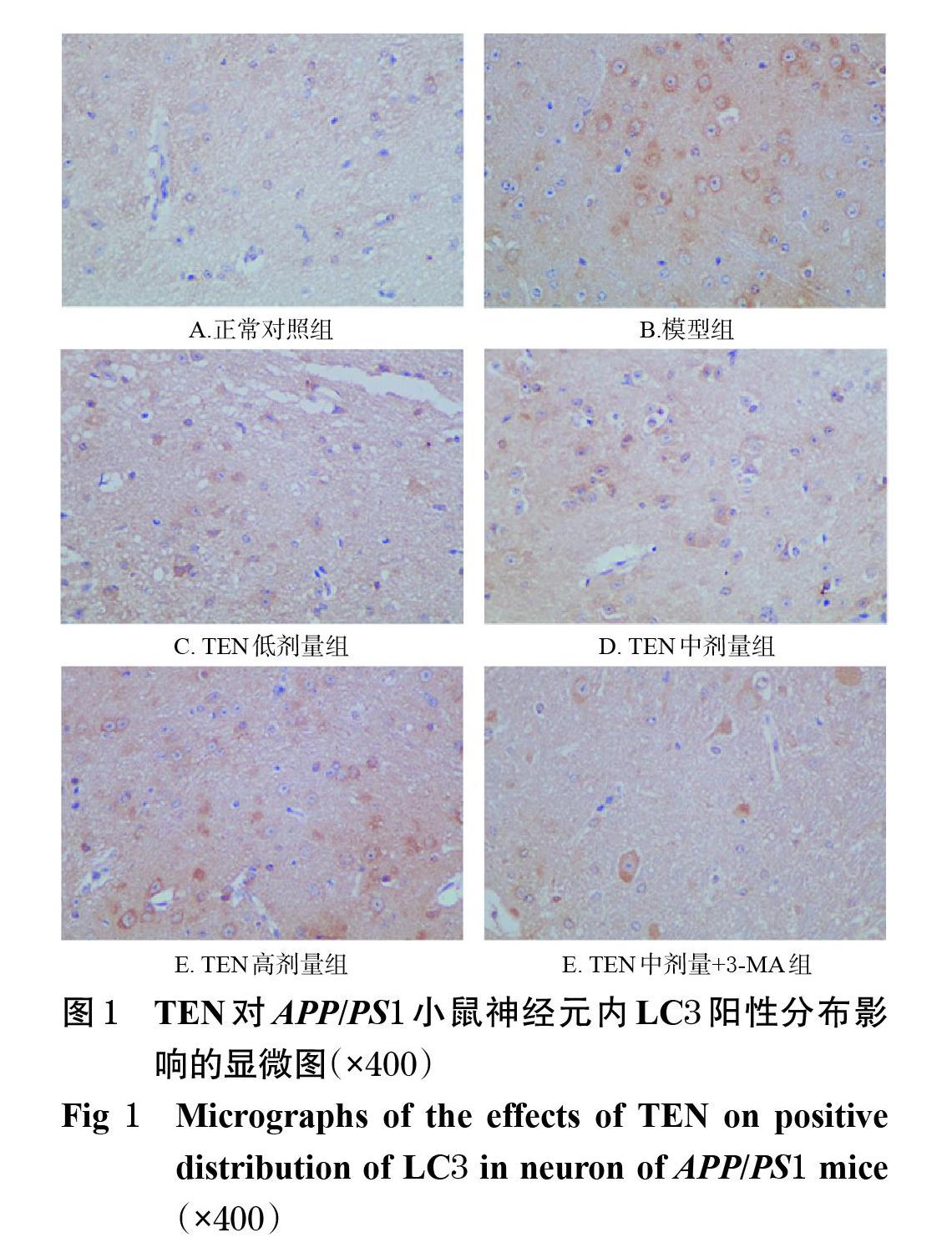
3.1 TEN对APP/PS1小鼠神经元内LC3阳性表达的影响
与正常对照组比较,模型组小鼠神经元内LC3阳性表达的IOD值显著升高(P<0.01)。与模型组比较,TEN低、中剂量组小鼠神经元内LC3阳性表达的IOD值虽有升高趋势,但差异无统计学意义(P>0.05),仅TEN高剂量组小鼠神经元内LC3阳性表达的IOD值显著升高(P<0.05)。与TEN中剂量组比较,TEN中剂量+3-MA组小鼠神经元内LC3阳性表达的IOD值显著降低(P<0.01)。结果见图1、表2。
3.2 TEN对APP/PS1小鼠脑组织线粒体中LC3、p62、Cathepsin D、Rab7、PINK1、Parkin mRNA表达的影响
与正常对照组比较,模型组小鼠脑组织线粒体中LC3、p62、PINK1、Parkin mRNA的表达量均显著升高(P<0.05或P<0.01),Cathepsin D、Rab7 mRNA的表达量均显著降低(P<0.05或P<0.01)。与模型组比较,TEN低、中、高剂量组小鼠脑组织线粒体中LC3、Cathepsin D、Rab7、PINK1(除TEN低剂量组外)、Parkin(除TEN低剂量组外)mRNA的表达量均显著升高(P<0.05或P<0.01),p62(除TEN低剂量组外)mRNA的表达量均显著降低(P<0.05或P<0.01)。与TEN中剂量组比较,TEN中剂量+3-MA组小鼠脑组织线粒体中LC3、PINK1、Parkin mRNA的表达量均显著降低(P<0.05或P<0.01),p62 mRNA的表达量显著升高(P<0.01)。结果见表3。
3.3 TEN对APP/PS1小鼠脑组织线粒体中LC3、p62、PINK1、Parkin蛋白表达的影响
与正常对照组比较,模型组小鼠脑组织线粒体中LC3、p62、PINK1、Parkin蛋白的表达量均显著升高(P<0.01)。与模型组比较,TEN低、中、高剂量组小鼠脑组织线粒体中LC3(除TEN中剂量组外)、PINK1(除TEN高剂量组显著降低外)、Parkin(除TEN低剂量组显著降低外)蛋白的表达量均显著升高(P<0.05或P<0.01),p62蛋白的表达量均显著降低(P<0.01)。与TEN中剂量组比较,TEN中剂量+3-MA组小鼠脑组织线粒体中LC3、PINK1、Parkin蛋白的表达量均显著降低(P<0.05或P<0.01),p62蛋白的表达量显著升高(P<0.01)。结果见图2、表4。
4 讨论
由于AD的发病机制复杂,导致目前还没有可治愈AD的药物或方法,因此明确该病的发病机制和研发有效的治疗药物已经成为医药界研究的难点与热点[19]。近年来研究者们发现,AD的发病机制涉及多种病理学变化,包括线粒体自噬功能障碍等[20]。大量文献报道,线粒体异常和突触功能障碍的存在是Aβ蛋白聚集或Tau磷酸化的起因[21-23],且线粒体自噬途径受损可能导致AD的发生[24-25]。
LC3是自噬体膜上的标志蛋白。在自噬体形成过程中,Atg4蛋白酶在新合成LC3的羧基端进行剪切,生成LC3-Ⅰ,随后LC3-Ⅰ通过Atg7和Atg3参与的泛素样反应与磷脂酰乙醇胺结合,形成脂质化形式的LC3-Ⅱ并附着于自噬体膜表面,LC3-Ⅱ是形成完整自噬体过程中必不可少的关键因子,因此LC3-Ⅱ常作为自噬体的标志物,而LC3-Ⅱ与LC3-Ⅰ的比值则被用来衡量自噬体的形成情况[26]。p62能够同自噬体膜上的LC3结合形成一个完整的自噬小体,随后溶酶体会与包裹着目标线粒体的自噬小体融合,形成自噬-溶酶体,最后被溶酶体内的蛋白水解酶降解,p62随即被一同降解[27]。由此可见,一个完整的自噬过程包括自噬体的形成和自噬体的清除,自噬的强弱与LC3成正比,与p62成反比。如果LC3和p62表达同时增加,只能表明自噬体已形成,但并未被正常降解,即包裹异常线粒体的自噬体没有被机体清除。有研究提示,提高APP/PS1小鼠空间学习记忆能力可能与调节LC3和p62相关的自噬水平有关[28-29]。本研究结果显示,模型组小鼠神经元内LC3的阳性分布以及脑组织线粒体中LC3、p62 mRNA及其蛋白的表达量均显著高于正常对照组,表明APP/PS1小鼠脑组织线粒体中自噬体有所增加,但自噬体没有得到较好的降解;经高剂量TEN干预后,APP/PS1小鼠神经元内LC3的阳性分布以及脑组织线粒体中LC3 mRNA及其蛋白的表达量均显著高于模型组,而p62 mRNA及其蛋白的表达量均显著低于模型组,表明TEN加快了自噬体的降解,使受损线粒体得以清除;而自噬抑制剂3-MA和TEN的共同干预结果表明,在线粒体自噬被抑制的情况下,TEN的上述作用也会受到抑制。
已有研究表明,溶酶体功能以及溶酶体与自噬小体的融合是影响线粒体自噬的重要因素[30]。溶酶体内主要的蛋白水解酶是Cathepsin D,其表达水平的高低影响着溶酶体的降解活性[31];Rab7则是调控溶酶体与自噬小体融合的关键因子[32]。有研究表明,溶酶体内蛋白水解酶活性的减弱以及线粒体自噬启动水平的降低都会使APP/PS1小鼠脑组织线粒体的自噬水平下降,提示当溶酶体功能受损后,即使能够形成自噬-溶酶体,也无法降解自噬体,致使大量包裹着受损线粒体的自噬体聚集在脑部,导致神经元异常死亡[33]。有研究发现,促进自噬体与溶酶体的融合、增强Cathepsin D的活性,可减轻神经功能受损与神经元死亡程度[34]。另有研究指出,12月龄的APP/PS1小鼠脑组织中可发现大量Aβ斑块,且Rab7活性显著减弱,提示大量Aβ斑块可能影响溶酶体功能,从而影响线粒体自噬水平[35]。本研究结果显示,APP/PS1小鼠脑组织线粒体中Cathepsin D、Rab7 mRNA的表达量均显著低于正常对照组,表明APP/PS1小鼠脑组织线粒体中溶酶体内蛋白水解酶的活性减弱,溶酶体与自噬体的融合受阻;经TEN干预后,APP/PS1小鼠脑组织线粒体中Cathepsin D、Rab7 mRNA的表达量均显著高于模型组,表明TEN能够增强APP/PS1小鼠脑组织线粒体中溶酶体内蛋白水解酶的活性和溶酶体与自噬体的融合作用。这进一步证实了TEN能够通过线粒体自噬-溶酶体系统促进自噬体与溶酶体的融合,提高线粒体的自噬水平,增强清除受损线粒体的能力。
PINK1/Parkin信号通路是介导线粒体自噬的重要途径[36]。PINK1是一种定位于线粒体外膜上的丝氨酸/苏氨酸激酶,在正常线粒体中,线粒体内膜转位酶和线粒体外膜转位酶会将PINK1转运至线粒体内,在基质金属蛋白酶和早老素相关菱形样蛋白的作用下,PINK1被降解,使PINK1无法募集位于细胞质内的Parkin[37]。当线粒体受损时,PINK1可发生自身磷酸化并募集Parkin,二者通过与p62、LC3结合,使受损线粒体被溶酶体中的蛋白水解酶降解[37]。已有研究报道,提高Parkin可降低AD模型小鼠脑组织中Aβ的含量,提高其学习记忆能力[38]。本研究結果显示,APP/PS1小鼠脑组织线粒体中PINK1、Parkin mRNA及其蛋白的表达量均显著高于正常对照组,表明APP/PS1小鼠脑组织中受损线粒体增多,PINK1无法进入线粒体内被降解清除,致使积聚于受损线粒体外膜上的PINK1通过募集游离于细胞质中的Parkin至线粒体外膜,从而启动APP/PS1小鼠脑组织线粒体的自噬;经中剂量TEN干预后,APP/PS1小鼠脑组织线粒体中PINK1、Parkin mRNA及其蛋白的表达量均显著高于模型组,表明TEN能够增强APP/PS1小鼠脑组织线粒体自噬;而3-MA和TEN的共同干预结果表明,3-MA可抑制TEN对APP/PS1小鼠脑组织线粒体自噬的增强作用。上述结果证实,APP/PS1小鼠脑组织中受损线粒体能够启动线粒体自噬,但仅仅是机体的代偿作用,自噬水平依旧不足以清除受损线粒体,而TEN能够增强线粒体的自噬水平,加快受损线粒体的清除。
综上所述,TEN可能通过激活PINK1/Parkin信号通路来诱导APP/PS1小鼠脑组织线粒体的自噬,增强溶酶体功能,为阐明TEN治疗AD的分子机制提供了科学的实验及理论依据。
参考文献
[ 1 ] KAMETANI F,HASEGAWA M. Reconsideration of amyloid hypothesis and Tau hypothesisin Alzheimers di- sease[J/OL]. Front Neurosci,2018,12:25[2021-07-10]. http://doi.org/10.3389/fnins.2018.00025.
[ 2 ] PENKE B,BOGAR F,PARAGI G,et al. Key peptides and proteins in Alzheimers disease[J]. Curr Protein Pept Sci,2019,20(6):577-599.
[ 3 ] WEI H C,LI B,NG K P,et al. Amyloidand Tau positive mild cognitive impairment:clinical and biomarker characteristics of dementia progression[J]. Chin Med J,2021,134(14):1709-1719.
[ 4 ] 田杰,孫荣欣,王萍,等.阿尔茨海默病的发病机制研究进展[J].山东医药,2018,58(27):97-100.
[ 5 ] 张瑞三.阿尔茨海默病发生发展中β淀粉样多肽与线粒体异常之间的关系[J/OL].现代医学与健康研究(电子版),2020,4(5):113-116[2021-07-10]. http://qikan.cqvip.com/
Qikan/Article/ReadIndex?id=7102331799&info=yudZm-
NYKFxo%2bJSBL3Q1%2b3hLV8Hu%2f5ScpiREP2adFOVKkfdj2E3s%2fag%3d%3d.
[ 6 ] CACCAMO A,MAJUMDER S,RICHARDSON A,et al. Molecular interplay between mammalian target of rapamycin(mTOR),amyloid-beta,and Tau:effects on cognitive impairments[J]. J Biol Chem,2010,285(17):13107-13120.
[ 7 ] LIU H,HUANG H,LI R,et al. Mitophagy protects SHSY5Y neuroblastoma cells against the TNFα-induced inflammatory injury:involvement of microRNA-145 and BNIP3[J/OL]. Biomed Pharmacother,2019,109:957-968
[2021-07-10]. http://doi.org/10.1016/j.biopha.2018.10.123.
[ 8 ] LOU G,PALIKARAS K,LAUTRUP S,et al. Mitophagy and neuroprotection[J]. Trends Mol Med,2020,26(1):8-20.
[ 9 ] CHAO H,LIN C,ZUO Q,et al. Cardiolipin-dependent mitophagy guides outcome after traumatic brain injury[J]. J Neurosci,2019,39(10):1930-1943.
[10] EGAN D F,SHACKEFORD D B,MIHAYLOVA M M, et al. Phosphorylation of ULK1(hATG1)by AMP-activated protein kinase connects energy sensing to mitophagy[J]. Science,2011,331(6016):456-461.
[11] LUTZ A K,EXNER N,FETT M E,et al. Loss of Parkin or PINK1 function increases Drp1-dependent mitochon- drial fragmentation[J]. J Biol Chem,2009,284(34):22938- 22951.
[12] DENG X X,ZHAO S P,LIU X Q,et al. Polygala tenuifolia:a source for anti-Alzheimers disease drugs[J]. Pharm Biol,2020,58(1):410-416.
[13] 陈启军,于岚,赵文文,等.远志提取物对抑郁大鼠肠道菌群的作用研究[J].中草药,2021,52(8):2313-2323.
[14] 黄秋强,林连华.安神中药远志的研究进展[J].世界睡眠医学杂志,2021,8(1):183-184.
[15] WANG J,LIU X M,CHANG Q,et al. Chemical consti- tuents from alkaline hydrolysisproducts of total saponins in Radix Palygalae[J]. Central South Pharmacy,2010,8(11):811-814.
[16] LEE J K,JIN H K,PARK M H,et al. Acid sphingomye- linase modulates the autophagic process by controlling lysosomal biogenesis in Alzheimers disease[J]. J Exp Med,2014,211(8):1551-1570.
[17] ZHAO H,WANG Z C,WANG K F,et al. Aβ peptide secretion is reduced by Radix Polygalae-induced autophagy via activation of the AMPK/mTOR pathway[J]. Mol Med Rep,2015,12(2):2771-2776.
[18] JIA H,JIANG Y,RUAN Y,et al. Tenuigenin treatment decreases secretion ofthe Alzheimers disease amyloid β-protein in cultured cells[J]. Neurosci Lett,2004,367(1):123-128.
[19] LIU Y,CONG L,HAN C,et al. Recent progress in the drug development for the treatment of Alzheimers di- sease especially on inhibition of amyloid-peptide aggregation[J]. Mini Rev Med Chem,2021,21(8):969-990.
[20] 李鳳娇,顾雯,俞捷,等.线粒体自噬机制、相关疾病及中药对其调节作用的研究进展[J].中国药房,2018,29(20):2865-2871.
[21] CAI Q,TAMMINENI P. Mitochondrial aspects of synaptic dysfunction in Alzheimers disease[J]. J Alzheimers Dis,2017,57(4):1087-1103.
[22] GUO L,TIAN J,DU H. Mitochondrial dysfunction and synaptic transmission failure in Alzheimers disease[J]. J Alzheimers Dis,2017,57(4):1071-1086.
[23] TANG J,OLIVEROS A,JANG M H. Dysfunctional mitochondrial bioenergetics and synaptic degene ration in Alzheimer disease[J]. Int Neurourol,2019,23(Suppl1):S5-S10.
[24] KERR J S,ADRUAANES B A,GREIG N H,et al. Mitophagy and Alzheimers disease:cellular and molecular mechanisms[J]. Trends Neurosci,2017,40(3):151-166.
[25] BELL S M,BARNES K,DEMARCO M,et al. Mitochondrial dysfunction in Alzheimers disease:a biomarker of the future[J/OL]. Biomedicines,2021,9(1):63[2021-07-
10]. http://doi.org/10.3390/biomedicines9010063.
[26] KABEYA Y,MIZUSHIMA N,UENO T,et al. LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J]. EMBO J,2000,19(21):5720-5728.
[27] DING W X,NI H M,LI M,et al. Nix is critical to two distinct phases of mitophagy,reactive oxygen species-mediated autophagy induction and Parkin-ubiquitin-p62-mediated mitochondrial priming[J]. J Biol Chem,2010,285(36):27879-27890.
[28] 贾宁,张泽,韩锟.黄芪多糖对APP/PS1转基因小鼠认知功能的自噬及凋亡的改善作用机制研究[J].中国临床药理学杂志,2020,36(20):3328-3331.
[29] 高杨,李丽娜,毛颖秋,等.电针对APP/PS1双转基因小鼠学习记忆能力及LC3 Ⅱ、p62表达水平的影响[J].长春中医药大学学报,2017,33(4):523-526.
[30] PALIKARAS K,TAVERNARAKIS N.Mitophagy in neurodegeneration and aging[J/OL]. Front Genet,2012,3:297[2021-07-10]. http://doi.org/10.3389/fgene.2012.00297.
[31] 刘怿君,段树民.溶酶体水解酶Cathepsin D的细胞生物学功能[J].蚌埠医学院学报,2018,43(10):1266-1274.
[32] HYTTINEN J M,NIITTYKOSKI M,SALMINEN A,et al. Maturation of autophagosomes and endosomes:a key role for Rab7[J]. Biochim Biophys Acta,2013,1833(3):503- 510.
[33] NILDDON P,SAIDO T C. Dual roles for autophagy:degradation and secretion of Alzheimers disease Abeta peptide[J]. Bioessays,2014,36(6):570-578.
[34] DENG Y H,DONG L L,ZHANG J Y,et al. Enriched environment boosts the post-stroke recovery of neurological function by promoting autophagy[J]. Neural Regen Res,2021,16(5):813-819.
[35] BA L,CHEN X H,CHEN Y L,et al. Distinct Rab7-related endosomal-autophagic-lysosomal dysregulation observed in cortex and hippocampus in APPswe/PSEN1dE9 mouse model of Alzheimers disease[J]. Chin Med J,2017,130(24):2941-2950.
[36] MA H J,GUO Z Y,GAI C,et al. Protective effects of buyinqianzheng formula on mitochondrial morphology by PINK1/Parkin pathway in SH-SY5Y cells induced by MPP+[J]. J Tradit Chin Med Sci,2020,7(3):274-282.
[37] 湯友静,牛玉娜,王辉. PINK1/Parkin介导的线粒体自噬分子机制[J].中国细胞生物学学报,2017,39(7):939- 946.
[38] 张子怡,康伟民,张晟,等.高强度间歇运动训练上调APP/PS1转基因阿尔兹海默病小鼠海马线粒体自噬的研究[J].中国康复医学杂志,2020,35(6):670-675.
(收稿日期:2021-07-12 修回日期:2021-10-11)
(编辑:邹丽娟)

