植物DNA甲基化研究进展
陈子涵,任建国,王俊丽
(贵州医科大学公共卫生与健康学院,环境污染与疾病监控教育部重点实验室,贵阳 550025)
0 引言
DNA 甲基化(DNA methylation)是目前表观遗传学研究较为清晰的机制之一,广泛存在于生物界中,是真核细胞中最为常见的一种基因组修饰方式,它在调节基因组功能的同时不改变DNA 的碱基序列。在植物中DNA 甲基化主要包括从头甲基化和维持甲基化两类。植物基因组主要通过甲基化酶(CMT)和甲基化转移酶(DRM)来催化和维持DNA 甲基化。研究发现DNA甲基化水平与部分疾病的发生、发展有关[1],能够影响动植物长发育、改变植物的花期[2-3],帮助植物抵抗逆境胁迫,有效调控基因和保证基因组的稳定性。
对于植物而言,面对生长环境的改变,表观遗传的变异会改变植物DNA的构象,从而改变染色质和蛋白质的结构,达到调节基因组的作用。研究发现,当植物面临生物胁迫和非生物胁迫时,植物基因组中DNA甲基化会发生改变,并且这些改变会遗传给后代。综上所述,DNA 甲基化的改变能够丰富植物物种的多样性,加强植物的环境适应性,为此,本研究整理了近年来植物DNA 甲基化的模式、生物学功能以及研究方法,以期深入了解DNA 甲基化对植物的影响,为植物基因组的深入研究提供一定的理论依据。
1 植物DNA甲基化模式
植物DNA甲基化是从头甲基化、维持甲基化和活性去甲基化的动态调节结果,这些活动由不同的酶催化,通过不同的途径作用于特定的基因组区域。植物发生DNA 甲基化的胞嘧啶序列有:CG,CHG 和CHH(H 代表A,T 或C)[6-7]。目前已知植物DNA 甲基化的方式主要有两种,一种是从头甲基化,另一种是维持甲基化。
1.1 从头甲基化
从头甲基化(De novomethylation)是通过不同的DNA甲基转移酶对DNA进行催化,使2条未甲基化的DNA 被甲基化。在拟南芥(Arabidopsis thaliana)中,从头甲基化是通过RNA 介导的DNA 甲基化(RdDM)途径实现的,该途径涉及支架RNA(scaffold RNA)、小干扰RNA(siRNA)和一系列的蛋白质,主要内容见图1。在RdDM 途径中,通过RNA 聚合酶IV(POL IV)的参与募集转座子和相关结构域元件后形成非编码RNA(P4 RNA),在RNA聚合酶2(RDR2)介导下合成双链 RNA(dsRNA),被 DICER-LIKE PROTEIN 3(DCL3),DCL2和DCL4切割,产生24个核苷酸的小干扰RNA(siRNAs)[8]。随后,siRNAs 与ARGONAUTE 4(AGO4)或AGO6 结合,与RNA 聚合酶V(POL V)转录的互补支架RNA 配对,AGO4 与DOMAINS REARRANGED METHYLASE 2 (DRM2)相互作用,DRM2能够使DNA从头甲基化。

图1 拟南芥中RNA介导的DNA甲基化途径的模型
SHH1(SAWADEEHOMEODOMAINHOMO LOGUE1)是POL Ⅳ产生siRNA时所必需的[10],SHH1在RdDM途径中发挥上游作用,募集POLⅣ以促进siRNA的生物合成。同时,SHH1 SWADEE 域能采用独特的串联Tudor-折叠与组蛋白H3K9me2 结合,SHH1 中的DTF1转录因子能够与SNF2 DOMAINCONTAINING PROTEIN CLASSY 1(CLSY)互作用,协助POL IV参与RdDM途径中CHH甲基化[9-10]。POLⅡ通过DCL3 切割产生24nt siRNAs[11],或者通过RDR6识别POLⅡ衍生的TE mRNA转录物,产生21nt/22nt siRNAs 参与从头甲基化,触发和建立TE 甲基化[12]。POLⅤ生成支架RNA需要DDR复合物参与,该复合物是由DEFECTIVE IN RNADIRECTED DNA METHYLATION 1 (DRD1)、DEFECTIVE IN MERISTEM SILENCING 3 (DMS3) 和 RNADIRECTED DNA METHYLATION 1 (RDM1)共同形成,能够与SUPPRESSOR OF VARIEGATION 3-9 HOMOLOGUEPROTEIN 2 (SUVH2)和SUVH9 结合,从而募集POL V 发挥DNA 甲基化作用[13-14]。RNA 结合蛋白RRP6-LIKE 1 (RRP6L1)和INVOLVED IN DE NOVO 2 (IDN2)-IDN2 PARALOGUE (IDP)复合物(IDN2-IDP complex)可以帮助将POL V转录的RNA在保留在染色上,并与SWI/SNF 染色质重塑复合物(SWITCH/SUCROSE NONFERMENTING chromatinremodeling complex,SWI/SNF)相互作用,通过改变核小体的结构来参与POLⅤ介导的DNA甲基化[15-18]。
1.2 维持甲基化
维持DNA甲基化是指DNA双链中一条链已发生甲基化,另一条未甲基化的链被甲基化。植物DNA甲基化的维持依赖于胞嘧啶序列,并由不同调控机制的DNA甲基转移酶催化(见图2)[27]。
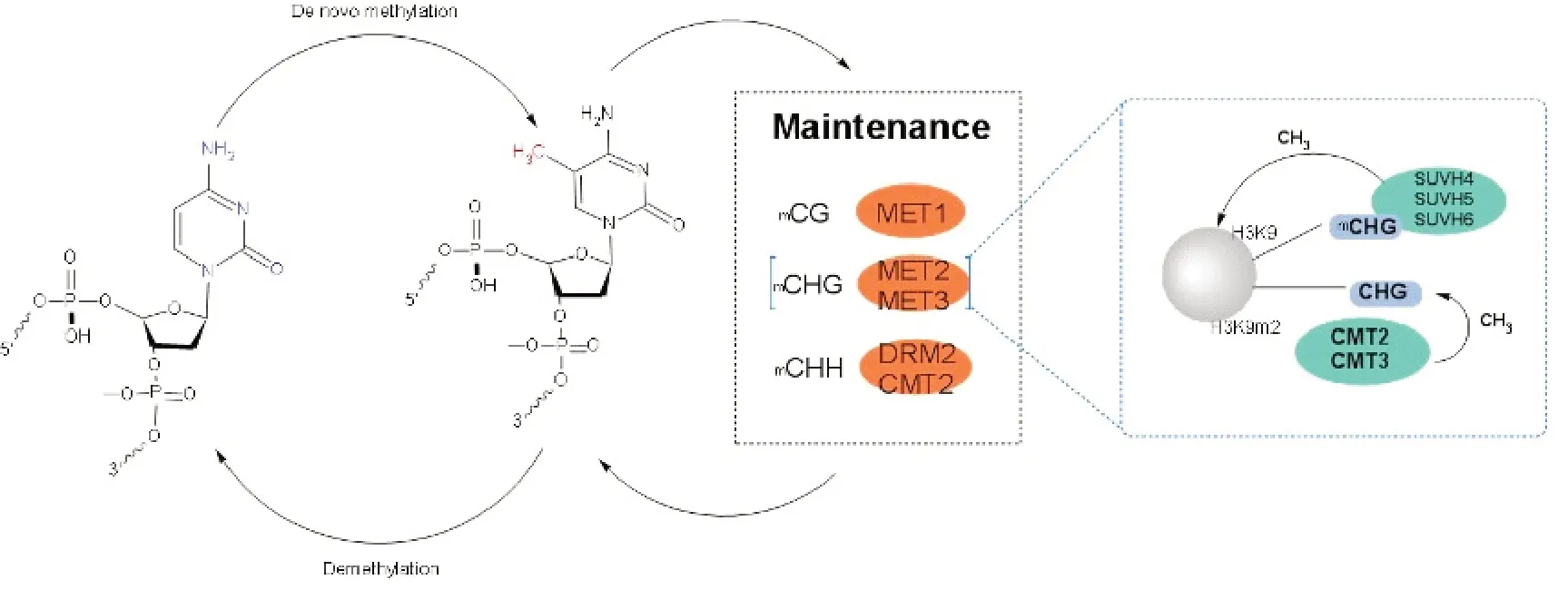
图2 植物DNA甲基化的动态调节
染色质甲基化酶(CMT)是植物特有的DNA 甲基转移酶[9]。它与小鼠Dnmt1、MET1结构相似,与MET1不同之处在于,CMT 能够修饰异染色质DNA。在拟南芥中已经识别了3 个CMT 基因[24],其中CMT1 在拟南芥各器官中表达水平很低,被认为是没有功能的[19],CMT3和CMT2主要依赖于组蛋白H3K9去甲基,维持拟南芥CHG 甲基化[20]。与H3K9me2 复合的玉米CMT3同源物ZMET2晶体结构表明,ZMET2通过BAH 结构域(bromo-adjacent homology,BAH)与组蛋白H3K9me2结合[21]。拟南芥H3K9特异性甲基转移酶SUVH4(SUPPRESSOR OF VARIEGATION 3-9 HOMOLOGUE PROTEIN 4)及其旁系SUVH5 和SUVH6 的突变消除了H3K9me2 形成,并大大降低了CHG甲基化水平[22]。
MET 甲基转移酶家族(MET1)由Finnegan 等[24]从拟南芥中分离出,是最早发现的植物甲基转移酶,它是小鼠Dnmt1 甲基转移酶的同源物,二者结构域有50%的同源性。它的主要作用是在重复和单拷贝DNA 序列中维持CG二核苷酸胞嘧啶甲基化。具体功能是将酶引向细胞核,识别未甲基化或半甲基化的胞嘧啶,使酶移向复制叉,并使其在S 期对半甲基化模板具有高度选择性[25]。Kankel等[26]通过反义转基因或错义突变使拟南芥MET1 功能受损,发现其CpG 位点的甲基化水平降低,植物的生长发育也受到了一定的影响。
植物域重排甲基转移酶(DRM)家族包括Zmet2、DRM1 和DRM2,在玉米和拟南芥中发现其与哺乳动物从头甲基转移酶(Dnmt 3)结构相似,只在催化结构域模体排列顺序不同[28]。DRM 是在RNA 的指导下,维持非CpG 位点的胞嘧啶甲基化和催化胞嘧啶从头甲基化[25]。CHH甲基化由具体的基因组区域所决定,通过RdDM 途径,DRM2 可以在RdDM 目标区域维持CHH甲基化,RdDM目标区域优先位于年轻的转座子和短转座子以及长转座子的边缘,通常位于异染色质[29-31]。相比之下,CMT2 则在RdDM 途径催化CHH甲基化。
2 植物DNA甲基化的生物学功能
DNA甲基化是重要的表观遗传修饰之一,广泛分布于常染色质的转座子区、转录不活跃基因的启动子区以及异染色质区,进而影响遗传信息的可获得性。
2.1 DNA甲基化对植物生长发育的调控
在生长和发育期间以及整个植物的生命周期中,不同组织或细胞类型中的DNA 甲基化水平受到严格控制,这表明DNA 甲基化在植物生理中发挥重要作用。
研究发现,DNA 甲基化表达水平的高低,会影响植物的生长发育。在对马哈利樱桃(Prunus mahaleb)进行研究时发现其基因组甲基化水平矮化组甲基化水平高于半矮化组[32]。刘琼瑶等[33]通过对矮生观赏杉木(Dwarf Ornamental)DNA甲基化的水平进行研究发现,矮生观赏杉木DNA甲基化水平和野生杉木叶片DNA甲基化水平差异呈现极显著水平。李际红等[34]发现叶籽银杏(Ginkgo bilobavar.epiphylla)的甲基化水平高于银杏,并且二者之间甲基化程度和(或)模式均存在广泛的变异,提示DNA甲基化水平及模式与植物生长发育特性有关。
多个研究证明在植物自主开花和春化作用中,DNA 甲基化起着重要的作用[1,35-37]。DNA 甲基化表达水平的降低能够促进植物花期提前,通过对小麦进行一定浓度的5-氮杂胞苷的干预,发现处理组的小麦抽穗和开花较非处理组早1 天以上,并且其余农艺性状基本保持一致。同时还发现,适量降低DNA甲基化水平能够在一定程度上增加小麦的产量[3]。新的研究中发现,DNA甲基化不仅在在动物发育过程中被广泛的重新编程,且在开花植物中也能够进行编程,并有助于开花植物的果实成熟[38]。
DNA 甲基化也参与了植物的果实成熟过程。番茄作为呼吸跃变型果实,经研究发现DNA低甲基化和DNA 去甲基化酶的上调参与调控了番茄果实的成熟[39]。草莓是非呼吸跃变型果实,Cheng等[40]发现在草莓成熟期将DNA 甲基化水平下调能够明显诱导草莓提前成熟,并发现这种下调是由于RdDM通路活性降低引起。但目前除番茄和草莓外,其他的植物果实发育过程是否与DNA甲基化表达水平有关,以及其能否调控果实成熟的具体机制尚不清楚,还需要进行深入研究。
2.2 DNA甲基化在植物生物胁迫中的作用
生物胁迫是指对植物生存与发育不利的各种生物因素的总称。植物为了抵御病原菌的生长,通过改变植物细胞中DNA甲基化的表达水平,以抵御病原体的感染和共生微生物的定殖。
病毒侵袭导致百合DNA 甲基化水平整体下降[41]。烟草被烟草花叶病毒(TMV)感染后,烟草的DNA 甲基化水平下降,胁迫响应基因NtAlix1 上调[42]。蒺藜苜蓿(Medicago truncatula)中的根瘤需要脱甲基酶基因DEMETER(DME)的作用,在结瘤形成过程中,数百个基因组区域被甲基化,包括一小部分结瘤特异性共生基因[45],另一个方面结瘤特异性基因的表达与染色质的倍性依赖开放有关,在一部分被测基因中,H3K27me3水平降低,而H3K9ac水平升高[44]。
在被囊肿线虫(Heterodera glycine,SCN)感染的大豆和拟南芥根中观察到DNA甲基化水平降低[45-46]。灰斑病菌(Cercospora sojina)侵袭大豆,使其感染灰斑病,影响到大豆的品质和产量,通过研究灰斑病菌胁迫下大豆基因组的DNA 甲基化水平发现,其DNA 甲基化表达水平下降明显,DNA且甲基化模式以去甲基化为主[47]。由此可见,抗病相关基因的低甲基化,将有利于植物抗病基因的表达,或者得到抗病基因,提高自身抗病性。
丁香假单胞菌番茄致病变种(Pseudomonas syringaepv.tomato,Pst DC3000)侵袭拟南芥叶片会引起轻度但广泛的差异DNA 甲基化。差异甲基化的胞嘧啶主要存在于CG 和CHH 基因富集区域,特别是在蛋白质编码基因的5'和3'末端。此外,Pst DC3000 响应的拟南芥DNA 甲基化与整个基因组邻近基因的表达水平呈负相关[48]。REPRESSOR OF SILENCING1(ROS1)的DNA 脱甲基酶阻遏物及其同系物转录激活剂样(DME)-LIKE 2(DML2)和DML3 后通过去除邻近DNA甲基化,共同调节许多生物胁迫响应基因[49]。这表明植物可以动态调节DNA甲基化,从而调节防御基因的表达。
2.3 DNA甲基化在植物非生物胁迫中的作用
随着温度的变化,植物通过DNA甲基化和去甲基化的可逆动态变化维持自身稳定性。在秋末低温条件下,西洋参芦头的DNA 甲基化水平升高,春初升温时DNA 甲基化水平下降,在春初至秋末整个苗期,西洋参毛根中的DNA 甲基化水平呈现上升趋势。研究后发现,只有经历足够的自然低温,西洋参幼苗在春季气温回升时DNA甲基化水平才能显著下降,同时开花基因PqFT在开花期和皂苷合成基因PqDDS在绿果期才能出现特定的高表达,从而增加皂苷的产量,提高西洋参的药用质量[50]。番茄果实的成熟与DNA 甲基化的改变密切相关,Zhang等[51]在研究后发现,在低温状态下,DNA脱甲基酶DML2被抑制,导致DNA甲基化过度,显著延迟了果实成熟和风味挥发物的生成,这也解释了为什么成熟番茄果实冷藏后会大大降低风味品质。
中国常用的中药材半夏(Pinellia ternate),在高温胁迫状态下,基因组DNA 甲基化水平显著降低,同时发现,DNA甲基化水平不会随胁迫时间增加而明显改变,这说明半夏对于高温胁迫能够迅速适应。对甲基化的变异类型进行分析后可以发现,DNA 甲基化和DNA 去甲基化均被诱导发生[52]。对棉花进行高温胁迫,发现其基因组DNA甲基化和去甲基化能够同时发生,但呈现出明显的品种差异性,甲基化主要发生在耐高温品种,去甲基化则发生在高温敏感品种[53]。曾子入等[54]利用甲基化敏感扩增多态性技术(MSAP)分析发现,高温胁迫下萝卜肉质根的DNA甲基化发生明显改变,耐热材料部位主要发生去甲基化,不耐热材料部位发生超甲基化。综上所述,植物能够通过DNA甲基化改变来维持基因组稳定,从而抵御高温胁迫,同时提示植物DNA甲基化水平和状态与品种的耐热性有关,为深入研究植物耐热品种的进化提供了一定参考。
光照是植物生长必不可少的条件之一,但光照量超过光合系统的需求量时,会出现“光抑制现象”,导致活性氧自由基(ROS)的积累,抑制植物的生长[55]。施江等[56]对半夏进行遮荫处理后发现,遮荫显著提升半夏基因组DNA甲基化水平,同时在遮荫条件下,DNA甲基化率高于DNA 去甲基化率(32.51%>16.25%),提示遮荫调控部分基因的表达可能通过DNA 甲基化修饰实现。
通过对蒙古黄芪(Mongolia Astragalus)进行干旱胁迫后,经过MSAP 分析,发现其DNA 甲基化程度随着干旱程度的增加呈现下降趋势,与胁迫呈显著负相关[57],提示了DNA甲基化与植物抗干旱之间存在一定的关联性,但其应对干旱的调控机制尚不清楚,需要进行进一步研究。潘雅姣等[58]研究发现,水稻基因组在干旱胁迫状态下,基因组CCGG位点发生了DNA甲基化,且表达的平均水平明显增加,根部增幅最为明显,认为DNA甲基化有一定时空特异性和品种特异性,与品种抗旱性反应密切相关。Xu[59]在单碱基分辨率水平上绘制了胞嘧啶甲基化的图谱,并分析了干旱敏感和耐旱品种在干旱胁迫下的基因表达变化,发现启动子非甲基化的基因显示出比启动子甲基化的基因更高的表达水平。编码转录因子(transcription factors,TFs)和转座因子(transposable elements,TEs)基因的甲基化与苹果抗逆机制有关。该研究在全基因组上揭示了干旱胁迫导致苹果甲基化组变化的特点,将有助于研究响应非生物胁迫的甲基化调节作用。
在逆境胁迫状态下,植物的DNA去甲基化主要依靠去甲基化酶基因介导的Ros1(Repressor of Silencing 1)切除5-meC 的游离碱基实现的[60]。Ros1 具有DNA糖苷酶活性和AP 核酸内切酶活性,能够切断N-糖苷键和裂解脱碱基位点,之后通过碱基切除修复机制(Base excision repair,BER)以及DNA 聚合酶、DNA 连接酶一同修复完成DNA 去甲基化进程。在盐胁迫状态,观察盐穗木(Halostachys caspica)的DNA 甲基化水平和Ros1 的表达程度,发现DNA 甲基化水平与Ros1的表达量呈明显负相关,盐胁迫状态下Ros1的表达增加,DNA 甲基化水平降低,从而提高了盐穗木的耐盐性[61]。在前期研究中,董蔚等[62-63]首次从蒺藜苜蓿(Medicago truncatula)中分离了MYB 家族转录因子基因MtMYBS1,证实其是参与植物盐胁迫的重要功能基因,盐胁迫下MtMYBS1 的表达与DNA 甲基化水平呈负相关,与蛋白H3K9ac 修饰水平呈正相关。由此可见,植物能够通过调控DNA甲基化水平以及相关基因的表达程度,提高植物的抗盐能力。
不同浓度的Cd、Cu 胁迫会导致拟南芥幼苗基因组DNA甲基化水平整体提高[64]。萝卜基因组在Pb胁迫下DNA全甲基化率上升,主要是重新甲基化[65]。不同浓度Cd 胁迫下,孔雀草(Tagetes patula)基因组DNA全甲基化率随着Cd浓度的增加逐渐上升,其主要的甲基化模式为重新甲基化[66]。中华水韭重金属Pb 和Cd的胁迫下,基因组DNA 甲基化的总体水平变化不大,但全甲基化水平略有降低,半甲基化水平略有上升[67]。研究发现,大豆在镉胁迫下基因组DNA甲基化的整体水平升高,同时甲基化多态性也有所提升,且与镉处理浓度呈正相关,其中甲基化模式的改变主要以去甲基化为主[68]。相关研究发现,重金属胁迫下,植物DNA甲基化水平与重金属的浓度有关,小麦幼苗根系的DNA甲基化水平随着Cd的浓度的增加呈现出先上升后下降的趋势[69]。上述研究报道提示重金属胁迫对植物甲基化水平的影响存在着多种反应机制,但是针对重金属胁迫的研究主要是针对植物DNA 甲基化水平,而对特定基因位点参与DNA甲基化的研究较少。
3 植物DNA甲基化的研究方法
DNA 甲基化的检测最早开始于1980 年,Kuo[70]采用高效液相色谱柱(HPLC)对基因组DNA甲基化进行了测定。近年来,DNA甲基化研究在模式植物和作物中取得了重要发展,检测方法也不断更新。一般来说,植物DNA 甲基化的检测过程分为待检测样品的前期处理、特定位点定位和甲基化状态的检测。现将用于植物DNA甲基化检测方法归纳(表1)如下。

表1 常用植物DNA甲基化检测技术
HPLC是一种出现较早的DNA甲基化检测技术,广泛用于检测植物的全基因组DNA甲基化水平,包括棉花、茶树、相思树、红豆杉等[76-79]。Gao[80]等通过优化的HPLC技术对茶树(Camellia sinensisL.)组织,品种和生长期进行了DNA 甲基化水平的测定,发现DNA 甲基化水平在各个组织各有不同,在不同的生长期甲基化水平的模式则形成了一个鞍形曲线。该方法的优点是在不需要参考基因组的条件下,就能对植物进行全基因组DNA甲基化水平的测定,缺点是操作体系较为复杂[81]。
甲基化敏感扩增多态性法(MSAP)是一种以AFLP技术为原理检测DNA 甲基化的PCR 技术,通过限制性内切酶MspⅠ和HpaⅡ识别CCGG序列上胞嘧啶甲基化,这两种酶对特定的胞嘧啶甲基化具有不同的敏感性,其中HpaⅡ只能识别mCCGG 即单链DNA 外侧甲基化位点;MspⅠ能够识别CmCGG即双链或者单链DNA的内侧甲基化位点。将相同的DNA序列扩增出不同的谱带以判断5’-CCGG 位点的胞嘧啶甲基化水平[82-83]。目前该技术大量使用于紫罗兰、拟南芥、马铃薯、丹参等植物的甲基化模式和水平检测上[84-87]。MSAP技术的优势[88]在于经济效益高,成本低,能够研究缺少基因组测序的非模式生物,还能够批量筛选所研究基因组中的突变和分化。同时该技术也有一定的局限性,因限制性内切酶具有一定的选择性,所以可能会遗漏一些甲基化状态。
全基因组亚硫酸盐测序(WGBS)技术是将新兴的高通量测序技术与亚硫酸盐转化方法相结合,能够对动植物的DNA 甲基化进行单碱基解析和全基因组分布分析,可以识别可能受到DNA甲基化和脱甲基化动态变化控制的基因,是目前甲基化测序的金标准[89]。Sun 等[90]利用WGBS 技术构建了西瓜(Citrullus lanatus)的全基因组DNA 甲基化谱,结合RdDM 通路基因的下调表明,被黄瓜绿斑驳花叶病毒(Cucumber Green Mottle Mosaic Virus,CGMMV)感染的西瓜,RdDM 导向的CHH 甲基化降低在西瓜抗病毒防御中发挥重要作用。这与之前对挪威云杉(Norway pruce)的检测结果相符合[91]。WGBS 也有一定的局限性,由于其价格昂贵,目前多用于具有高质量参考基因组的物种应用,不能够广泛应用于大型实验设计,特别是中型至大型植物基因组。
简并代表性亚硫酸氢盐测序技术(RRBS)作为一种经济有效的体外方法,可用于没有参考基因组的生物,并且比以前的基于标记的方法具有更高的分辨率,通过使用限制性内切酶对基因组进行酶切,用高通量进行测序,对基因组甲基化水平进行测序。该技术最初是为哺乳动物研究开发的,所以主要集中于富含GC的区域(CpG岛)的甲基化。Matin等[92]使用优化的双限制性核酸内切酶消化,片段末端修复,衔接子连接,亚硫酸氢盐转化,PCR 扩增和新一代测序(NGS),建立了一种有效的植物甲基化基因组分析方法(Plant-RRBS),该方法主要检测水稻中假定的启动子区域和未注释区域的胞嘧啶甲基化。Plant-RRBS 通过使用优化的核酸内切酶组合从可重复覆盖的基因组片段中获得有效读取数来提供高通量、广泛的、基因组分散的甲基化检测,从而促进了多样本研究的比较分析,以分析实验材料和植物中的胞嘧啶甲基化和跨代稳定性繁殖种群。
甲基化DNA免疫共沉淀测序技术(MeDIP-seq)是通过免疫共沉淀法预处理DNA,使用抗甲基胞嘧啶核苷抗体富集甲基化的DNA 片段,通过对CpG 密集的甲基化区域进行高通量测序,快速准确的检测全基因组的甲基化状态和分布特征[93-94]。相较于MeDIPchip,该方法灵敏度更高,更适合用于大样本量的研究,Vining[95]对毛果杨(Populus trichocarpa)7 种不同组织类型进行了DNA 甲基化变异性及其与基因表达关系的研究中就使用了该方法。
目前新兴的第三代测序技术是分子测序,主要包括单分子实时测序技术(SMRT)和牛津纳米孔测序技术(Oxford Nanopore Nechnologies),能够直接检测甲基化的DNA序列,如PacBio SMRT技术是利用在测序过程中碱基修饰时DNA聚合酶的合成速度减慢,出现信号延迟的时间来检测甲基修饰情况[96],但这一代技术价格较为昂贵,目前较难进行广泛的应用。
PaciMeDIP-chip 利用5-甲基胞嘧啶的单克隆抗体,通过免疫沉淀法富集甲基化片段,经荧光探针标记,与CG 岛芯片进行杂交,对杂交信号进行分析,每个点信号的强度对应甲基化状态。该方法以在拟南芥[97]和水稻[98]的DNA甲基化检测上得到应用。
随着对植物表观遗传修饰的深入研究和高通量测序技术的进一步发展,DNA甲基化的检测技术将会不断完善,应用于难以测序的区域,能够有效提高植物DNA 甲基化数据的挖掘和处理,获得更多的生物信息。
4 展望
DNA 甲基化是一种表观遗传方式,具有可逆性。DNA 甲基化在高等真核生物中的主要作用是在逆境状态下保护基因组内源DNA,在植物的生长发育、作物产量以及逆境胁迫等方面发挥了重要作用,特定区域的DNA甲基化能够稳定遗传给后代,起到抗逆保护的作用,帮助植物有效抵御外界威胁。近年来人们虽然已经对植物DNA甲基化的研究有了一定进展,但针对植物DNA甲基化的作用机制还不明确,亟待解决的问题有以下几点:(1)植物DNA 甲基化所涉及的信号传递与转导机制尚不明确。现有的研究多以植物DNA甲基化表达水平作为研究目标,对其具体的机制研究较少,因此有必要对其如何控制复制起始进行进一步的研究;(2)DNA 甲基化调控植物生长发育的机制尚不明确,植物面对逆境胁迫时DNA甲基化的特定位点和具体响应机制也不够深入;(3)已有大部分针对5-mC 的研究,但对N6-mA 在植物中的作用功能的研究国内较为少见。因此,今后的研究可从分子和细胞水平阐明DNA甲基化的分子调控机制,探寻基因层面的植物抗逆机制,为植物新品种的培育和改良提供一定的理论依据。

