恒古骨伤愈合剂对人骨髓间充质干细胞生长、分化的影响及机制研究
张 瑞,柳围堤,程自超,杜怀峰
(西安交通大学医学院附属3201医院康复医学科,陕西 汉中 723000)
成骨细胞介导骨形成,破骨细胞介导骨吸收,两者平衡在维持正常骨代谢过程中具有关键作用,调控该平衡对防治骨质疏松有积极意义[1]。骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)系存在于骨髓基质的非造血细胞来源细胞亚群,骨髓液含量最多,近年来其诱导成骨分化的作用日益引起骨科研究者的重视[2]。研究[3]发现,转化生长因子-β1(Transforming growth factor-β1,TGF-β1)信号通路在BMSCs成骨分化中有重要作用,间充质干细胞TGF-β1信号通路可促成其增殖及成骨分化,成骨细胞TGF-β1信号则可调控成骨晚期分化,参与钙盐沉积及胶原分泌过程。Smad蛋白为TGF-β受体作用信号传导的中介分子,其中Smad2、Smad3可被TGF-β1受体活化,通过磷酸化方式激活,与Smads4形成复合物,转导骨形态发生蛋白与受体结合,协同影响成骨基因转录[4]。目前对中药调控TGF-β1/Smads信号通路的研究相对少见。恒古骨伤愈合剂主要成分为三七、红花、黄芪、人参等,早期民间常用于骨病、骨折治疗[5-6]。有临床报道[7-8]证实,恒古骨伤愈合剂对骨质疏松性骨折有肯定的效果,对改善骨质疏松模型动物骨微结构有重要意义。但对于恒古骨伤愈合剂是否存在促骨形成作用及其对TGF-β1/Smads信号的调节作用,目前尚未明确。因此,本研究应用全骨髓贴壁法分离及培养人骨髓间充质干细胞(Human bone mesenchymal stem cells,hBMSCs),并以恒古骨伤愈合剂诱导hBMSCs,探讨恒古骨伤愈合剂对TGF-β1/Smads信号通路成骨细胞分化的影响及机制。
1 材料与方法
1.1 细胞来源 hBMSCs均取自健康成年志愿者。
1.2 主要试剂 恒古骨伤愈合剂(批号:Z20025103;云南克雷斯制药股份有限公司),胎牛血清(批号:11011-8611;北京索莱宝科技有限公司),F12和DEME培养基(美国Gibco公司),四氮唑盐比色(MTT)试剂盒和胰蛋白酶(美国Bid-Rad公司),BCA蛋白浓度测定试剂盒(批号:12104A46;美国Thermo Fisher公司),TRIzol试剂盒(美国Invitrogen公司),RNA抽提试剂盒和DNA反转录试剂盒(美国Sigma公司),SYBR Green super Mix(大连宝生生物科技有限公司),定量PCR试剂盒和引物设计及合成(日本TaKaRa公司),碱性磷酸酶(ALP)试剂盒(美国Invitrogen公司),ALP染液(上海碧云天生物科技有限公司),鼠单克隆Smad2/3/4抗体(一抗)(批号:AG07244496;美国Abcam公司),辣根标记羊抗小鼠IgG(二抗)(批号:No.BSTiZH24C54;美国Proteintech公司)。
1.3 主要仪器 CO2细胞培养箱(美国Thermo公司),倒置显微镜(日本Olympus公司),凝胶成像分析系统(美国Bio-Rad公司),荧光定量PCR仪(美国Biometra公司),DYY-2电泳仪(北京六一仪器厂),ELX 800型酶标仪(美国Bid Tek公司)。
1.4 细胞培养 取健康志愿者捐献骨髓,无菌条件下髂后上棘骨穿刺,抽取肝素化骨髓液2~5 ml,全骨髓贴壁法[9]培养hBMSCs,细胞生长融合至80%时按1∶2比例进行传代,吸去培养液,磷酸盐缓冲液(PBS)洗涤2次,加入胰蛋白酶消化30 s,80%细胞变圆后轻拍培养瓶促使细胞脱壁,加F12完全培养基3 ml终止消化。细胞悬液转移至离心管,1200 r/min离心5 min,弃上清,加3 ml F12培养基重选,按3×104个细胞/cm2接种于培养瓶内,加4 ml F12完全培养基培养。细胞均匀贴壁厚,取生长良好第3代细胞,按5×103个/孔接种于96孔板,加完全培养基200 μl/孔培养24 h。细胞充分贴壁后,PBS洗涤3次,分为对照组(含10%胎牛血清DMEM培养基)和研究组(恒古骨伤愈合剂诱导,1.0 mg/ml)。研究组24 h细胞周期同步后添加含1.0 mg/ml恒古骨伤愈合剂血清培养基培养,48 h后去培养基,加MTT工作液100 μl,37 ℃培养4 h后弃上清,加100 μl二甲基亚砜,震荡10 min,分别于48、72、96 h应用酶标仪于490 nm处读取吸光度(OD)值,重复3次取均值,绘制培养不同时间细胞增殖曲线。
1.5 ALP染色 取生长良好第3代hBMSCs,按5×104个/孔接种于96孔板,加1.5 ml完全培养基。细胞贴壁至80%后,对照组继续完全培养基,研究组给予含恒古骨伤愈合剂血清培养基,均设5个复孔,1周后加ALP染液,37 ℃孵育0.5 h后弃染液,蒸馏水漂洗3次,干燥后封片,在倒置显微镜下观察细胞形态变化。
1.6 实时荧光定量PCR(RT-PCR)检测目的基因相对表达量 两组细胞培养1周后,参照RNA抽屉试剂盒使用说明提取总RNA。浓度及纯度满意后,1%琼脂糖电泳检测RNA完整性,反转录合成cDNA,RT-PCR仪测定TGF-β1、ALP、人Ⅰ型胶原(Col Ⅰ)、骨钙素(OCN)、核因子-κB活化因子受体配体(RANKL)、破骨细胞抑制因子(OPG)相对表达量。PCR反应体系:cDNA 1.0 μg+正反向引物各0.5 μg+双蒸水10.5 μl+SYBR Green 12.5 μl,引物序列见表1。PCR扩增条件:95 ℃预变性180 s,95 ℃变性30 s,60 ℃退火60 s,72 ℃延伸60 s,共30个循环后,72 ℃延伸10 min,以GAPDH为内参。循环反应完毕后PCR产物于2%琼脂糖凝胶电泳,溴化乙啶染色,凝胶成像系统成像。以2-△△CT法计算各目的基因相对表达量。

表1 各基因引物序列
1.7 Western blot测定p-smad2/3蛋白表达 两组细胞融合至80%时,细胞裂解液裂解提取总蛋白,10% SDS-聚丙烯酰胺凝胶电泳分离等量蛋白质,每孔30~50 μg,转移至聚偏二氟乙烯膜,PBS冲洗3次,加一抗孵育,4 ℃过夜。洗膜3次,加二抗(1∶5000稀释)孵育1 h。洗膜3次,化学发光法显色,以β-actin为内参,检测p-Samd2/3蛋白水平,采用Quantity one软件分析条带灰度值,以靶条带灰度值与内参灰度值比值作为目的蛋白相对表达量。
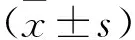
2 结 果
2.1 两组hBMSCs培养48 h细胞形态比较 见图1。生长状态良好第3代hBMSCs轮廓清晰,细胞大小均匀,呈长梭形,聚集化生长,细胞间隙增大,呈旋涡或平行排列。恒古骨伤愈合剂培养48 h后细胞形态逐渐变为圆形、多边形,细胞界限模糊,呈现聚集特点,类似成骨细胞形态,见数量不均微小颗粒物质,部分见发育成熟矿化物。对照组培养48 h后细胞形态呈梭形,突起变长,分散生长,细胞两极朝向不规律,可见少量微小颗粒物质。

图1 研究组(左)与对照组(右)hBMSCs
2.2 两组hBMSCs培养1周ALP染色结果比较 见图2。研究组hBMSCs含药血清培养1周后ALP染色程度高、显色范围广,对照组ALP着色弱、强度低,表明研究组hBMSCs分化潜能高。

图2 研究组(左)与对照组(右)hBMSCs
2.3 两组hBMSCs培养不同时间细胞增殖活性比较 见表2。研究组hBMSCs培养不同时间增殖活性均高于对照组(F组间=9.785,F时间=14.265,F交互=12.175,均P<0.05)。

表2 两组hBMSCs培养不同时间细胞增殖活性比较(%)
2.4 两组hBMSCs培养1周各目的基因mRNA相对表达量比较 见表3。研究组hBMSCs培养1周TGF-β1、Col Ⅰ、OCN、OPG mRNA相对表达量高于对照组,RANKL mRNA相对表达量低于对照组(均P<0.05)。
2.5 两组hBMSCs培养1周p-Smad2/3蛋白相对表达量比较 见图3。研究组hBMSCs培养1周后p-Smad2/3蛋白相对表达量为0.465±0.125,对照组为0.147±0.019,研究组高于对照组(t=5.623,P<0.001)。

表3 两组hBMSCs培养1周各目的基因mRNA相对表达量比较

注:左图为p-Smad2/3蛋白电泳图;右图中,与对照组比较,*P<0.05
3 讨 论
调查[10-11]显示,我国有超过90%人群无法从日常饮食中摄取足够的钙,骨质疏松已成为威胁公众健康的重要问题。骨质疏松属退行性老年疾病,表现为骨量减少、骨微结构破坏,其发病主要与破骨细胞活性上升、骨吸收增多、成骨分化减少有关,导致成骨细胞功能衰竭、骨形成减少,造成骨代谢负平衡,故理想的治疗骨质疏松药物需围绕促骨形成展开,辅以抑制骨吸收。目前多应用双磷酸盐类、雌激素类药物等拮抗骨质疏松,它们均为抑制骨吸收类药物,可控制骨吸收,但无明显促骨形成效应,长期应用可能增加颌骨坏死、乳腺癌等发病风险[12]。重组人甲状腺激素具有促骨形成作用,但可能诱发骨肉瘤发生[13]。中医药以补肾、壮骨及含黄酮类药物为主,分子生物研究[14]发现中医药可通过多信号通路调控骨吸收、骨形成平衡,进而防治骨质疏松。李建国等[15]研究发现,淫羊藿提取物及其总黄酮可促进BMSCs成骨分化,上调Col Ⅰ、TGF-β1等成骨细胞特异性分子表达。李三华等[16]应用杜仲醇提取物诱导BMSCs,发现其可上调成骨分化因子表达。以上均显示中医药在防治骨质疏松方面有较好的前景。
已有文献[17]报道,恒古骨伤愈合剂可促进成骨细胞成熟及增殖。动物实验[18]证实,恒古骨伤愈合剂可促进坏死股骨头内源性骨形成蛋白表达。本研究发现,研究组hBMSCs培养1周后分化潜能较对照组高,ALP染色增强,细胞增殖活性随培养时间延长而上升,推测恒古骨伤愈合剂可能存在促骨形成效应。ALP系成骨成熟的关键标志酶,其活性上升提示成骨分化及成熟[19],而恒古骨伤愈合剂培养后ALP染色增强,推测恒古骨伤愈合剂可诱导ALP表达,促进成骨细胞增殖。目前临床公认hBMSCs具多向分化潜能,如何诱导其定向分化为成骨细胞在骨质疏松及骨组织重建中有重要意义。我们发现恒古骨伤愈合剂可诱导其分化,进一步观察其机制发现,hBMSCs含恒古骨伤愈合剂血清培养基培养1周后,成骨特异性标志物TGF-β1、Col Ⅰ、OCN mRNA相对表达量高于对照组,破骨细胞抑制因子OPG mRNA相对表达量高于对照组,破骨分化特异性标志物RANKL mRNA相对表达量低于对照组,提示恒古骨伤愈合剂可能存在促进骨形成及抑制骨吸收双重效应。TGF-β系调控细胞生长、分化及细胞外基质合成的关键细胞因子,其中TGF-β1已被证实与骨折、骨质疏松及动脉粥样硬化发生紧密相关[19-20]。但早期TGF-β生物学功能多集中于组织修复、炎症及胚胎发育等方面[21-22]。近年来发现,TGF-β对细胞生长、分化起到不同程度的调节作用[23-24]。实验研究发现,TGF-β对间充质起源细胞有明显刺激效应。骨组织细胞分泌大量TGF-β1,与跨膜受体结合形成受体多元体启动细胞信号转导,刺激BMSCs增殖,促使其向成骨分化,实现骨形成及重建。早期TGF-β1已广泛应用于骨折修复及骨质疏松治疗效果评估中[25]。OCN系成骨细胞分泌的特异性蛋白,直接反映骨形成及骨转化水平,成骨分化早期以ALP表达为主,成骨细胞成熟后期骨桥蛋白出现,分化为骨细胞,在矿化阶段骨桥蛋白及OCN表达增加。本研究发现,恒古骨伤愈合剂可促进成骨特异性分子TGF-β1、OCN、Col Ⅰ mRNA表达,提示其有促骨形成作用,考虑恒古骨伤愈合剂可调控TGF-β1/Smads信号通路,激活成骨特异性因子表达,抑制破骨细胞特异性分子表达,进而发挥促骨形成作用。RANKL为破骨细胞形成的关键因子,可促进干细胞成破骨分化,通过调控RANKL表达可抑制骨吸收[26]。我们发现恒古骨伤愈合剂可抑制破骨相关抑制RANKL表达,推测其可能存在抑制骨吸收效应。
Smad家族为TGF-β关键受体,系TGF-β信号转导重要细胞内介质,Smad2、Smad3通过C端受体介导磷酸化反应后激活,与Smad4形成复合物,转移至细胞核,与其他转录因子协同调节特异性基因转录过程。TGF-β激活Smads后细胞生长停滞,间充质上皮细胞发生迁移。代光明等[27]研究发现,抑制TGF-β1/Smads通路可抑制成骨分化相关基因表达,阻碍成骨细胞增殖及矿化。在TGF-β1/Smads通路中,Smad2/3参与TGF-β1信号转导,通过调控下游靶基因发挥促骨形成作用。我们发现,细胞培养1周后,研究组Smad2/3蛋白表达高于对照组,提示恒古骨伤愈合剂可促进Smad2/3蛋白表达,考虑恒古骨伤愈合剂可通过刺激TGF-β1分泌激活Smad2/3表达,发挥促骨形成作用。
综上所述,恒古骨伤愈合剂很可能是通过上调TGF-β1/Smads通路成骨细胞特异性分子基因表达促进骨形成,同时存在抑制骨吸收效应,有望作为骨质疏松治疗的新靶点,但对其具体生物学效应尚待进一步临床试验证实。

