125I放射性粒子诱导肝癌细胞长链非编码RNA表达谱变化研究*
严 洁,肖云华
(1.重庆市红十字会医院/江北区人民医院放射科;重庆 400020;2.重庆市大足区妇幼保健院放射科,重庆 402360;3.陆军军医大学第一附属医院核医学科,重庆 400038)
世界卫生组织国际癌症研究机构(IARC)发布2020年全球最新癌症负担数据显示,中国的癌症发病率和死亡率均为全球第一,约有50%的胃癌、肝癌和食道癌病例来自中国,虽然肝癌在中国的总体发病率排名第五位,但大约55%的肝癌患者在确诊时已处于Ⅲ期或Ⅳ期,使得肝癌死亡率排名第二位[1]。美国的统计数据也显示,在肺癌等癌症发病率逐年下降的趋势下,肝癌发病率仍然持续上升[2]。这些统计数据都充分显示肝癌防治任务重要而紧迫。
放疗(RT)已广泛用于全身各种实体肿瘤治疗,但传统体外RT对正常肝组织损伤较大,限制了RT在肝癌治疗中的应用[3-4]。近年来,以125I放射性粒子植入为代表的近距离辐射治疗因为肿瘤内累积辐射剂量高、对周围正常组织损伤小而逐渐在临床推广应用[5]。虽然放射性粒子植入治疗肝癌取得了较好的临床治疗效果,但仍然需要进一步提高RT敏感度,减少辐射剂量及患者医疗费用负担。研究表明,长链非编码RNA(lncRNA)具有广泛的生物学功能,涉及染色体剂量补偿效应、基因组印迹、染色体沉默、染色质修饰与重塑、细胞分化、基因转录与翻译调控、细胞结构完整性的维持、细胞周期调节、细胞内物质转运、干细胞重新编程和热休克反应等重要生命活动过程,并且能够调控肝癌的RT敏感度[6-8]。125I放射性粒子是否引起肝癌细胞lncRNA表达变化,以及lncRNA在近距离辐射诱导肝癌细胞死亡过程中的作用,尚鲜有文献报道,本研究对此进行探索并报道如下。
1 材料与方法
1.1细胞株及主要试剂 人肝癌Hep3B细胞株来源于陆军军医大学基础医学院生化教研室。DMEM高糖培养基、0.25%胰酶、胎牛血清、PBS均购自 Hycolone公司。125I粒子活度29.6 MBq(0.8 mCi)为宁波君安药业科技有限公司产品(批号:JA-210219)。
1.2方法
1.2.1细胞培养 人肝癌Hep3B细胞株接种于10%胎牛血清的DMEM高糖培养基,在37 ℃、5%CO2饱和湿度的孵育箱中培养,细胞长满时用 0.25% 胰酶消化传代,取对数生长期细胞进行辐射。
1.2.2细胞辐射方式 将人肝癌Hep3B细胞分为实验组(125I组)和对照组(NC组)。125I 放射性粒子辐照模式参照参考文献[9],采用9颗初始活度为29.6 MBq(0.8 mCi)、初始剂量率为5.32 cGy/h的粒子,其中 1 颗粒子位于圆形环中央,8颗粒子以35 mm直径等距环形排布。125I组对数生长期细胞置于 35 mm 培养皿内粒子辐射装置上方 5 mm处,给予6 Gy 剂量辐射,所有辐射过程均在细胞培养箱中进行。NC组细胞放于同一细胞培养箱培养(辐照模型设置了铅防护,不会对NC组细胞造成辐射)。
1.2.3LncRNA提取及测序 按照上述方法对人肝癌Hep3B细胞株进行辐照处理作为125I组样本。通过经典的TRIzol法提取125I组及NC组的总RNA,将总RNA溶于无RNase的水中,保障样本浓度大于100 ng/μL,体积大于35 μL。lncRNA测序委托北京诺禾致源科技股份有限公司(中国北京)进行,采用去除核糖体RNA的方法构建链特异性文库[10]。首先,从总RNA中去除核糖体RNA,随后将RNA打断成250~300 bp的短片段,以片段化的RNA为模板,随机寡核苷酸为引物合成cDNA第一条链,随后用RNase H降解RNA链,并在DNA polymerase I体系下,以dNTPs(dUTP、dATP、dGTP和dCTP)为原料合成cDNA第二条链。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选350~400 bp的cDNA。使用USER酶降解含U的cDNA第二链,最后进行聚合酶链式反应(PCR)扩增并获得文库。对文库进行Qubit初步定量,稀释文库至1 ng/μL,再用Agilent 2100 bioanalyzer检测对文库的插入片段长度进行检测,分布在250~300 bp为符合预期。库检合格后,根据文库的有效浓度及数据产出需求进行Illumina PE150测序。
1.2.4LncRNA生物信息分析 LncRNA测序获得原始数据后进入信息分析流程,流程分为2个阶段:测序数据质量评估及lncRNA信息挖掘。原始数据质控合格后进行后续信息挖掘,包含lncRNA表达量分析、差异lncRNA分析、GO功能富集等分析。
1.2.5实时荧光定量聚合酶链式反应(qRT-PCR) 验证辐射应答性lncRNA125I组及NC组样本分别提取总RNA并用反转录试剂盒反转录成cDNA。以cDNA为模板进行RT-PCR,引物由Genecopoeia 公司设计合成,测定差异lncRNA的表达水平。qRT-PCR实验使用标准实验步骤(Tm=60 ℃)进行,50次循环,以管家基因GAPDH作为实验内参。结果用2-ΔΔCt相对定量法计算各组、各基因的相对表达量。然后用GraphPad Prism 8对125I组和NC组作图,并用其自带统计分析软件进行统计分析。
采用Hisat2将clean reads比对到参考基因组上[11],使用Stringtie软件在基于比对到基因组上的结果,将reads拼接成转录本[12]。 使用Cuffmerge软件对各样本拼接得到的转录本进行合并,去掉其中链方向不确定和转录本长度不超过200 nt的转录本,接下来利用Cuffcompare软件跟已知数据库进行比较,得到已知的lncRNA和Novel_lncRNA,并使用StringTie对lncRNA进行定量分析[13]。
2 结 果
2.1125I放射性粒子近距离辐射影响肝癌细胞lncRNA表达谱变化 测序结果显示,125I组lncRNA原始数据为13.78 G,NC组lncRNA原始数据为12.97 G,测序数据质量评估见表1,合格判断标准为Q20≥90%、Q30≥85%。

表1 lncRNA测序数据质量评估
差异lncRNA筛选标准为|log2FoldChange|>4且padj<0.01,本次实验中得到9 206个差异lncRNAs转录本,其中上调4 556个,下调4 650个,差异lncRNAs转录本情况如图1所示。
2.2LncRNA的qRT-PCR验证 为了进一步验证lncRNA测序的准确性,从9 206个差异lncRNAs转录本中挑出显著差异的6个lncRNAs转录本进行qRT-PCR验证。分组设置分别为125I放射性粒子辐射照射实验组、非辐射照射对照组,通过qRT-PCR得到6种lncRNAs转录本在不同处理细胞中的表达水平,实验发现这5种lncRNAs转录本的表达量变化趋势和测序结果一致(图2),其中XLOC_002662、CBSL的表达水平显著降低,XLOC_076363、TMEM189-UBE2V1、AC025165.3的表达水平显著升高,两组比较差异均有统计学意义(P<0.05);AP002990.1基因表达趋势虽然与预测结果一致,但两组表达水平比较差异无统计学意义(P>0.05)。
2.3LncRNA的功能预测 LncRNA生物学功能丰富,广泛参与生物体各类重要生理过程,可在转录水平和转录后水平上对靶基因的表达进行调控,并找出不同处理产生的差异功能通路。通过lncRNA与蛋白编码基因的位置关系(co-location)预测lncRNA的靶基因,然后对差异lncRNA的靶基因进行功能富集分析,以此来预测lncRNA的主要功能。
对本次检测出的9 206个差异lncRNAs转录本进行靶基因GO功能富集分析(图3),发现差异lncRNAs转录本的靶基因主要功能集中在自噬体形成、DNA损伤等方面,即相关差异lncRNAs在受到辐射影响后参与细胞增殖的调控。
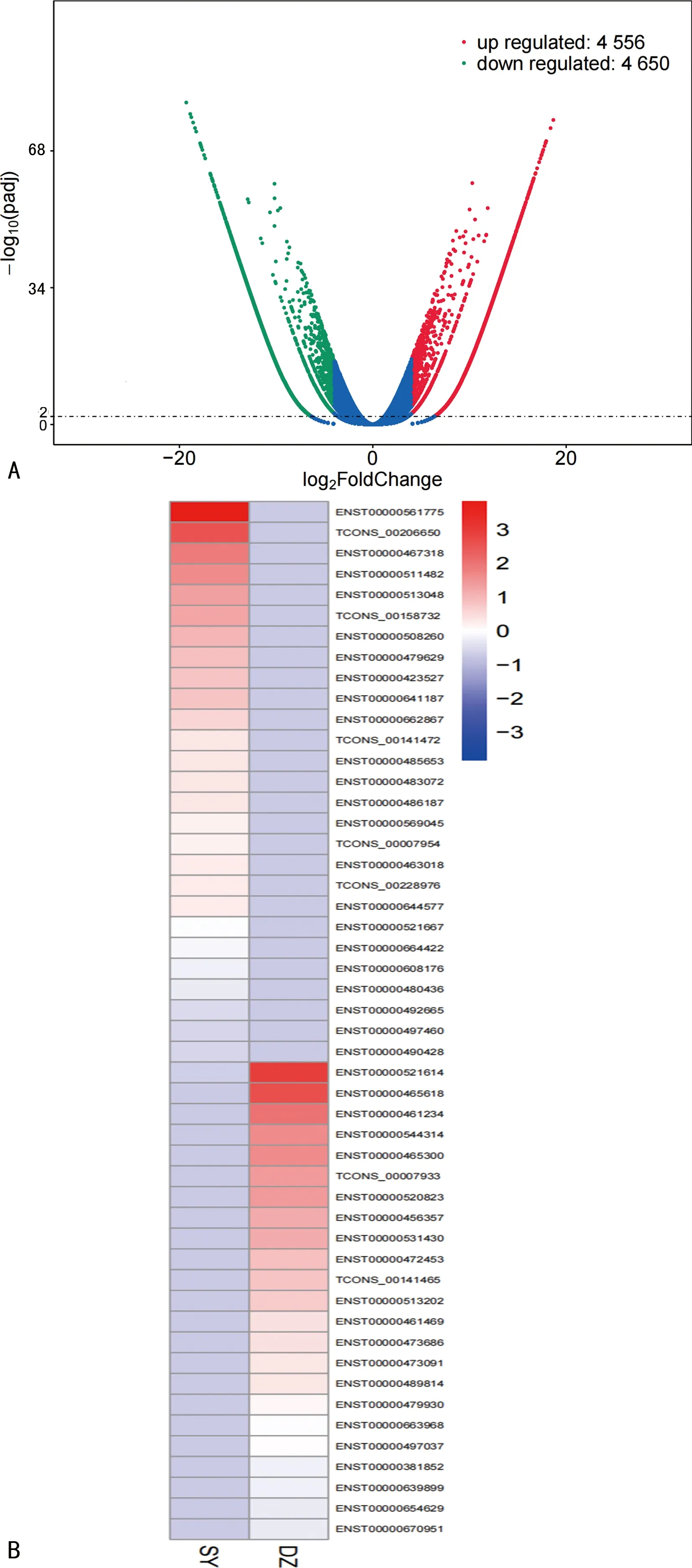
A.样本火山图;B.差异lncRNAs转录本热图。
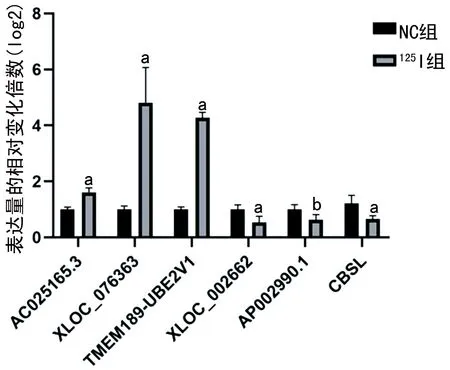
与NC组比较,a P<0.05,b P>0.05。
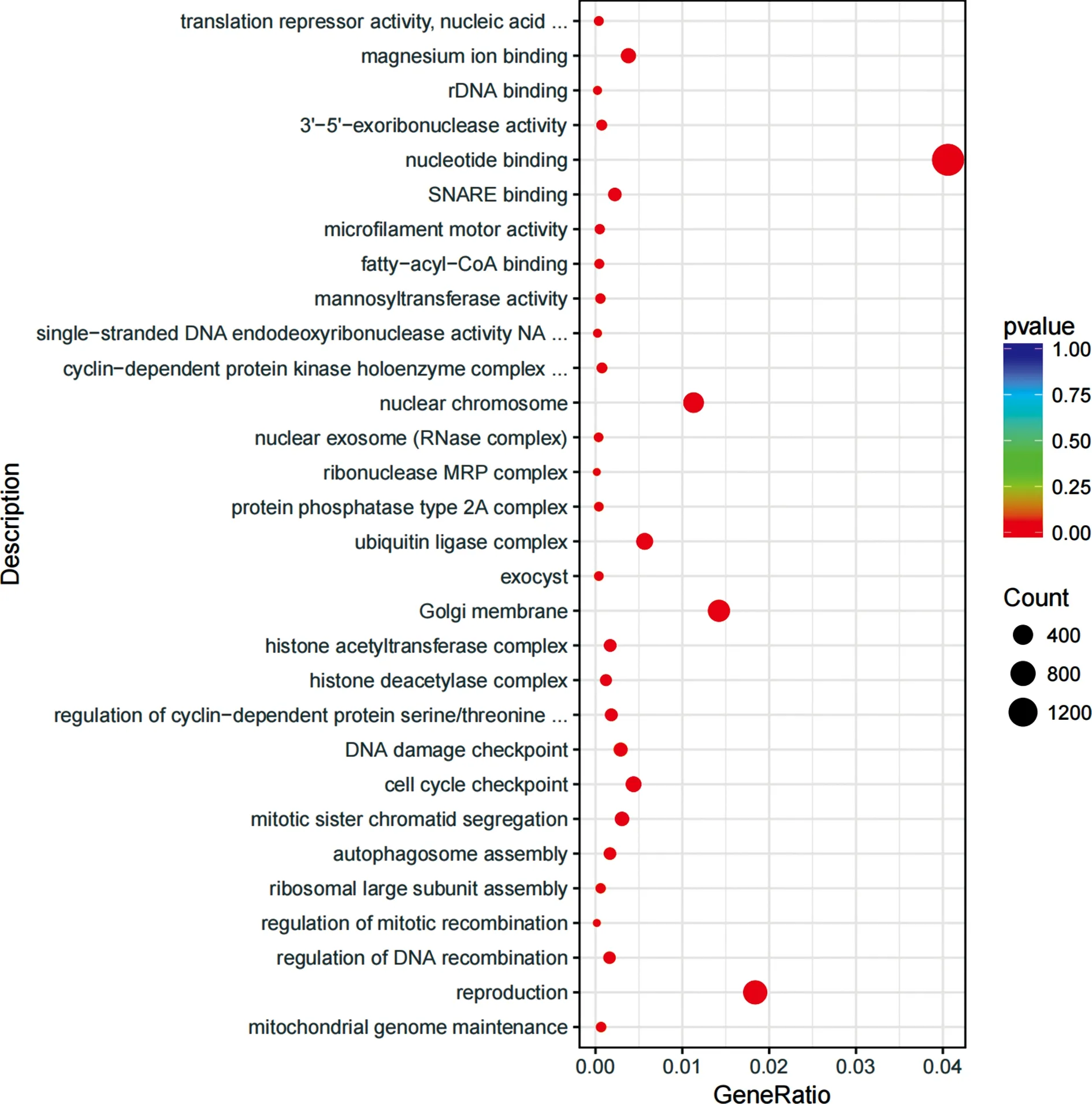
图3 6 Gy125I放射性粒子辐照与未经辐照的Hep3B细胞差异lncRNAs GO功能富集图
3 讨 论
近年来,以125I放射性粒子植入为代表的近距离辐射治疗因肿瘤内累积辐射剂量高、对周围正常组织损伤小而逐渐在临床推广应用[14-15],取得了较好的临床治疗效果。然而研究者对125I放射性粒子诱导肝癌细胞死亡、RT抵抗、增强RT敏感性的分子机制报道较少,特别是关于125I辐射导致的肝癌细胞lncRNA表达谱变化目前不十分清楚。为了探索相关问题,作者通过设置6 Gy125I放射性粒子辐照125I组与未经辐照的NC组进行lncRNA测序分析,研究其表达谱的变化情况,以期待探索新的机制、生物标志物和干预靶点,提高125I放射性粒子在肝癌RT中的临床应用价值。
通过本次lncRNA测序分析发现,9 206个差异表达lncRNAs,其中上调4 556个,下调4 650个;对差异lncRNA转录本进行靶基因GO功能富集分析发现其主要功能集中在自噬体形成、DNA损伤等方面,即相关差异lncRNA在受到辐射影响后参与细胞增殖的调控,这与已报道的电离辐射损伤染色体、影响细胞有丝分裂研究结果相吻合[16]。从目前检索的文献情况来看,这是首次报道肝癌细胞经过125I放射性粒子照射后lncRNA表达谱的变化,本次研究为近距离辐射诱导肝癌细胞死亡分子机制、寻找新的RT标志物及干预靶点提供了新的研究思路。本研究选取表达差异较大的6个基因(|log2FoldChange|>8且padj<0.01)进行了qRT-PCR验证,6个lncRNAs分别分布于chr12、chr5、chr20、chr1、chr11、chr21,分子长度在275~1 225 nt,平均长度632 nt。qRT-PCR验证结果显示其表达趋势与lncRNA测序结果相吻合。查阅NCBI基因数据库发现:XLOC_002662表达与细胞死亡抑制调节功能相关;CBSL与水解酶催化转硫途径的第一步有关,还参与硫化氢的产生,而硫化氢是一种对细胞具有保护作用的气体传递物质;TMEM189-UBE2V1是相邻TMEM189和UBE2V1基因的一种罕见但自然发生的通读转录物,其通过mRNA读取的意义及其蛋白产物的功能尚未确定;AC025165.3参与蛋白编码调节;XLOC_076363在该数据库中还没有功能注解。这些功能注解提示lncRNA广泛参与125I放射性粒子诱导细胞死亡的过程,其详细机制纷繁复杂,需要在今后的研究实践中进一步探索。
本次实验验证的基因数目较少,并且没有继续对这些基因进行更加深入的功能和机制研究,是本实验的局限性。此外,选择实验的细胞株单一也是本次实验的局限性之一。在后续实验中,作者将进一步探讨lncRNA在125I放射性粒子诱导肝癌细胞死亡过程中的分子机制。
总之,通过对125I放射性粒子辐照后的肝癌Hep3B细胞进行lncRNA测序,发现大量lncRNA参与了染色体损伤、细胞分裂增殖过程,这为进一步探索电离辐射诱导肿瘤细胞死亡分子机制、寻找RT生物标志物和干预靶点提供了新思路。

