粪肠球菌内源性质粒的序列分析及其穿梭载体的构建
袁 林,曾 静,郭建军,魏国汶
(江西省科学院微生物研究所, 江西南昌 330096)
乳酸菌是一群革兰氏阳性、能够发酵碳水化合物、以乳酸为主要代谢产物的各类细菌统称,是人与大多数动物肠道内的常见优势菌群[1−5]。乳酸菌被广泛地应用于食品工业以及饲料工业等,是全世界公认的安全级(Generally Recognized as Safe, GRAS)食品微生物,并逐渐成为微生物学研究的模式生物[6]。现阶段研究与开发乳酸菌食品级载体-受体系统,探索重要基因在乳酸菌中的克隆表达,已成为乳酸菌分子生物学研究的热点[7−11]。
质粒是细菌细胞中染色体之外,能够自主复制的共价闭合环状双螺旋的DNA分子或遗传因子。已有研究表明,乳酸菌可携带数个质粒,大小不一,其中多数质粒为隐蔽性质粒,少数质粒则具有某些特殊功能[12]。乳酸菌的一些特性与其所携带的质粒相关,并且这些特性可以通过质粒稳定转移至其他乳酸菌或其他细菌中[13]。目前已有许多研究对乳酸菌内源性质粒进行序列测定和功能分析,并利用乳酸菌内源性质粒上重要元件构建乳酸菌载体,其中获得乳酸菌内源性质粒的复制子是构建乳酸菌载体的关键[14−16]。例如,Fang 等[17]对来源于植物乳杆菌Lactobacillus plantarumLP3的质粒pLP3进行分离及测序分析,并基于质粒pLP3的复制子成功构建乳酸菌表达载体;Zuo等[18]对来源于粪肠球菌Enterococcus faecalisML21的高拷贝数质粒pML21进行分离及测序分析,然后采用分子生物学技术将质粒pML21的复制子与大肠杆菌-双歧杆菌穿梭载体pAM1上包含红霉素抗性基因Em和大肠杆菌复制子的DNA片段相融合,获得了大肠杆菌-粪肠球菌穿梭载体。
本研究从本实验室前期分离纯化的具有优良益生特性的粪肠球菌Enterococcus faecalisEXW27中分离得到了内源性质粒pXW,拟对其进行DNA序列的测定及分析,确定质粒pXW的最小复制子,然后利用质粒pXW的复制子构建大肠杆菌-乳酸菌穿梭载体,并研究大肠杆菌-乳酸菌穿梭载体的宿主范围、转化效率和稳定性。本研究所涉及的粪肠球菌E.faecalisEXW27的内源性质粒pXW可以为乳酸菌基因操作提供新工具,并可以为构建具有自主知识产权的乳酸菌表达载体提供基础元件。
1 材料与方法
1.1 材料与仪器
大肠杆菌Escherichia coliDH5α、粪肠球菌E.faecalisEXW27、乳脂乳球菌LactococcuscremorisMG1363、乳酸乳球菌乳酸亚种Lactococcus lactissubsp.lactisLM0230、嗜酸乳杆菌Lactobacillus acidophilusXW118、植物乳杆菌Lactiplantibacillus plantarumXW113、鼠李糖乳杆菌Lacticaseibacillus rhamnosusDB、副干酪乳杆菌Lacticaseibacillus paracaseiLG1、乳酸片球菌Pediococcus acidilacticiXW28 均由本实验室保存;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性内切酶、T4 DNA连接酶、DNA Marker、蛋白质Marker、质粒DNA小量纯化试剂盒、DNA胶回收试剂盒 日本Takara公司;MRS肉汤培养基、M17肉汤培养基 杭州百思生物技术有限公司;实验所用试剂 均为分析纯。
PCR 仪 (Mastercycler gradient) 美国 Eppendorf公司;QuantStudio 实时荧光定量 PCR 仪 美国Thermo Fisher Scientific 公司;TY04S-3C 凝胶成像系统 北京君意东方电泳设备有限公司;SP-752PC 紫外可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 引物设计与合成 大肠杆菌-乳酸菌穿梭质粒构建过程中以及粪肠球菌内源性质粒拷贝数测定过程中涉及的引物及其序列见表1,引物由生工生物工程(上海)股份有限公司合成。

表1 引物信息Table 1 Primer sequences
1.2.2 质粒的提取与序列测定 挑取MRS平板上单菌落,接种于100 mL新鲜的 MRS 液体培养基中,37 ℃静置过夜培养。转接至100 mL新鲜的MRS 液体培养基中,37 ℃静置培养24 h。8000 g离心10 min收集菌体,首先用10 mmol/L Tris-HCl、5 mmol/L EDTA,pH8.0 缓冲液洗涤菌体沉淀,然后用含有30 mg/mL溶菌酶溶液(10 mmol/L Tris-HCl、5 mmol/L EDTA,pH8.0)重新悬浮菌体,并于 37 ℃处理1 h,最后采用 Takara 质粒 DNA 小量纯化试剂盒提取质粒。利用琼脂糖凝胶电泳确认所提取质粒的大小,并将分离纯化的质粒送至生工生物工程(上海)股份有限公司进行序列测定。
1.2.3 质粒的序列分析及注释 将测序完成的DNA 序列用 SnapGene Viewer(version 2.3.2)软件进行人工拼接,绘制质粒图谱,标注重要酶切位点并分析质粒DNA序列中的G+C含量。采用NCBI网站的 ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/)查找质粒的开放阅读框(open reading frame,ORF),结合质粒启动子预测网站Promoter Pridition(http://www.fruitfly.org/seq_tools/promoter.html)确定各开放阅读框的启动子序列。采用NCBI网站的 BLAST(https://blast.ncbi.nlm.nih.ov/Blast.cgi)对各开放阅读框所编码的蛋白质序列进行比对分析,预测蛋白质的功能。
1.2.4 质粒拷贝数的测定
1.2.4.1 粪肠球菌生长曲线的测定 挑取MRS平板上单菌落,接种于100 mL新鲜的MRS液体培养基中,37 ℃静置过夜培养。转接至100 mL新鲜的MRS液体培养基中,37 ℃静置培养24 h。每间隔2 h取1 mL培养液,测定培养液于600 nm的吸光值,测定粪肠球菌的生长曲线。
1.2.4.2 粪肠球菌总DNA的提取 挑取MRS平板上单菌落,接种于100 mL新鲜的MRS液体培养基中,37 ℃静置过夜培养。转接至100 mL新鲜的MRS液体培养基中,37 ℃静置培养24 h。8000 g离心10 min收集菌体,首先用10 mmol/L Tris-HCl、5 mmol/L EDTA,pH8.0缓冲液洗涤菌体沉淀,参照《分子克隆实验指南》[19]中细菌总DNA提取方法提取菌体的总DNA。
1.2.4.3 质粒拷贝数的测定 采用相对定量 PCR法[20]测定内源性质粒在粪肠球菌EXW27中的拷贝数。选取粪肠球菌基因组上单拷贝基因gyrB作为内参基因,内源性质粒上单拷贝基因repB作为目的基因。针对基因gyrB和repB分别设计荧光定量PCR引物:gyrB-F、gyrB-R、repB-F、repB-R。引物对的设计要求是引物对的扩增效率均高于95%,并且两者的数值相差低于1%。采用所设计引物对以细菌总DNA为模板进行荧光定量PCR,并采用琼脂糖凝胶电泳检测荧光定量PCR反应的产物。对粪肠球菌总DNA进行系列梯度稀释,取已稀释的DNA样品作为模板,测得各样品的CT值,将CT值与log10C0(C0为稀释度)做标准曲线。将所得到的引物扩增标准曲线的斜率代入引物扩增效率E的计算公式(公式1)中,分别计算得到各引物对的扩增效率。取不同生长阶段的粪肠球菌菌体,并按照如上方法提取总DNA,将总DNA等比稀释至0.1~1 ng/μL,作为荧光定量PCR的模板。采用所设计引物进行荧光定量PCR,读取荧光定量PCR反应的CT值,并代入公式2计算质粒的拷贝数。

式中,k为扩增扩增标准曲线的斜率。

式中,E为引物的扩增效率,△CT为用目的基因相关的引物和内参基因相关的引物进行荧光定量PCR扩增得到的CT值的差值。
1.2.5 质粒最小复制子的鉴定
1.2.5.1 大肠杆菌-粪肠球菌穿梭载体的构建 通过分析质粒的开放阅读框,初步确定质粒上的复制子信息。设计不同引物对(如表1所示),采用PCR技术扩增不同长度的含复制子的DNA片段。扩增F1片段所用引物对为F1-F、F1-R;扩增F2片段所用引物对为F2-F、F1-R;扩增F3片段所用引物对为F3-F、F1-R;扩增F4片段所用引物对为F2-F、F4-R;扩增F5片段所用引物对为F2-F、F5-R;扩增F6片段所用引物对为F2-F、F6-R。以大肠杆菌-粪肠球菌穿梭载体pXWM1的构建为例,采用引物对F2-F、F5-R扩增F1片段,采用引物对pAM1-F、pAM1-R扩增大肠杆菌-双歧杆菌穿梭载体pAM1上包含红霉素抗性基因和大肠杆菌复制子的DNA片段。将得到的两种DNA片段均用BamHI和XhoI双酶切处理,酶切产物回收后酶连转化大肠杆菌DH5α感受态细胞,挑取转化子酶切验证,获得重组质粒pXWM1。
1.2.5.2 粪肠球菌感受态制备及电击转化 粪肠球菌感受态制备及电击转化参照文献[21−23]进行。挑取 MRS 平板上单菌落,接种于100 mL新鲜的 GM17液体培养基 [0.5%(g/100 mL)葡萄糖、M17液体培养基]中,30 ℃静置培养过夜。将过夜培养物以1%的接种量接种于100 mL新鲜的 SGM17 液体培养基 [0.5 mol/L蔗糖、0.5%(g/100 mL)葡萄糖、1%(g/100 mL)甘氨酸、M17 液体培养基 ]中,30 ℃静置培养5~6 h。离心收集菌体沉淀,用冰浴的电击缓冲液(0.5 mol/L蔗糖、10%甘油)洗涤两次后,重悬于100 μL电击缓冲液中,放置在冰上待用。向100 μL 感受态细胞中加入100 ng 重组质粒,轻轻混匀,置于冰上备用。将含有重组质粒的粪肠球菌感受态细胞混合液小心加入冰预冷的电转杯中,然后进行电击转化。电击转化参数为1.8 kV、200 Ω、25 μF,脉冲时间为4.0 ms。电击完成后,立即向电转杯中加入900 μL新鲜的 SGM17 液体培养基,30 ℃静置复苏2 h。取复苏后的菌液涂布于含2.5 μg/mL 红霉素的 MRS 固体平板,30 ℃培养24~48 h。
1.2.6 穿梭载体的宿主范围、转化效率和稳定性测定
1.2.6.1 穿梭载体的宿主范围测定 参照1.2.5.2中方法制备多种乳酸菌感受态细胞,将验证过的能够有效复制的穿梭载体转化乳酸菌感受态细胞,转化子涂布于含2.5 μg/mL红霉素的MRS固体平板,30 ℃培养48~96 h。观察转化平板上是否有穿梭质粒的转化子菌落,确定穿梭质粒的宿主范围。
1.2.6.2 穿梭载体的转化效率测定 分别取 20、50、100 和 500 ng 重组质粒与乳酸菌感受态细胞混匀,电击转化乳酸菌感受态细胞,每个浓度做3个平行。转化子于 30 ℃ 静置活化 3 h 后,将菌悬液稀释至合适的浓度,涂布于含 2.5 μg/mL 红霉素的 MRS固体平板,30 ℃ 培养 48 h 至菌落长出。对平板菌落进行计数,并计算转化效率,最终以这四个梯度中效率最高者作为穿梭载体的转化效率。
1.2.6.3 穿梭载体的稳定性测定 挑取转化平板上单菌落接种至含25 μg/mL的MRS液体培养基中,37 ℃过夜培养。再以1%接种量接种至不含红霉素的MRS液体培养基中,37 ℃培养12 h。再次按1%接种量接种至不含红霉素的MRS液体培养基中,37 ℃培养12 h,依次传代培养直至60代。稀释培养好的菌液分别涂布于含红霉素的MRS固体平板和不含红霉素的MRS固体平板。将两种固体平板上的菌落数代入公式3计算质粒丢失率,并以此数据来表征质粒的稳定性。

1.3 数据图像的处理
以Primer premier 5.0的引物设计软件进行相关引物的设计,以Tanon 1600全自动数码凝胶成像系统对DNA琼脂糖电泳凝胶进行采集及分析。
2 结果与分析
2.1 质粒的分离与序列测定
从粪肠球菌EXW27中分离得到质粒,并对其进行琼脂糖凝胶电泳检测,结果如图1所示。琼脂糖凝胶电泳结果表明从粪肠球菌EXW27提取得到的质粒为单一条带,大小约为8000 bp。将此质粒命名为质粒pXW,并将分离纯化的质粒样品送至生工生物工程(上海)股份有限公司进行序列测定。

图1 质粒pXW的琼脂糖凝胶电泳检测图Fig.1 Agarose gel electrophoresis analysis of plasmid pXW
2.2 质粒的注释
将测序完成的DNA序列用SnapGene Viewer软件进行人工拼接,绘制质粒图谱,如图2A所示。质粒pXW是双链环状DNA分子,共8617 bp,GC含量为33.29%。经BLAST分析显示:质粒pXW的核苷酸序列与来源于屎肠球菌E.faeciumFS86的质粒(GeneBank登录号:MT501398.1)的核苷酸序列具有最高的相似性,两者的相似率为88.37%。并且两种质粒的核苷酸序列比对结果显示:除了E.faeciumFS86来源质粒的质粒图谱(图2B)上红色标记出的四个额外片段(片段 1、2、3、4)外,两种质粒的核苷酸序列完全一致。其中片段1在E.faeciumFS86来源质粒上的位置为2579~2794,片段2在E.faeciumFS86来源质粒上的位置为4477~4647,片段3在E.faeciumFS86来源质粒上的位置为 6996~7323,片段 4在E.faeciumFS86来源质粒上的位置为9080~9498。以上结果表明,粪肠球菌和屎肠球菌之间可能通过水平基因转移来获得质粒片段或质粒。目前,有关E.faeciumFS86来源质粒的序列分析未见相关研究报道。本研究对自主分离得到的质粒pXW进行序列分析。

图2 质粒图谱Fig.2 Physical map
对质粒pXW进行开放阅读框(ORF)搜索,结果显示质粒pXW含有8个开放阅读框。在NCBI数据库中对这些开放阅读框进行序列信息的比对,预测所有ORF的功能,各ORF编码的蛋白质信息如表2所示。ORF1编码一个含159个氨基酸残基的蛋白质,为迁移蛋白质 MobC(Mobilization protein),该MobC蛋白的氨基酸序列与来源于屎肠球菌E.faecium24-10的MobC蛋白的氨基酸序列的相似性高达99%。ORF2编码一个含304个氨基酸残基的蛋白质,为迁移蛋白质MobA(Mobilization protein),该MobA蛋白的氨基酸序列与来源于屎肠球菌E.faeciumAcr4的MobA蛋白的氨基酸序列的相似性高达96%。MobC蛋白和MobA蛋白可能与质粒的迁移作用相关[24]。ORF4编码一个含245个氨基酸残基的蛋白质,为复制起始蛋白RepB(Replication initiation protein),该RepB蛋白的氨基酸序列与来源于E.faeciumC68的RepB蛋白的氨基酸序列的相似性高达99%。RepB蛋白的BLAST分析结果显示,RepB蛋白属于Rep_3超家族(pfam01051),预测与质粒的θ型复制相关[24−26]。ORF5编码一个含178个氨基酸残基的蛋白质,为DUF536结构域包含蛋白质(DUF536 domain-containing protein),该DUF536结构域包含蛋白质的氨基酸序列与来源于E.faecium的DUF536结构域包含蛋白质的氨基酸序列的相似性高达99%。DUF536结构域包含蛋白质属于DUF536超家族,为未知功能蛋白质,预测其与质粒的 θ型复制相关[24−26]。ORF7编码一个含403个氨基酸残基的蛋白质,为转座酶(transposase),该转座酶的氨基酸序列与来源于E.faecium64/3 xUW2774的转座酶的氨基酸序列的相似性高达100%。ORF8编码一个含567个氨基酸残基的蛋白质,为ABC转运器ATP-结合蛋白(ABC transporter ATP-binding protein),该 ABC转运器 ATP-结合蛋白的氨基酸序列与来源于E.faecium的ABC转运器ATP-结合蛋白的氨基酸序列的相似性高达99%。ORF3和ORF6在NCBI数据库中没有搜索到与其相关的蛋白质。质粒pXW上除具有与质粒复制相关的蛋白质(复制起始蛋白RepB和DUF536结构域包含蛋白质)外,还包含有与质粒迁移作用相关的蛋白质(迁移蛋白质MobC和MobA),以及转座酶和ABC转运器ATP-结合蛋白,因此质粒pXW被归为显性质粒。质粒pXW在粪肠球菌EXW27中所起的作用有待进一步研究确证。

表2 质粒pXW的开放阅读框信息Table 2 Open reading frame information for plasmid pXW
2.3 质粒拷贝数的测定
本研究采用相对定量PCR法测定内源性质粒pXW在粪肠球菌EXW27中的拷贝数。选取粪肠球菌基因组上单拷贝基因gyrB作为内参基因,内源性质粒上单拷贝基因repB作为目的基因。针对基因gyrB和repB分别设计荧光定量PCR引物:gyrBF、gyrB-R、repB-F、repB-R。采用所设计引物以粪肠球菌EXW27总DNA为模板进行荧光定量PCR,并用琼脂糖凝胶电泳检测荧光定量PCR的产物,结果如图3所示。gyrB和repB的PCR产物大小分别为145 bp和150 bp。对粪肠球菌EXW27的总DNA进行系列梯度稀释,取已稀释的DNA样品作为模板,分别采用引物对gyrB-F/gyrB-R或repB-F/repBR进行荧光定量PCR反应,测得各样品的CT值,将CT值与log10C0(C0为样品的稀释度)做标准曲线,如图4所示。引物对gyrB-F/gyrB-R的扩增标准曲线为 y=−3.4327x+2.3219,R2=0.9995;引物对repB-F/repB-R的扩增标准曲线为y=−3.4358x+5.4843,R2=0.9999。将所得的扩增标准曲线斜率代入引物扩增效率E的计算公式(公式1),计算得到引物对gyrB-F/gyrB-R和repB-F/repB-R的扩增效率分别为95.57%和95.48%。引物对的扩增效率均高于95%,而且两者的数值相差仅为0.09%,低于1%。因此引物对gyrB-F/gyrB-R和repB-F/repB-R是可以作为相对定量PCR引物使用的。

图3 PCR产物的琼脂糖凝胶电泳检测Fig.3 Agarose gel electrophoresis analysis of PCR products

图4 引物扩增效率的标准曲线Fig.4 Standard curve of amplification efficiency of primers
取不同生长阶段的粪肠球菌EXW27菌体,并提取其总DNA,将总DNA等比稀释至0.1~1 ng/μL,作为荧光定量PCR的模板。采用所设计引物进行荧光定量PCR,读取荧光定量PCR反应的CT值,并代入公式2计算在粪肠球菌EXW27于不同生长时期的质粒pXW拷贝数。质粒pXW的拷贝数随粪肠球菌EXW27生长的变化趋势(图5)为:粪肠球菌EXW27的对数生长早中期时质粒pXW的拷贝数最高,且基本保持稳定,最高拷贝数为32.09±0.93;其对数生长后期至稳定期时质粒pXW的拷贝数逐渐降低,到生长稳定期时,质粒拷贝数稳定为12.75±0.79。因此粪肠球菌EXW27的内源性质粒pXW属于高拷贝质粒[27]。在细菌对数生长后期,质粒拷贝数发生下降属于普遍现象,其中的原因可能是细菌生长后期时细胞生理代谢发生变化,细胞的生长趋于停滞,胞内DAN合成减慢,内源性质粒复制所依赖的DNA聚合酶合成量也随之下降。虽然质粒自身编码的复制相关蛋白可以识别复制起始位点,但是缺乏必要的酶系,导致复制复合体无法形成,质粒复制受到阻碍,质粒的拷贝数下降。

图5 质粒pXW的拷贝数与粪肠球菌EXW27生长曲线之间的关系Fig.5 Relationship between the copy number of plasmid pXW and the growth curve of E.faecium EXW27
2.4 质粒的复制方式推定以及最小复制子的鉴定
通过对质粒pXW上的开放阅读框进行BLAST比对分析,确定了质粒上与其复制相关的复制蛋白,一个是复制起始蛋白RepB,一个是复制起始蛋白RepB下游的DUF536结构域包含蛋白质。本研究进一步对复制起始蛋白RepB的上游DNA序列进行详细分析(如图6所示),发现复制起始蛋白RepB的上游存在类似起始质粒复制的反向重复序列和正向重复序列,推测复制起始蛋白RepB所在区域可能为复制子区域。根据以上分析,推测质粒pXW含有1个复制子,包括复制起始子、复制起始蛋白RepB以及下游的DUF536结构域包含蛋白质。复制起始子含有1对13 bp的反向重复序列IR(Invert repeats,IR)、2个 8 bp的正向重复序列DR1(Direct repeats,DR)、3.5个 12 bp的正向重复序列DR2以及4.5个22 bp的正向重复序列DR3。复制起始蛋白RepB属于Rep_3超家族(pfam01051)。Rep_3超家族中RepB蛋白均与质粒的θ型复制相关,例如粪肠球菌E.faecium226的质粒pMBB1为θ型复制质粒,其RepB蛋白属于Rep_3超家族[26]。紧接其下游的DUF536结构域包含蛋白质为未知功能蛋白质, BLAST分析结果显示其可能与质粒的θ型复制相关。此外,质粒pXW的复制子结构属于典型的θ型质粒的复制子结构[28−29]。因此推定质粒pXW的复制类型为θ型复制。

图6 质粒pXW的复制区域分析Fig.6 Genetic context of the replication region of plasmid pXW
为了确定质粒pXW的最小复制子,本研究构建了含有不同长度复制子片段的大肠杆菌-粪肠球菌穿梭载体,并将不同的大肠杆菌-粪肠杆菌穿梭载体分别转化粪肠球菌感受态,验证质粒pXW的最小复制子。如图7所示,复制子片段F1包含一部分ORF3、完整的反向重复序列IR、完整的正向重复序列DR、ORF4、ORF5以及ORF5的下游区域;复制子片段F2包含完整的反向重复序列IR、完整的正向重复序列DR、ORF4、ORF5以及ORF5的下游区域;复制子片段F3包含完整的正向重复序列DR、ORF4、ORF5以及ORF5的下游区域;复制子片段F4包含完整的反向重复序列IR、完整的正向重复序列DR、ORF4、ORF5以及部分ORF5的下游区域;复制子片段F5包含完整的反向重复序列IR、完整的正向重复序列DR、ORF4以及ORF5;复制子片段F5包含完整的反向重复序列IR、完整的正向重复序列DR、ORF4以及部分ORF5。穿梭载体的转化结果显示,含有复制子片段F1、F2、F4或F5的大肠杆菌-粪肠球菌穿梭载体电击转化粪肠球菌感受态后有菌落长出,含有复制子片段F3或F6的大肠杆菌-粪肠球菌穿梭载体电击转化粪肠球菌感受态后无菌落长出。因此,对于质粒pXW的复制子,完整的反向重复序列IR、完整的正向重复序列DR、ORF4以及ORF5是必需的。质粒pXW的最小复制子包括完整的反向重复序列IR、完整的正向重复序列DR、复制起始蛋白RepB以及θ型复制相关蛋白DUF536结构域包含蛋白。

图7 质粒pXW最小复制子的鉴定Fig.7 Minimal replicon identification of plasmid pXW
2.5 质粒的宿主范围、转化效率及稳定性测定
将确定最小复制子过程中构建的含有复制片段F5的穿梭载体命名为pXWM1,其质粒图谱如图8所示。为确定穿梭质粒pXWM1的宿主范围,将穿梭质粒pXWM1电击转化至各种乳酸菌感受态细胞中,利用红霉素标记进行筛选,以确定穿梭质粒pXWM1的宿主范围,并计算其在各种乳酸菌中的转化效率和穿梭质粒的稳定性。结果显示,穿梭质粒pXWM1均可在表3所示的乳酸菌中成功电转,并获得对应的转化子。这表明,质粒pXW属于宽宿主范围质粒。前面研究结果显示质粒pXW被推断为θ型复制质粒,质粒较稳定,并且质粒pXW含有质粒迁移蛋白MobC和MobA,这些因素与该质粒属于宽宿主质粒是相符合的。
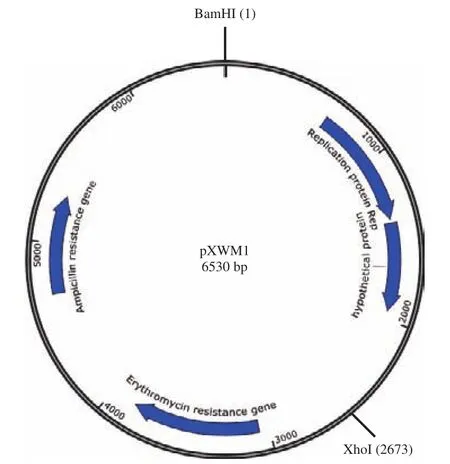
图8 pXWM1的质粒图谱Fig.8 Physical map of pXWM1
穿梭质粒pXWM1在表3所示的乳酸菌中的电击转化效率介于 1.96×102~8.96×104CFU/μg (质粒DNA)之间,比普通乳酸菌质粒转化效率(10~105CFU/μg质粒DNA)略低。穿梭质粒比普通乳酸菌质粒转化效率略低的可能原因是[30]:乳酸菌宿主菌中存在限制性修饰系统,排斥未甲基化的外源质粒;乳酸菌宿主菌内可能存在不亲和群的质粒;不同乳酸菌宿主菌的DNA甲基化水平;以及其他限制转化效率的因素如电击电压、电击缓冲液、感受态细胞的状态等。穿梭载体pXWM1在表3所示的乳酸菌中经过60代连续传代培养后,穿梭质粒的丢失率介于28.54%~54.17%之间。穿梭载体pXWM1在不同乳酸菌感受态细胞中电转化效率和质粒稳定性的差异,可能与质粒和宿主菌的相容性相关[14]。

表3 穿梭载体pXWM1在不同乳酸菌宿主中的转化效率和稳定性Table 3 Transformation efficiency and stability of shuttle vector plasmid pXWM1 in different hosts
3 结论
从具有优良益生特性的粪肠球菌E.faecalisEXW27中分离得到了内源性质粒pXW,该质粒大小为8617 bp,GC含量为33.29%。针对该质粒DNA序列的BLAST分析结果显示质粒pXW为新质粒。进一步通过生物信息学分析发现,该质粒编码8个ORF,其中包括质粒迁移作用蛋白MobC(ORF1)和 MobA(ORF2)、质粒复制起始蛋白 RepB(ORF4)、θ型复制相关蛋白DUF536结构域包含蛋白(ORF5)、转座酶(ORF7)、ABC 转运器 ATP-结合蛋白(ORF8)以及假定蛋白质(ORF3、ORF6)。根据复制起始蛋白RepB、紧接其下游的DUF536结构域包含蛋白以及复制子的序列分析,推测该质粒的复制方式为θ型复制。质粒pXW在粪肠球菌EXW27中拷贝数最高可达32.09±0.93,表明质粒pXW属于高拷贝数质粒。本研究确定了质粒pXW的最小复制子,并利用该复制子成功构建大肠杆菌-粪肠球菌穿梭载体pXWM1。该穿梭载体的宿主范围宽,实现了在多种乳酸菌中的成功转化,并且转化效率高,质粒丢失率低。质粒pXW的这些优良特性有利于将其改造为具有自主知识产权的乳酸菌工程载体。

