玉米胚乳醇溶蛋白合成的分子机制研究进展
任雪梅,南力彰,李旭凯
(1.山西农业大学生命科学学院,山西太谷030801;2.山西农业大学农学院,山西太谷030801)
玉米是粮食、饲料和能源兼用的作物,不仅能够作为许多发展中国家人口的主食,又可作为畜牧业肉、蛋、奶生产的主要原料。在我国,玉米主要以饲料加工为主,也有部分成为了餐桌上的美味佳肴。
目前种植和推广的玉米品种以高产的普通玉米为主,其玉米籽粒中赖氨酸、色氨酸含量较低,品质较差。普通玉米籽粒赖氨酸含量仅在0.23%左右,达不到畜禽饲料对赖氨酸的需求(0.6%~0.8%)[1]。其主要原因是由于占胚乳储藏蛋白绝大多数的醇溶蛋白(70%)所含的赖氨酸及色氨酸含量低所造成。因此,不能依靠增加玉米籽粒蛋白质含量来增加玉米的营养价值,而是需要通过降低胚乳醇溶蛋白的含量,进而增加玉米胚乳中赖氨酸的含量来改良玉米蛋白质的品质[1]。
玉米硬质胚乳和粉质胚乳的比例决定玉米的籽粒质地。opaque2玉米突变体的籽粒中胚乳醇溶蛋白的含量降低,赖氨酸含量显著增加,但其籽粒中硬质胚乳含量降低,粉质胚乳含量增高,因此,胚乳表现出软质、粉质的特征,不仅影响玉米产量,而且易受机械损伤,易感染昆虫、病原菌等[2-3]。育种工作者通过利用opaque-2(o2)修饰因子,在o2存在的情况下恢复籽粒硬度培育了优质蛋白玉米(Quality protein maize,QPM),从而应用到生产中[4]。
本研究从玉米籽粒形态结构、玉米胚乳醇溶蛋白的分类及形成过程、转录因子对醇溶蛋白表达的调控这3个部分展开叙述,综述了玉米胚乳醇溶蛋白合成的分子机制,对优良玉米品种的培育具有重要意义。
1 玉米籽粒的形态结构
成熟的玉米籽粒由胚(embryo)、胚乳(endosperm)以及包裹胚和胚乳的种皮(pericarp)3个部分组成,其中,胚乳占籽粒体积和质量的绝大部分,大约占籽粒干质量的85%,是决定玉米籽粒大小和产量的关键因素(图1)[5]。
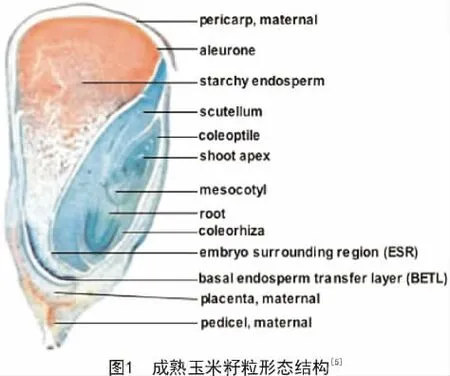
玉米籽粒通过双受精获得,雄配子体的一个精细胞与卵细胞融合成受精卵,进而发育形成二倍体的胚;另一个精细胞与具有双核的中央细胞融合成受精极核,最终发育形成三倍体的胚乳;种皮由来自母本的珠被发育而来,包裹着胚和胚乳。胚的结构由外到内依次为:盾片(scutellum)、胚芽鞘(coleoptile)、胚根鞘(coleorhiza)、胚芽(shoot apex)、胚根(root)以及中胚轴(mesocotyl)。胚乳的结构包含胚周围区(Embryo surrounding region,ESR)、基部胚乳转移层(Basal endosperm transfer layer,BETL)、淀粉胚乳区(Starchy endosperm region)以及糊粉层(Aleurone layer)。其中,淀粉胚乳区是籽粒构成的主体部分,主要负责蛋白和碳水化合物的合成[5]。
2 玉米胚乳醇溶蛋白分类及形成过程
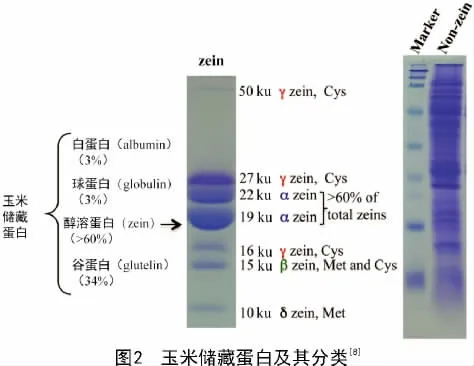
玉米籽粒胚乳是营养物质的储藏中心,主要包含淀粉及储藏蛋白。玉米胚乳储藏蛋白的组分决定了胚乳的结构和营养品质[5-6]。储藏蛋白以蛋白体的形式存在,根据溶解度的不同将胚乳储藏蛋白分为白蛋白(albumin)、球蛋白(globulin)、谷蛋白(glutelin)和醇溶蛋白(prolamin)。其中,醇溶蛋白占到总蛋白含量的70%,是含量最多的胚乳储藏蛋白[7]。
玉米胚乳醇溶蛋白包含4个亚类(图2),即α-zeins(19、22 ku)、γ-zeins(50、27、16 ku)、β-zeins(15 ku)和δ-zeins(18、10 ku)[8]。其中,α-zein占总醇溶蛋白含量的60%以上,是醇溶蛋白的主要组分。
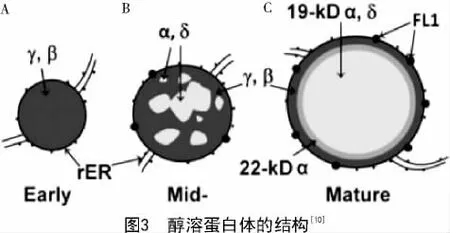
醇溶蛋白在胚乳中的形成和积累具有特异性。大约授粉后10 d左右,醇溶蛋白开始合成[7]。胚乳发育的过程中蛋白体由外向内逐渐形成,在蛋白体形成早期,β-zein和γ-zein作为结构蛋白在糙面内质网上先合成,并积累在蛋白体的外围(图3-A)。在蛋白体形成的中期,大多数的α-zein和少数的δ-zein开始在内部积累,并逐渐形成球形的蛋白体(图3-B)。在蛋白体形成的后期,19 ku α-zein及δ-zein位于蛋白体的核心,包裹在22 ku α-zein的内部,而最外层是β-zein和γ-zein,形成成熟的蛋白体(图3-C)。成熟的蛋白体直径在1~2 μm,呈均匀的圆形,并且α-zein必须在γ-zein存在下才能稳定积累[9-10]。
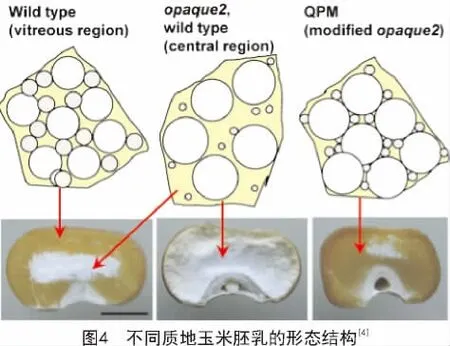
玉米醇溶蛋白在胚乳发育过程中的胚乳蛋白体中大量积累,对蛋白体的形成具有重要作用,进而能够影响玉米籽粒的质地[10]。关于玉米质地的形成,DUVICK的观点被广泛认可。他认为在发育中的胚乳外周区域存在一定比例的淀粉粒、蛋白质和黏性细胞质,在籽粒成熟脱水时形成坚硬的致密的透明的硬质胚乳;而在胚乳中央区域,醇溶蛋白体较小且数量较少,籽粒成熟干燥时不能形成坚硬的基质,淀粉粒完全裸露,导致了胚乳中央区域呈现粉质状(图4)[11]。在o2突变体中,主要的醇溶蛋白组分α-zein的含量降低了60%以上,因此,胚乳外周区域也粉质化(图4)。而o2突变体中籽粒总蛋白含量几乎保持不变,因此相应地提高了籽粒中的非醇溶蛋白及赖氨酸含量[12]。然而,粉质化严重影响了o2突变体在实际储存及生产中的应用。经过墨西哥国际玉米和小麦改良中心(CIMMYT)对硬粒透明o2突变体品种的选育,筛选到了QPM品种,既保留了o2突变体中低含量的α-zein及高含量的赖氨酸和色氨酸,又具有和野生型基本相同的籽粒硬度[4]。
因此,改变胚乳醇溶蛋白的合成及蛋白体的形成就能改变籽粒的质地。与其他3种储藏蛋白(也叫非醇溶蛋白)相比,醇溶蛋白缺乏必需的赖氨酸及色氨酸,严重影响了玉米的营养品质。因而,改变醇溶蛋白的组分及含量对改善玉米营养品质及籽粒外观具有重要意义。通过育种技术改变醇溶蛋白的组分及含量,提高玉米品质、肉蛋制品的品质及改善人类营养摄取是重要的手段[13]。
3 转录因子对醇溶蛋白表达的调控
尽管已经有一些报道指出醇溶蛋白基因是受转录后调控[14-15],但是转录因子(Transcription factor,TF)对醇溶蛋白的转录调控发挥主要作用(表1)[16]。转录因子能够结合在醇溶蛋白基因启动子区的调控元件上,从而调控醇溶蛋白基因的表达。目前报道的调控醇溶蛋白基因表达的转录因子有5个家族,bZIP(basicregion-leucinezipper)家族的O2(Opaque-2)、OHP1/2(O2 Heterodimerizing Protein 1/2)和ZmbZip22,Dof(DNA binding with One Finger)家族的PBF1(P-box Binding Factor1),MADS家族的Zm-MADS47以及NAC家族的ZmNAC128/130。
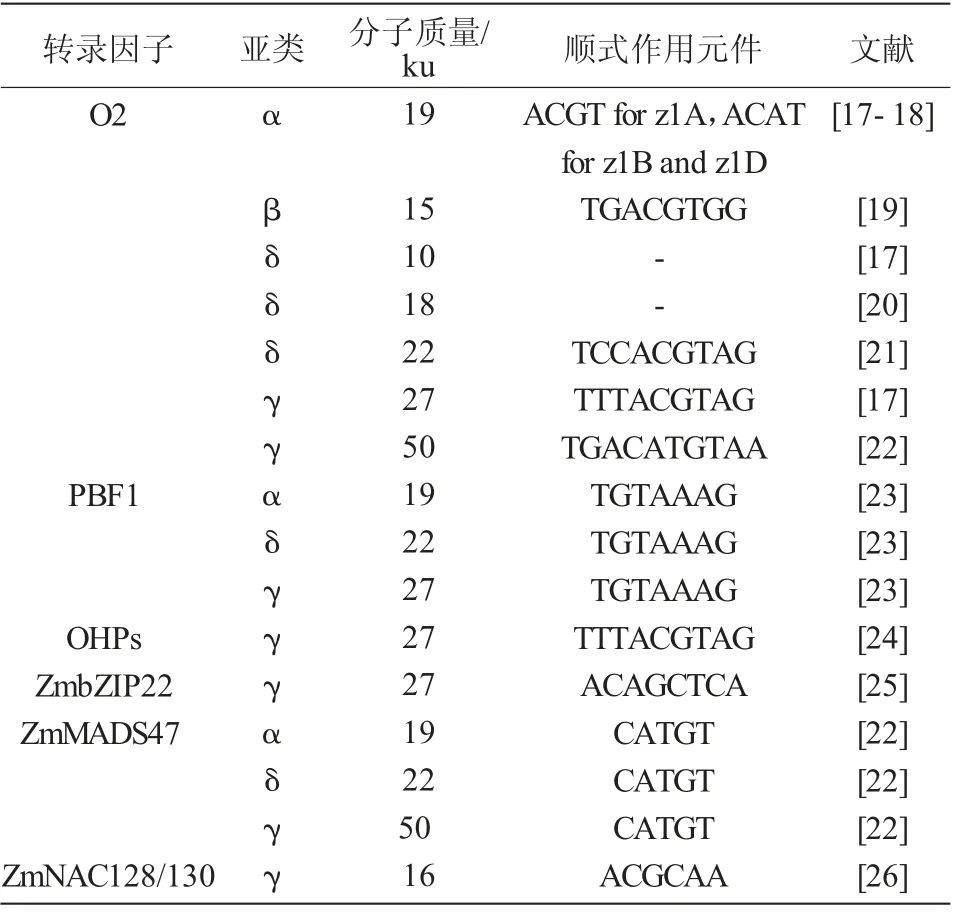
表1 调控醇溶蛋白的转录因子
O2是正向调控胚乳醇溶蛋白表达的转录因子,通过转座子标签法克隆到O2基因,发现其在发育的胚乳中特异性表达[27]。O2通过结合22 ku α-zein启动子区的O2-box(5′-TCCACGTAG-3′)核心元件调控其转录[21]。该基因突变会导致22 ku α-zein基因的表达量降低,并会使得富含赖氨酸的非醇溶蛋白的含量增加[21]。此外,o2基因的突变还能增加游离氨基酸的含量[28]。利用染色质免疫沉淀测序研究表明,除了编码16 ku γ-zein的基因外,O2可以直接激活几乎所有的醇溶蛋白编码基因;然而,O2对不同的醇溶蛋白基因启动子的激活程度不同[17,20,26,29]。
o2是隐性的、多效性的,而且在不同的α-zein单倍型中渗透程度不同[30]。在有的品系中α-zein的含量能减少60%以上[8]。o2修饰因子(o2 modifier)能够在o2存在条件下,将粉质的胚乳转化为坚硬的籽粒质地。这种经修饰产生的o2突变体即为QPM[31-32]。QPM胚乳中α-zein维持较低的含量,而积累了大量的小的、富含γ-zein的蛋白体,其γ-zein含量是野生型及o2突变体胚乳的2~3倍[33],这些蛋白体被认为可以形成一种坚硬的硬质基质,其质地类似于成熟的野生型胚乳(图4)。
2008年HOLDING等[32]的研究发现,在玉米7号染色体上存在7个o2修饰因子位点,其中,o2 modifier1落在7号染色体上(chr7:13861507-128175453),位于27 ku γ-zein位点的附近,是主效的胚乳修饰位点,而其余6个修饰位点的效应较小。γ-zein被认为是胚乳修饰所必需的[34]。为了进一步探究γ-zein对QPM胚乳修饰的作用,巫永睿研究员课题组通过全基因组关联分析结合连锁分析发现一个数量性状位点(Quantitative trait locus,QTL)qγ27,该位点位于o2 modifier1的同一区域。qγ27是在27 ku γ-zein位点上产生15.26 kb的重复,增强了27 ku γ-zein在QPM胚乳修饰中的表达。这个片段的复制发生在玉米驯化改良之前,其祖先大刍草中已存在此片段。由于提高27 ku γ-zein表达量对优质蛋白玉米胚乳修饰具有重要作用,因此,推测qγ27位点的存在是人工选择的结果,并且这项研究将会为优质蛋白玉米育种提供有效的分子标签[35]。
在编码醇溶蛋白基因翻译起始位点上游约300 bp的启动子区存在保守的醇溶蛋白框(Prolamin Box,P-box)基序(5′-TGTAAAG-3′),该基序存在于多种作物中编码种子储藏蛋白基因的启动子区[23]。PBF(Prolamin-box Binding Factor)属于植物特有的锌指DNA结合蛋白的Dof类转录因子家族,其能够与P-box基序结合并激活醇溶蛋白基因在胚乳发育时期特异表达[23]。PBF还能与O2相互作用,O2结合位点在22 ku α-zein基因启动子区P-box下游的20 bp处,二者协同调控α-zein基因的转录[7]。令人惊讶的是,使用RNAi沉默PBF1导致27 ku γ-zein严重减少,而α-zein的减少量较少[7],这表明PBF1在调控醇溶蛋白基因表达中的作用可能是复杂的。然而,缺乏有效的突变体去进一步探究该基因在胚乳发育中的具体作用。利用瞬时表达系统研究玉米PBF1和O2对水稻及小麦储藏蛋白基因的转录激活作用,研究发现,PBF1和O2对水稻及小麦储存蛋白表达具有协同叠加效应,提高了水稻籽粒储藏蛋白基因的表达[36]。小麦中的WPBF(Wheat Prolamin-box Binding Factor)对小麦籽粒发育过程中α-zein基因的表达也发挥同样作用[37]。由此可见,不同禾本科物种中PBF1和O2的同源基因都能够在胚乳发育过程中发挥相似的作用,参与调控胚乳发育的基因在遗传基础上具有一定的保守性。
O2异源二聚体蛋白OHP1(O2 Heterodimerizing Protein,OHP)、OHP2是2个bZIP转录因子[38-39]。与O2不同,OHPs在所有玉米组织中组成型表达[24]。OHP能够识别所有α-zein基因的启动子区并激活转录,但是OHP激活α-zein基因表达量的变化要比O2低得多。在O2正常表达的株系中抑制OPH的表达,α-zein基因的表达量没有明显下降,但是O2的缺失突变体中,OHP对α-zein的表达起重要作用。证实了O2是主要的转录因子而OHP只是发挥较小的转录调控作用。这项发现在27 ku的γ-zein中是相反的结论,表明O2和OHP经过基因复制后功能分化,对醇溶蛋白的表达发挥特异的调控作用[18]。从进化分析,玉米转录因子O2和OHP1、OHP2起源于片段复制。OHP1和OHP2能够结合到编码27 ku γ-zein基因启动子区的顺式作用元件O2-like box(5′-TTTACGT-3′)上,与PBF互作,共同调控27 ku γ-zein的表达。它们的沉默导致27 ku γ-zein蛋白丰度的显著减少。o2;PbfRNAi;OhpRNAi的三突变体中醇溶蛋白蛋白体只有野生型的1/10大小[24]。这些研究证实,OHPs、O2和PBF是玉米醇溶蛋白合成的主要调节因子,它们以累加和协同的方式共同作用。OHP和O2基因表达模式的差异可能导致蛋白体形成过程中27 ku γ-zein和22 ku α-zein积累时间的轻微差异。
ZmbZIP22是另一个胚乳特异性表达的bZIP转录因子,能够激活编码27 ku γ-zein基因的转录[25]。ZmbZIP22直接与27 ku γ-zein基因启动子区的ACA GCTCA框结合,激活27 ku γ-zein基因的表达。通过CRISPR/Cas9获得的zmbzip22突变体中,27 ku γ-zein基因的表达量明显降低。通过萤光素酶互补呈像及酵母双杂交发现,ZmbZIP22能够与PBF1、OHP1和OHP2相互作用,但不能与O2相互作用。因此,ZmbZIP22能够与其他转录因子共同调控27 ku γ-zein基因的表达。
ZmMADS47是MADS-box家族的转录因子,最初由酵母双杂交筛选O2的互作蛋白获得。Zm-MADS47主要通过与O2的相互作用,激活编码αzein和50 ku γ-zein基因的表达[23]。尽管存在与O2的相互作用,ZmMADS47表现出的是一种与OHPs类似的组成型表达,而不是与O2表达模式相同的胚乳特异性表达[23]。
编码16-kD γ-zein基因的启动子区缺乏P-box和O2 box基序。因此,该基因的表达不受O2或PBF1的影响。ZmNAC128和ZmNAC130是2个胚乳特异性的NAC家族转录因子,能够直接与16 ku γ-zein基因的启动子区结合激活其转录。这些NAC转录因子影响多个生物过程,RNAi沉默后影响胚乳中碳水化合物和氨基酸的利用以及胚乳中醇溶蛋白和非醇溶蛋白的积累[26]。
由以上分析可知,O2对玉米胚乳储藏蛋白的积累具有较强的影响,能够通过调控多种醇溶蛋白基因的表达进而控制其积累量(表1)。醇溶蛋白基因的表达调控是多个转录因子组合调控的结果,同一类型的醇溶蛋白受到多个转录因子的共同调控,如19 ku α-zein及22 ku δ-zein同时受到O2、PBF1及ZmMADS47的调控;27 ku γ-zein同时受到O2、PBF1、OHPs及ZmbZIP22的调控;50 ku γ-zein同时受到O2及ZmMADS47的调控。在调控醇溶蛋白基 因 的 转 录 因 子 中,O2、PBF1、ZmbZIP22、ZmNAC128和ZmNAC130都在胚乳中特异性表达,而OHPs和ZmMADS47则是组成性表达。这表明玉米醇溶蛋白编码基因的表达模式不仅受胚乳特异性转录因子的调控,还受到其他途径的调控。
4 展望
玉米是我国最主要的粮食作物之一,在保障国家粮食安全和人口稳定方面发挥着重要的作用。在前人不断的育种实践过程中,玉米的产量得到突飞猛进的增长。现阶段对高品质玉米、口感佳的鲜食玉米、抗逆玉米品种、适宜机械化收获的玉米品种培育有了更多的需求,如鉴定和筛选抗旱及耐密易机收的玉米品种[40-41]、选育鲜食优质白糯玉米品种[42]、因地制宜选择适宜特定产区的高产氮高效玉米品种[43]。探究玉米胚乳醇溶蛋白合成的分子机制对培育高品质玉米品种具有现实意义。
随着基因组学、生物化学和高分辨率显微镜技术的进步,极大地扩展了研究人员对玉米醇溶蛋白生物合成和蛋白体形成的认识。然而,研究人员对玉米醇溶蛋白基因表达调控的认识还有更广阔的空间需要去探索。根据现有的研究报道,大多数的醇溶蛋白基因由一个或多个转录因子调控,而将这些编码转录因子的基因突变体后,表现出醇溶蛋白的生物合成量降低而并非完全没有积累。这表明醇溶蛋白的合成途径还受到一些未被发掘的转录因子的调控。前人总结了在小麦育种过程中利用其野生近缘种偃麦草属植物对小麦遗传改良的研究[44-45],未来的玉米种质的研究可能通过利用其野生资源大刍草挖掘更多新的调控醇溶蛋白的转录因子以及阐明其复杂的调控网络。
近年来,随着玉米醇溶蛋白表达调控以及分子遗传学的研究进展,对QPM的调控机制也有了新的认识,使得在不丢失其他优良农艺性状的情况下调控籽粒营养成分成为可能。玉米胚乳醇溶蛋白的表达影响玉米籽粒的营养品质。利用CRISPR/Cas9基因编辑技术敲除部分编码醇溶蛋白的基因,能够选择性地降低部分醇溶蛋白基因的表达,从而提高玉米籽粒的赖氨酸含量及蛋白品质。通过对醇溶蛋白不断深入的基础研究将为QPM育种材料的选育提供指导,加快QPM的育种进程。

