动态pH值调控策略提高ε-聚赖氨酸发酵产量及其原因解析
邓玥,柳天一,陈旭升*
1(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由25~35个L-赖氨酸单体,在ε-PL合成酶催化下通过ε-氨基和α-羧基脱水缩合连接而成的同型氨基酸聚合物[1],具有广谱的抑菌活性和优良应用属性,现已被多个国家批准作为生物防腐剂在食品、化妆品防腐等领域应用[2-4]。近年来,在医药、生物制药和农业等行业中也显示出应用潜力[5-7]。因此,ε-PL具有广阔的市场应用前景。
微生物发酵法是目前工业生产ε-PL的唯一方式,提升发酵水平以降低其生产成本是实现ε-PL广泛应用的重要前提。因此,研究者们试图通过菌株选育和发酵过程优化来提高生产菌的ε-PL发酵产量。相比于菌株选育,发酵过程优化与调控是一种简单、快速提高产物发酵水平的有效手段。在ε-PL发酵优化和调控研究方面,KAHAR等[8]建立了两阶段pH值控制策略,结合葡萄糖和硫酸铵流加工艺,实现StreptomycesalbulusS410的ε-PL产量达到48.3 g/L,长期处于国际领先水平。ZHANG等[9]采用丝瓜囊作为细胞固定化载体,建立了搅拌式发酵罐Kitasatosporasp.MY 5-36重复批次发酵工艺,ε-PL平均产量达到34.11 g/L,固定化细胞重复利用5次,发酵周期达到526 h。LIU等[10]利用弱酸性阳离子树脂D152进行ε-PL原位产物分离发酵的尝试,在5 L发酵罐中进行192 h补料分批发酵,ε-PL质量浓度达到23.4 g/L,较游离菌体发酵ε-PL产量提高了6.2倍。作者所在实验室提出了一种pH冲击发酵策略,经过192 h补料分批发酵,可实现S.albulusM-Z18发酵甘油和葡萄糖生产ε-PL的产量分别达到54.7和47.13 g/L[11-12],帮助我国ε-PL发酵产量迈入国际先进行列。由此可见,通过优化菌体发酵方式和调控pH值能够有效提升ε-PL发酵水平。
前期,本实验室通过长期的菌株选育,获得了1株ε-PL高产突变株S.albulusGS114,其摇瓶ε-PL产量较出发菌株S.albulusM-Z18提高了70%左右。然而,采用已有的培养条件和发酵控制策略,S.albulusGS114的ε-PL产量较出发菌株仅能提高13%左右[13]。如何建立针对性的发酵调控策略是发挥高产菌株生产潜能的关键。因此,本文通过调节pH值的方式来调控发酵中后期溶氧水平,以期提高S.albulusGS114的ε-PL发酵产量,并从氧化损伤角度,初步解析该策略提高ε-PL发酵产量的原因。
1 材料与方法
1.1 材料
1.1.1 菌株
StreptomycesalbulusGS114,实验室选育和保藏。
1.1.2 培养基
固体培养基(BTN)(g/L):葡萄糖10,酵母粉1,鱼粉蛋白胨2,pH 7.5。
种子培养基(g/L):葡萄糖30,酵母粉8,(NH4)2SO45,KH2PO41.36,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,pH 7.5。
发酵培养基(g/L):葡萄糖90,酵母粉8,(NH4)2SO45,KH2PO41.36,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,pH 6.8。
1.1.3 试剂和仪器
葡萄糖,优级纯,山东西王药业有限公司;酵母粉,Oxide公司;其他试剂分析纯,国药化学试剂有限公司;过氧化氢酶(catalase,CAT)检测试剂盒,南京建成生物工程研究所;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒,苏州科铭生物技术有限公司。
5 L发酵罐,上海保兴生物设备有限公司;T&J-Miniskid 1 L*4迷你平行生物反应器,迪比尔生物工程(上海)有限公司;UV-2100分光光度计,优尼科仪器有限公司;AB204-N分析天平,瑞士梅特勒公司;恒温培养箱GNP-9160,上海光都仪器设备有限公司;3K15高速冷冻离心机,德国西格玛公司;Enspire多标记检测系统(酶标仪),珀金埃尔默有限公司;biotek多功能酶标仪,美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 培养方法
种子培养:挑取2~3环孢子接种至种子培养基,30 ℃、200 r/min培养24 h。

不同pH条件的分批发酵:将培养好的种子液以体积分数8%接种量接入,装液量为600 mL,温度设置为30 ℃,初始转速为200 r/min,溶氧设置为30%,转速溶氧联动控制。待pH分别自然下降至3.5、4.0、4.5和5.0时,用体积分数12.5%的NH3·H2O分别维持pH恒定直至发酵结束。
1.2.2 分析方法

活性氧(reactive oxygen species,ROS)测定:采用荧光探针2,7-二氯荧光双乙酸盐(2,7-dichlorofluorescent diacetate,DCFH-DA)测定,方法为:取80 μL发酵液置于1.5 mL离心管中,加入920 mL磷酸缓冲液进行稀释悬浮后,再加入浓度为10 mmol/L的DCFH-DA 1 μL,充分混匀后置于30 ℃,200 r/min摇床中,反应40 min。12 000 r/min离心5 min,弃上清液,收集菌体,加入磷酸缓冲液12 000 r/min离心5 min洗涤4次,弃上清液,再加800 μL磷酸缓冲液重悬菌体,吸取200 μL于酶标孔中,在502、530 nm下检测荧光强度,并通过蛋白浓度将其定量。根据荧光强度的大小即可反映胞内ROS的水平。
氧化损伤指标测定:丙二醛(malonaldehyde,MDA)含量参考ZENG等[17]的方法。
羰基含量测定参考段丽菊等[18]的方法。
抗氧化体系测定:SOD、CAT和T-AOC按照试剂盒说明进行操作。
2 结果与讨论
2.1 基于动态pH值调控溶氧水平策略发酵生产ε-PL的过程参数分析
低pH值冲击工艺是本实验室在优化S.albulusM-Z18发酵生产ε-PL时,建立的一种高效发酵生产ε-PL的控制策略。将该调控策略用于S.albulusGS114发酵生产ε-PL时(图1-a),可实现ε-PL产量达到44.1 g/L,菌体量为38.99 g/L。相比于S.albulusM-Z18发酵结果,ε-PL产量提高了16%,但菌体量却下降了24.4%,显示出S.albulusGS114具有较高的单位菌体ε-PL合成能力。S.albulusGS114是经过基因组重排和核糖体工程连续选育,获得的1株高产ε-PL突变株,其摇瓶ε-PL产量达到3.0 g/L,较出发菌S.albulusM-Z18提高了1.7倍。然而,S.albulusGS114作为二代菌株,在5 L发酵罐中ε-PL发酵产量仅较一代菌株S.albulusM-Z18提高了10%左右,显示出S.albulusGS114仍有产量提升空间。如图1-a所示,利用低pH冲击工艺,可以实现S.albulusGS114产量达到44.1 g/L,菌体量为(38.99±3.83)g/L。另外,从发酵过程溶氧变化趋势来看,从36 h开始溶氧水平逐渐上升,到96 h时溶氧水平达到70%并一直维持至发酵结束,意味着在发酵过程中S.albulusGS114出现了明显菌体活力下降。因此,我们试图通过提升菌体活力达到增加菌体量的目的,以进一步提高ε-PL产量。
为此,本研究通过发酵中后期动态调节pH值来控制发酵过程溶氧水平保持在20%~40%,从而建立了一种基于动态pH值调节溶氧水平的发酵控制策略,发酵过程参数如图1-b所示。采用动态pH值调节溶氧水平的发酵控制策略,在48 h时适当提高pH值,随后溶氧在60 h左右开始下降;当溶氧水平低于20%时,再适当下调pH值,如此反复,实现发酵过程溶氧水平维持在20%~40%。经过192 h补料分批发酵,DCW达到62.03 g/L,ε-PL产量达到(60.2±0.94)g/L,分别比未调控提高了59%和36%。由此可见,基于动态pH值调节溶氧水平的发酵控制策略,不仅能够显著改善S.albulusGS114生长状况,而且能够明显提高其ε-PL发酵产量,实现二代菌株S.albulusGS114发酵产量的进一步提高,对提升工业发酵ε-PL水平具有重要指导意义。

a-pH冲击策略;b-pH调控策略图1 不同策略发酵过程中各指标变化Fig.1 Indices under different strategies during fermentation
2.2 动态pH值调控溶氧水平发酵生产ε-PL过程的氧化损伤相关参数分析
2.2.1 ROS水平及氧化损伤分析
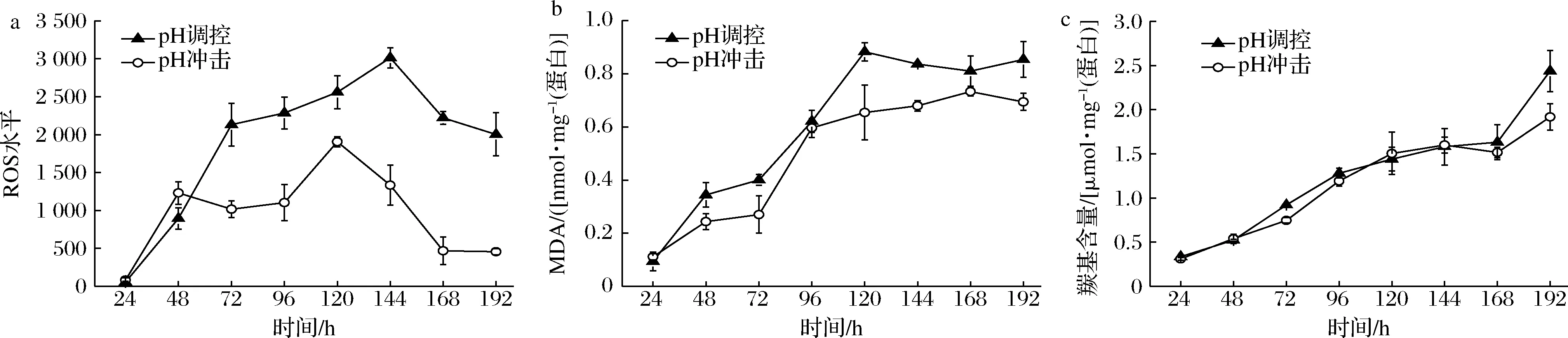
a-ROS;b-MDA;c-羰基含量图2 发酵过程中的氧化损伤参数比较Fig.2 Comparison of oxidation damage parameters during fermentation
分别以脂质氧化产物MDA(图2-b)和蛋白质氧化产物羰基(图2-c)的含量作为氧化损伤指标来评估ROS对菌体带来的氧化损伤。如图2-b所示,MDA含量随着发酵进行而逐渐上升,在整个发酵过程中pH调控组始终略高于pH冲击组,这也符合高ROS水平会给菌体带来更高氧化损伤的一般认知。然而,如图2-c所示,2组的羰基含量几乎处于同一水平,直到发酵结束时才出现差异。这可能因为小白链霉菌的呼吸链位于细胞膜上,呼吸作用产生的ROS首先对膜脂质进行攻击,同时膜脂质的氧化增加了电子泄露的可能[21],导致更高的ROS水平。
以上结果说明,随着发酵的进行S.albulusGS114受到的氧化损伤程度逐渐增加,但是更高的ROS水平并未带来更高的氧化损伤。这可能是因为通过pH调控策略使得菌体的活力增强,即使在ROS水平较高的情况下也能够通过激活抗氧化系统来保护自身免受氧化胁迫的危害。
2.2.2 抗氧化能力分析
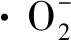
a-CAT;b-SOD;c-T-AOC图3 发酵过程中抗氧化能力参数比较Fig.3 Comparison of antioxidant capacity parameters during fermentation
2.3 pH值对ε-PL发酵过程中氧化损伤相关参数影响的分析
为了探究动态pH值调控溶氧发酵过程中,ROS水平升高和菌体抗氧化能力提高的原因,本研究分别考察了S.albulusGS114在pH 3.5、4.0、4.5和5.0的ROS水平和菌体T-AOC。如图4-a所示,pH值越高DCW越大,在pH 5.0发酵条件下,菌体生长情况最好;而在pH 3.5时,DCW在36 h达到最大之后开始逐渐下降,表明S.albulusGS114在此pH值下不适宜生长。图4-b显示的是不同pH值下菌体细胞内的ROS水平。pH值越高,ROS水平越高,除pH 3.5外,ROS在12~24 h激增,在24~48 h波动不大,48 h后迅速增加,整体上呈现先上升后稳定再上升的趋势。这可能是由于在较高的pH下,菌体生长状态较好,其呼吸活力较强,产生的ROS水平就越高,这个结果与pH调控组的ROS水平较高相吻合(图3-a)。图4-c显示的是对不同pH下S.albulusGS114胞内的总抗氧化能力进行了比较。菌体总抗氧化能力与发酵pH值高地成正比,pH 3.5时抗氧化能力明显低于其他3组,这也与其菌体生长情况相吻合,表明较低的pH不仅抑制了S.albulusGS114的正常生长,也抑制了其胞内各种代谢的正常进行。通过考察不同pH条件下S.albulusGS114的ROS水平和T-AOC发现,pH值越高ROS水平越高,在pH 4.0与4.5时,随着发酵时间的增加,ROS水平的差异逐渐增大,由于pH调控策略在发酵过程中有较长的一段时间需要将pH提升至4.0以上,因此在pH调控的发酵过程中ROS一直处于较高的水平;菌体的总抗氧化能力也与发酵pH值成正比,这可能是由于pH越高,S.albulusGS114生长状态越好,呼吸活力的增强带来了更多的ROS,从而激活胞内的抗氧化系统,使得自身的总抗氧化能力得到增强。

a-DCW;b-ROS;c-T-AOC图4 不同pH发酵的菌体量、ROS水平和抗氧化能力比较Fig.4 Comparison of biomass,ROS level and T-AOC during fermentation with different pH
3 结论
为了提高S.albulusGS114的ε-PL发酵产量,本文通过在发酵中后期动态调节pH值来控制发酵过程溶氧水平在20%~40%,建立了一种基于动态pH值调节溶氧水平的发酵控制策略,ε-PL产量达到(60.2±0.94)g/L,较未调控发酵提高了36%。通过氧化损伤相关参数分析,初步揭示了动态pH值调节溶氧水平提高ε-PL发酵产量的原因:动态调节pH值策略显著增强了发酵中后期菌体生长能力和总抗氧化能力(包括过氧化氢酶活性),以维持菌体胞内ROS产生水平维持在菌体可以承受的范围,促进了ε-PL在发酵中后期的生物合成。很多研究都已表明ROS具有调节次级代谢产物的作用[22-24],本研究结果初步发现了ROS对促进ε-PL生物合成的潜在作用,因此下一步将考察ROS是否直接调节聚赖氨酸的合成,为提升工业发酵ε-PL水平提出进一步指导。

