川明参多糖在体外模拟消化过程中的结构变化及对消化酶活性的影响
高涛,罗黄洋,吴韧,阎睿,2,贺灵芝,2,程飞,唐华丽*
1(重庆三峡学院 生物与食品工程学院,重庆,404100) 2(重庆市万州药品检验所,重庆,404100)
川明参(ChuanminshenviolaceumSheh et Shan)作为一种具有药食两用潜力的传统中药,是伞形科多年生草本植物,主要分布于四川与湖北等地,富含多糖[1]、香豆素[2]、氨基酸[3]及脂肪酸等物质[4]。多糖作为川明参中活性物质的主要成分,具有较好的增强免疫[5]、抗病毒[6]、抗菌[7]和抗氧化[8-9]等生物活性。川明参作为一种潜在的食品资源,目前对其他营养素的消化吸收的影响还未见报道。α-淀粉酶、脂肪酶和胃蛋白酶是消化道中主要的消化酶,主要负责碳水化合物、脂肪和蛋白质等常见营养素的消化[10]。值得注意的是,消化酶不仅影响食物的消化吸收,还与一些疾病有关,例如糖尿病[11]、肥胖[12]、心血管疾病[13]、高血压[14]、胃食管反流病[15]、扁桃体肥大等[16]。
绝大多数植物多糖不能完全被消化道降解,进而到达结肠,被肠道微生物发酵利用[17]。但也有数据表明,人体消化液对于多糖的结构依旧存在一定的影响[18]。川明参多糖作为一种葡聚糖,且含有较多的(1→4)-α-D-Glcp,故探究川明参多糖在消化过程中的结构变化显得尤为重要。消化实验最好的方式是直接在生物体内部进行,但由于消化系统的复杂性、道德约束及实验成本等方面的原因,大多数情况都是选择体外实验模拟体内消化的方式进行的[19]。
本文采用超声辅助水提醇沉法提取川明参粗多糖(Chuanminshenviolaceumpolysaccharides,CVPs),经纤维素柱和凝胶柱层析制备川明参多糖主要成分(CVPs-1-G)。采用体外模拟实验结合凝胶渗透色谱和质谱探究川明参多糖在模拟消化过程中的结构变化以及寡糖生成情况,并测定各阶段消化产物对消化酶活性的影响。此外,以结合自由能为指标,采用分子对接技术研究CVPs-1-G消化后生成的寡糖对消化酶活性的影响。
1 材料与方法
1.1 材料与试剂
川明参购自于重庆市万州区中草药市场,粉碎后过40目筛,于95%的乙醇中浸泡1 d后除去小分子物质,过滤收集沉淀,保存于45 ℃烘箱中;α-淀粉酶、脂肪酶、胃蛋白酶、牛血清蛋白(bovine serum albumin,BSA)、可溶性淀粉、三氯乙酸、4-硝基苯棕榈酸酯,上海麦克林试剂有限责任公司;DNS试剂、PBS、Tris-HCl,飞净生物科技有限公司;其余试剂均为国产分析纯。
1.2 主要仪器及设备
UV-2450紫外可见光分光光度计,LC-10A型高效液相色谱仪,日本岛津公司;Imark酶标仪,BIO-RAD公司;ALPH1-2/LD-Plus冷冻干燥机,德国CHRIST公司;LC-10A型高效液相色谱仪;TSQ Quantum质谱仪,美国赛默飞公司。
1.3 试验方法
1.3.1 川明参粗多糖的提取
按文献[8]的方法制备川明参粗多糖。称取一定质量川明参粉置于2 000 mL锥形瓶中,按料液比1∶20(g∶mL)加入蒸馏水溶解。在300 Hz,60 ℃条件下,超声提取90 min。过滤浓缩后,按4∶1的体积比向浓缩液中加入Sevag试剂[V(氯仿)∶V(正丁醇)=4∶1],剧烈振荡20 min,收集水相,重复6次后,加入无水乙醇沉淀至乙醇体积分数至80%。静置过夜,离心收集沉淀,真空冷冻干燥即可得到粗多糖粉末。
1.3.2 CVPs-1-G的制备
称取500 mg川明参粗多糖粉末溶于10 mL去离子水中,8 000 r/min离心10 min,取上清液过0.45 μL水系滤膜后上样。分别用0、0.1、0.2、0.3 mol/L的NaCl溶液进行梯度洗脱。色谱柱为DEAE-52纤维素柱(2.5 cm×60 cm),设置流速为1 mL/min,每10 min收集一管。收集NaCl浓度为0 mol/L的洗脱组分,按上述步骤操作进行Sephadex G-100凝胶柱(2.5 cm×60 cm)层析,洗脱曲线为单峰,收集峰并冷冻干燥即为CVPs-1-G。
1.3.3 CVPs-1-G的体外模拟消化
1.3.3.1 模拟口腔消化
模拟口腔消化实验参考文献[17]和[20]的方法进行。收集6名符合条件的志愿者的新鲜唾液,5 000 r/min离心10 min,收集上清液,按照RUTH等[21]的方法测定唾液淀粉酶活性,并于-20 ℃条件下保存待用。取5 mL唾液放置于37 ℃条件下预热30 min,加入5 mL多糖溶液(10 mg/mL)于37 ℃条件下保持0、5、15、30 min后沸水浴10 min。测定分子质量与还原糖生成量。
1.3.3.2 模拟胃消化
参考文献[17]的方法配制模拟胃液,并参考文献[17]和[20]的方法进行模拟胃消化。首先将经唾液消化30 min的多糖溶液用0.1 mol/L的HCl调节pH至2.0,再进行模拟胃消化实验。取5 mL胃液和5 mL调节好pH的唾液消化产物,放置于恒温振荡器中进行反应,调节温度为37 ℃,振荡速度为120 r/min。反应1、2、4、6 h后取出沸水浴10 min,消化产物经透析袋透析,再经Sevag法除蛋白质后冷冻干燥,测定分子质量及还原糖生成量。
1.3.3.3 模拟小肠消化
参考文献[17]的方法配制模拟小肠液体,并参考文献[17]和[20]的方法进行模拟小肠消化。首先将经模拟胃消化6 h后的多糖消化液用1 mol/L的NaHCO3调节pH至7.0,再进行模拟小肠消化实验。取10 mL调好pH的多糖胃消化液和3 mL小肠液混匀,放置于恒温振荡器中,调节温度为37 ℃,振荡速度为120 r/min。反应1、2、4、6 h后取出沸水浴10 min,消化产物经透析袋透析,再经Sevag法除蛋白质后冷冻干燥,并测定分子质量及还原糖生成量。
1.3.4 分子质量、还原糖生成量及寡糖含量测定
1.3.4.1 分子质量测定
精密称取5 mg样品溶于1 mL超纯水配制的0.05 mol/L的NaCl溶液中,超声波溶解后于12 000 r/min条件下离心10 min,取上清液过0.22 μm水系滤膜后上机分析。上样量20 μL;流速0.6 mL/min;柱温40 ℃。流动相为0.05 mol/L的NaCl溶液。
1.3.4.2 还原糖生成量测定
精确称取干燥后的多糖消化产物,以葡萄糖为对照,采用DNS法测定还原糖含量。
1.3.4.3 寡糖测定
称取5 mg经唾液消化、胃消化和小肠消化的干燥样品溶于10 mL去离子水,12 000 r/min离心10 min,取上清液经适当稀释后过0.22 μm水系滤膜后进行上机分析。气体流速为12 L/min,喷雾电压为3.0 kV,离子源温度为320 ℃,上样速度为20 μL/min,扫描范围为150~3 000 Da,数据记录时间为10 min。
1.3.5 消化产物对消化酶活性的影响
1.3.5.1 α-淀粉酶抑制活性的测定
参照文献[22]的方法测定α-淀粉酶抑制活性[22]。取1 mL的α-淀粉酶溶液(1 mg/mL,采用pH 7.2的0.1 mol/L的PBS配制)于37 ℃条件下预热10 min,随后加入1 mL不同浓度的样品溶液和1 mL质量分数2%的可溶性淀粉溶液,于37 ℃条件下反应10 min。反应完成后,加入1 mL的DNS试剂于100 ℃条件下放置5 min。冷却至室温,加入5 mL蒸馏水,于540 nm处测定紫外吸收波长。以阿卡波糖为对照,α-淀粉酶抑制率按公式(1)计算:
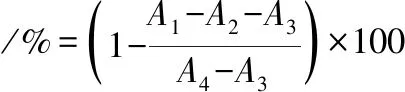
(1)
式中:A1,样品组的吸光度值;A2,蒸馏水代替可溶性淀粉的吸光度值;A3,蒸馏水代替样品和酶的吸光度值;A4,蒸馏水代替样品的吸光度值。
1.3.5.2 脂肪酶抑制活性的测定
参考文献[23]的方法测定脂肪酶抑制活性。于96孔酶标板中加入50 μL不同浓度的样品溶液与50 μL的胰脂肪酶溶液(5 mg/mL,采用pH 7.0的0.2 mol/L的Tris-HCl配制),并于37 ℃条件下预热10 min。随后,加入200 μL浓度为2 mmol/L的4-硝基苯棕榈酸酯(先溶于异丙醇,再以Tris-HCl进行稀释)在37 ℃条件下反应15 min。反应完成后于405 nm处测定紫外吸收波长。以奥利司他为对照,胰脂肪酶抑制活性按公式(2)计算:
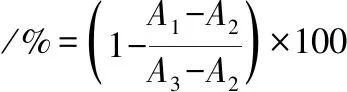
(2)
式中:A1,样品组的吸光度值;A2,蒸馏水代替酶的吸光度值;A3,蒸馏水代替样品的吸光度值;A4,蒸馏水代替样品和酶的吸光度值。
1.3.5.3 胃蛋白酶抑制活性的测定
参考文献[24]的方法测定川明参多糖的胃蛋白酶活性。取1 mL胃蛋白酶溶液(1 mg/mL,用pH 2的PBS进行配制)和1 mL不同浓度的样品溶液于37 ℃条件下预热20 min。随后,加入2 mL质量浓度为0.5 mg/mL的BSA溶液于37 ℃条件下反应10 min。最后,加入2 mL 10%的三氯乙酸终止反应,于275 nm处测定紫外吸光度值。以抑肽素为对照,胃蛋白酶抑制活性按公式(3)计算:
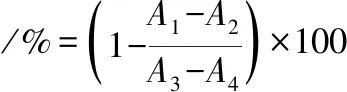
(3)
式中:A1,样品组未反应的吸光度值;A2,样品组反应后的吸光度值;A3,对照组(蒸馏水代替样品)未反应的吸光度值;A4,对照组(蒸馏水代替样品)反应后的吸光度值。
1.3.6 分子对接
采用Chem3D绘制CVPs-1-G消化产物中主要生成寡糖(二糖)的结构式,保存为mol2格式,再将其导入Autodock软件保存为pdbqt格式。在PDB数据库下载α-淀粉酶(https://www.rcsb.org/structure/3DHP)、脂肪酶(https://www.rcsb.org/structure/1LPB)和胃蛋白酶(https://www.rcsb.org/structure/3UTL)的PDB文件,将其导入Pymol软件去除配体,去水加氢并保存为PDB格式文件,再将其导入Autodock软件保存为pdbqt格式文件。最后采用Autodock vina软件进行分子对接,计算其分子结合自由能。
1.4 数据处理
每组实验至少重复3次,结果以平均值±标准差表示。采用SPSS 23.0对数据进行显著性检验,方差齐性时,组间对比LSD检验,方差不齐性时,采用Tamhane’s T2检验。根据Probit回归模型计算IC50。常规数据绘图采用Origin 2018进行,分子对接绘图采用Pymol进行。
2 结果与讨论
2.1 CVPs-1-G的制备及基本结构
采用超声波辅助水提醇沉法提取CVPs,并经DEAE-52纤维素柱和Sephadex G-100凝胶柱分离纯化以制备CVPs-1-G。CVPs-1-G是一种分子质量为(8.1±0.5) kDa,Mw/Mn为1.19,主要由(1→4)-α-D-Glcp组成,并含有一定量的(1→6)-α-D-Glcp,支链通过→4)-α-D-Glcp-(1→与(1→3,6)-α-D-Glcp的O-3和O-6位相连的葡聚糖[25]。其精细结构如图1所示。
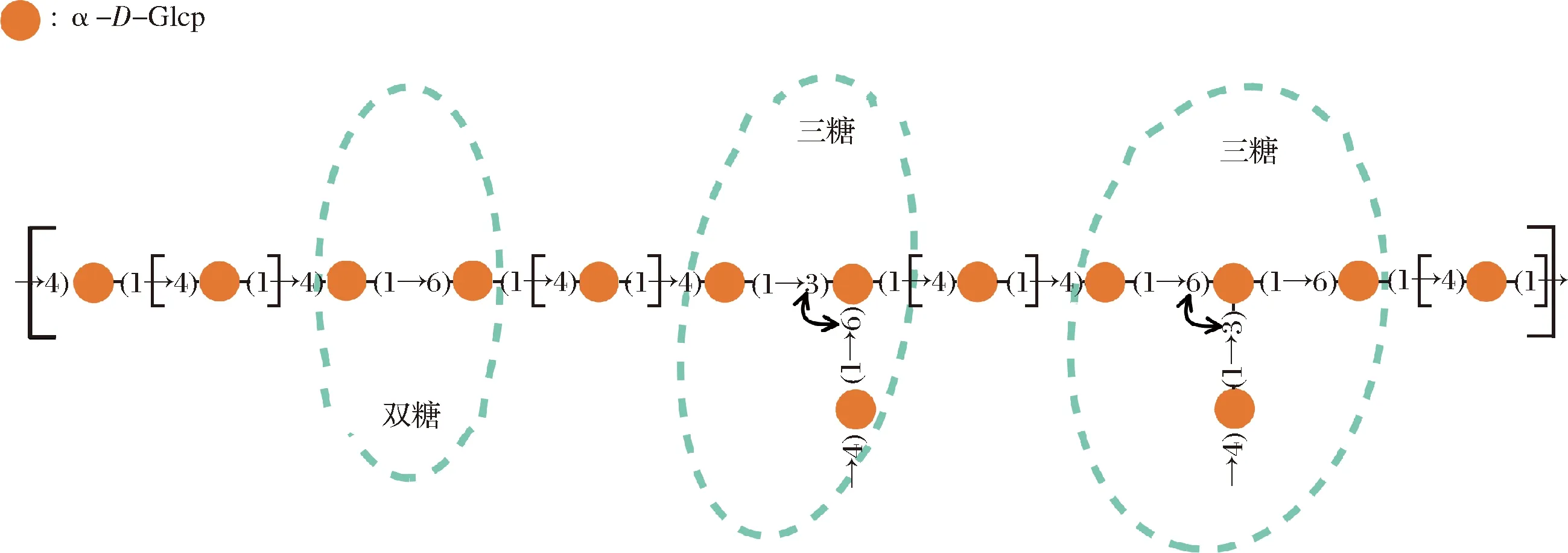
图1 CVPs-1-G的精细结构Fig.1 The structure of CVPs-1-G
2.2 CVPs-1-G在模拟消化过程中的结构变化及寡糖生成情况
2.2.1 CVPs-1-G在唾液消化过程中的分子质量及还原糖生成量的变化
唾液作为与第一个与食物接触的消化液,其中最重要的水解酶为淀粉酶,可水解碳水化合物中的α-1,4糖苷键[21,26]。前期的研究表明,CVPs-1-G是一种葡聚糖,并含有一定量的(1→4)-α-D-Glcp。所以,探究CVPs-1-G在唾液中的消化情况极有必要。经测定后发现,本实验选用的唾液其唾液淀粉酶活性为(176±15) U/mL,此结果在RUTH等[21]报道的18~204 U/mL范围内,符合实验要求。
CVPs-1-G在唾液消化过程中分子质量及还原糖含量的变化如表1和图2所示。CVPs-1-G随着消化时间的延长其在高效凝胶渗透色谱(high performance gel permeation chromatography,HPGPC)图上的保留时间也随之延长,该结果表明CVPs-1-G随着唾液消化时间的延长分子质量也随之降低。经唾液消化30 min后,CVPs-1-G的分子质量从原来的7.86 kDa降低到5.16 kDa。此外,随着唾液消化时间的延长,其还原糖含量也显著增高,从最开始的0.005 mg/mL上升到0.216 mg/mL。综上,CVPs-1-G在模拟唾液消化的过程中,结构可能发生了变化。
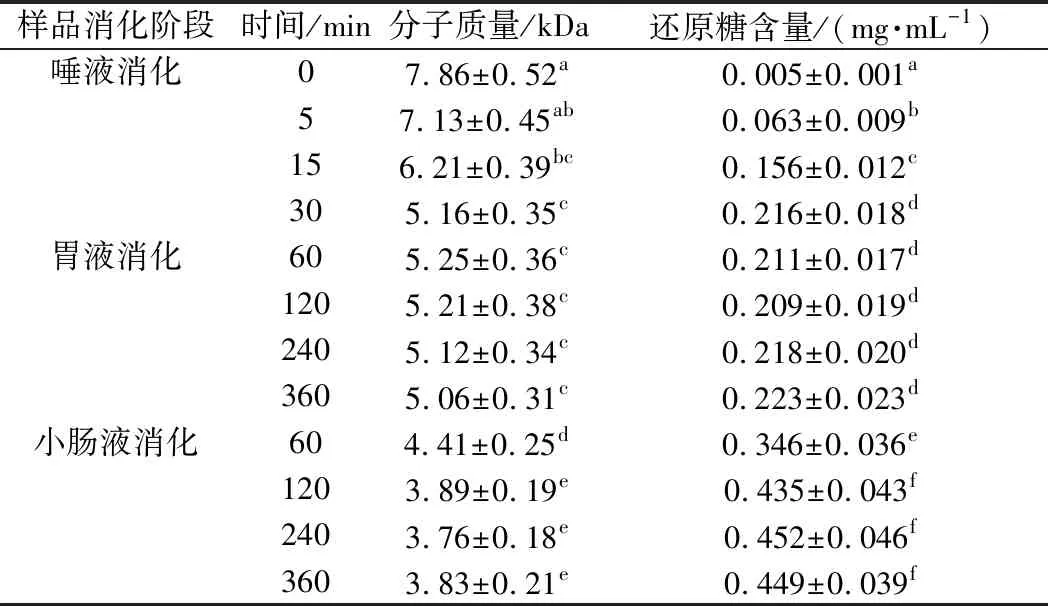
表1 不同消化时间下CVPs-1-G的分子质量及还原糖含量Table 1 Molecular weight and reducing sugar content of CVPs-1-G under different digestion conditions
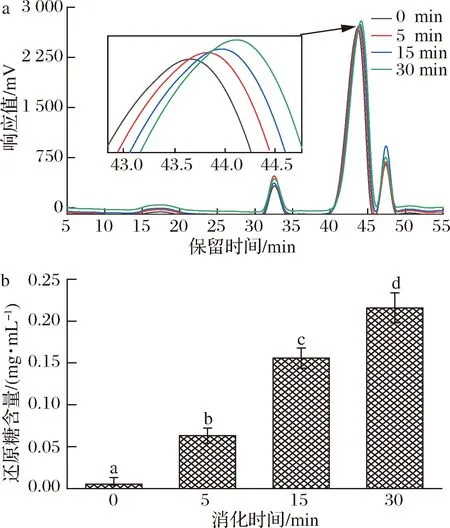
a-分子质量;b-还原糖生成量图2 CVPs-1-G在模拟唾液消化过程中分子质量及还原糖生成量Fig.2 Molecular weight of CVPs-1-G and the content of reducing sugar during simulated salivary digestion
2.2.2 CVPs-1-G在胃消化过程中的分子质量及还原糖生成量的变化
食物经唾液初步消化后被送入胃中,在胃酸的作用及胃的蠕动下被消化,而唾液淀粉酶在胃酸的作用下失活[27]。CVPs-1-G经唾液模拟消化30 min后进行胃液模拟消化,其分子质量及还原糖含量变化如表1和图3所示。随着模拟胃消化时间的延长,CVPs-1-G在HPGPC中的保留时间无明显变化,表1中的分子质量变化也无明显差异。此外,通过DNS法测得的各消化时间段的还原糖含量也无显著性差异。综上,CVPs-1-G在模拟胃消化阶段不会发生任何变化。
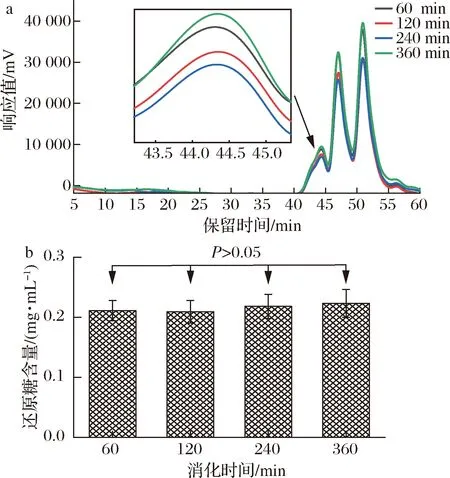
a-分子质量;b-还原糖生成量图3 CVPs-1-G在模拟胃消化过程中分子质量及还原糖生成量Fig.3 Molecular weight of CVPs-1-G and the content of reducing sugar during simulated gastric digestion
2.2.3 CVPs-1-G在小肠消化过程中的分子质量及还原糖生成量的变化
小肠是碳水化合物消化吸收的重要场所,探究CVPs-1-G在小肠中的变化显得很有必要。CVPs-1-G经唾液模拟消化30 min、胃消化6 h后进行小肠模拟消化如表1和图4所示,与小肠消化60 min的HPGPC图相比,小肠消化120 min的HPGPC图中CVPs-1-G的保留时间被延长。但随着小肠消化时间的延长,CVPs-1-G在HPGPC图上的保留时间无明显变化。与胃液消化360 min时CVPs-1-G的分子质量(5.06 kDa)相比,CVPs-1-G在小肠消化120 min以内的分子质量均显现出下降的趋势,于小肠消化120 min后达到稳定。其小肠消化360 min后的分子质量为3.93 kDa。此外,在小肠消化产物的还原糖含量上也表现出了相似的变化,小肠消化120 min后的消化产物的还原糖含量显著高于消化60 min后的消化产物。小肠消化120 min后,随着消化时间的延长,其还原糖含量未发生明显改变。其结果表明,CVPs-1-G在经唾液消化和胃消化后在小肠消化阶段会被部分降解后保持稳定。
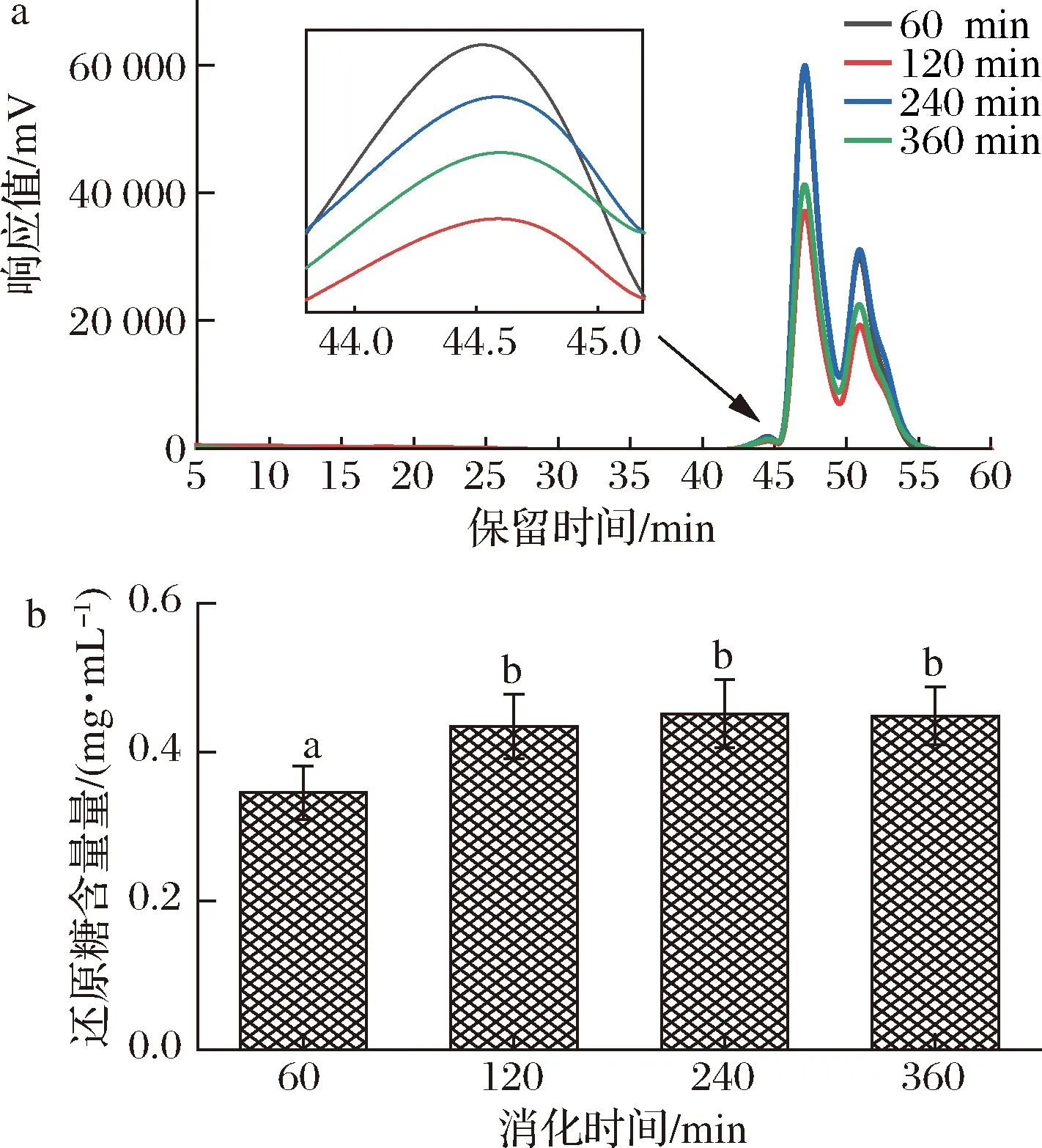
a-分子质量;b-还原糖生成量图4 CVPs-1-G在模拟小肠消化过程中分子质量及还原糖生成量Fig.4 Molecular weight of CVPs-1-G and the content of reducing sugar during simulated intestinal digestion
2.2.4 CVPs-1-G在模拟消化过程中的寡糖生成情况
采用电喷雾质谱(electrospray ionization-mass spectrometry,ESI-MS)测定经唾液消化30 min、胃消化6 h和小肠消化6 h后的消化产物中的寡糖。消化产物经透析膜(100 Da)透析除去小分子物质,再经Sevag法除蛋白质后进行ESI-MS分析。CVPs-1-G模拟消化产物的ESI-MS如图5所示,由于在消化的过程中使用大量的NaCl,使得产生的寡糖基本以[M+2 Na]+的形式存在。如图5所示,CVPs-1-G经模拟消化后主要产生了单糖、二糖、三糖、四糖及五糖,其中二糖含量最高,其次是四糖,五糖含量最低。由于模拟消化过程中的碳水化合物水解酶均只能水解α-1,4-糖苷键,并结合图1的CVPs-1-G的结构信息,推测模拟消化后产生的二糖为Glcp-α-1,4-Glcp(水解不完全形成的麦芽糖)和Glcp-α-1,6-Glcp。
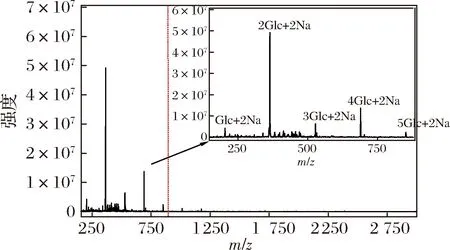
图5 CVPs-1-G经模拟消化后的ESI-MS图Fig.5 ESI-MS of CVPs-1-G after simulated digestion in vitro
2.3 CVPs-1-G在模拟消化产物对消化酶活性的影响
α-淀粉酶及脂肪酶主要在小肠消化阶段发挥作用,胃蛋白酶主要在胃消化阶段发生作用,故仅需考察CVPs-1-G的小肠消化产物对α-淀粉酶和脂肪酶活性的影响,胃消化产物对胃蛋白酶抑制活性的影响。如图6所示,与CVPs-1-G相比,CVPs-1-G消化产物的α-淀粉酶、脂肪酶及胃蛋白酶抑制活性的IC50值均有显著降低(P<0.05),其结果表明CVPs-1-G经模拟消化后其α-淀粉酶、脂肪酶和胃蛋白酶抑制活性均有一定程度的增强。
采用皮尔逊相关性分析考察CVPs-1-G消化产物与消化酶抑制活性之间的关系,结果如表2所示。CVPs-1-G消化产物的α-淀粉酶抑制活性、脂肪酶抑制活性和胃蛋白酶抑制活性与其分子质量大小显著负相关,与其还原糖生成量显著正相关。其结果表明,CVPS-1-G的消化产物对α-淀粉酶、脂肪酶和胃蛋白酶的抑制活性随着其分子质量的降低和还原糖含量的升高而升高。
2.4 分子对接结果分析
根据寡糖分析的结果,采用分子对接考察CVPs-1-G消化产物中的寡糖对消化酶活性的影响。各二糖分子(Glcp-α-1,4-Glcp和Glcp-α-1,6-Glcp)与α-淀粉酶、脂肪酶和胃蛋白酶的分子对接结合自由能结果如表3所示,各二糖分子与α-淀粉酶、脂肪酶和胃蛋白酶的结合自由能均<-5 kJ/mol,表明各二糖分子与α-淀粉酶、脂肪酶和胃蛋白酶间具有较好的结合能力[28]。此外,在可能产生的这3种二糖分子中,Glcp-α-1,6-Glcp与α-淀粉酶、脂肪酶和胃蛋白酶的结合能力最强,表明该二糖分子可能具有更好的消化酶抑制活性。每个二糖分子与α-淀粉酶、脂肪酶和胃蛋白酶的具体结合情况采用Pymol软件进行可视化分析,结果如图7所示,每个二糖分子均能较好的通过氢键与α-淀粉酶、脂肪酶和胃蛋白酶结合在一起。

a-α-淀粉酶;b-脂肪酶;c-胃蛋白酶图6 CVPs-1-G消化产物的α-淀粉酶、脂肪酶及胃蛋白酶抑制活性的IC50Fig.6 The IC50 of CVPs-1-G digestion products on α-amylase,lipase and pepsin inhibitory activities
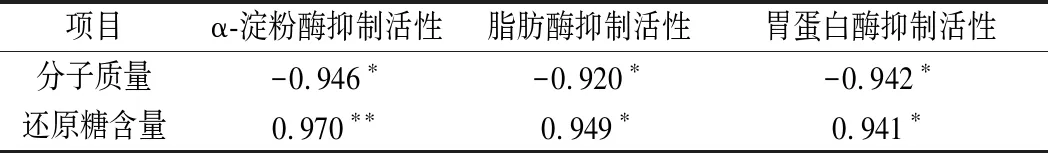
表2 CVPs-1-G消化产物的分子质量及还原糖生成量与α-淀粉酶、脂肪酶及胃蛋白酶抑制活性的皮尔逊相关性分析Table 2 Pearson correlation analysis of molecular weight and reducing sugar content of CVPs-1-G digestive products with α-amylase,lipase and pepsin inhibitory activities

表3 二糖组分与消化酶的分子对接结合自由能Table 3 Chemical shifts and coupling constant of residue A-G
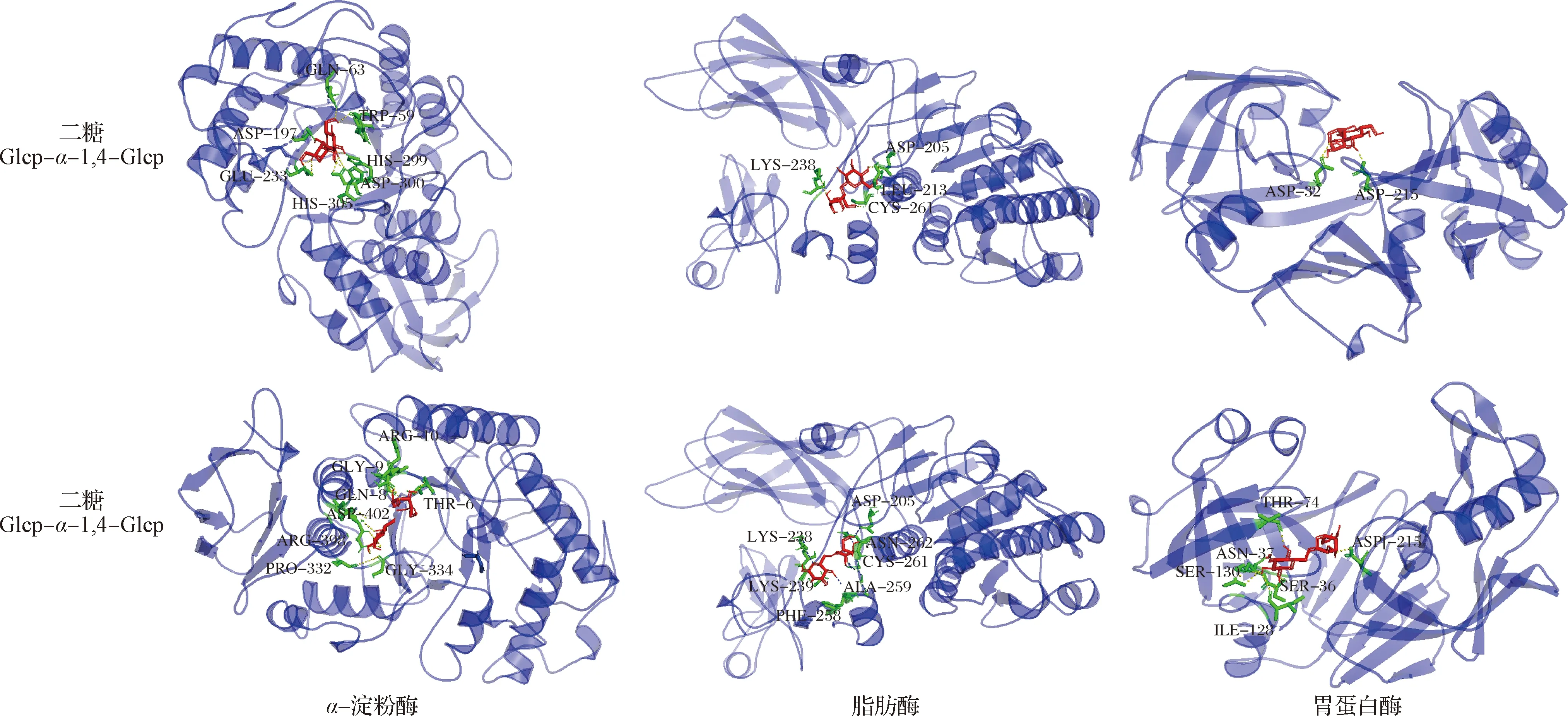
图7 二糖分子与消化酶的分子对接Fig.7 Molecular docking of disaccharides with digestive enzymes
3 结论
本文以川明参为原料,采用超声辅助水提醇沉法提取CVPs,经纤维素柱层析和凝胶柱层析分离纯化得到CVPs-1-G。采用体外模拟实验结合凝胶渗透色谱和质谱探究CVPs-1-G在模拟消化过程中的结构变化及寡糖生成情况,并测定各阶段消化产物对α-淀粉酶、脂肪酶和胃蛋白酶抑制活性的影响。此外,采用分子对接技术探究CVPs-1-G消化后生成的寡糖对消化酶活性的影响。结果表明,CVPs-1-G在唾液消化阶段与小肠液消化阶段中存在一定降解,在胃消化阶段较为稳定,经模拟消化后,主要产生的寡糖为二糖。此外,CVPs-1-G经模拟消化后,其α-淀粉酶、脂肪酶和胃蛋白酶抑制活性均有显著增加,其α-淀粉酶、脂肪酶和胃蛋白酶抑制活性与其分子质量及还原糖生成量显著相关。此外,分子对接结果显示,CVPs-1-G经模拟消化后生成的二糖分子与α-淀粉酶、脂肪酶和胃蛋白酶的结合自由能均小于-5 kJ/mol,表明该二糖分子与α-淀粉酶、脂肪酶和胃蛋白酶均具有较好的结合能力。

