短发夹RNA沉默HIPK2对口腔鳞癌SCC-25细胞株增殖、自噬和裸鼠移植瘤生长的影响*
李森森,杨再波△,朱 彬,童国勇,张宏谧
(1.湖北恩施土家族苗族自治州中心医院口腔诊疗中心,恩施 445000;2.湖北民族大学附属民大医院口腔科,恩施 445000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是常见的恶性肿瘤,占所有头颈鳞状细胞癌(HNSCC)病例的40%,通常表现为侵略性行为,经常导致局部浸润和早期淋巴结转移[1]。大多数OSCC 患者在诊断时处于晚期临床阶段,由于手术难以根治并且预后较差,OSCC 的5 年生存率<50%[2]。约25%~50%的患者在治疗后会出现局部复发和远处转移[3]。因此,寻找可靠的生物标志物和新的分子靶点对于开发和实施OSCC患者的精准个性化治疗至关重要。
同源结构域相互作用蛋白激酶2(homeodomain-interacting protein kinase 2,HIPK2)属于丝/苏氨酸蛋白激酶家族成员,通过参与调控基因表达对细胞周期、凋亡及衰老具有调控作用[4]。相关研究表明,HIPK2可作为抑癌基因,抑制乳腺癌、卵巢癌和胰腺癌等肿瘤的发生和发展,或表达上调发挥促癌作用[5-7]。HIPK2 在OSCC 中表达升高,且以仅胞质阳性表达为主,与OSCC 的密预后密切相关[8]。但HIPK2 对OSCC 的具体作用机制尚未见相关报道,因此,本文通过构建HIPK2 短发夹RNA 沉默HIPK2 表达,探究其对OSCC 细胞SCC-25 生长、自噬及裸鼠移植瘤生长的影响。
1 材料和方法
1.1 实验试剂
DMEM 培养基、胎牛血清、青—链霉素和胰蛋白酶购自美国Gibco公司;人舌磷癌细胞SCC-25购自中国科学院典型培养物保藏委员会细胞库;BCA蛋白浓度测定试剂盒、辣根过氧化物酶标记山羊抗兔IgG 购 自Thermo Fisher;一 抗HIPK2、c-Myc、Bax、Bcl-2、Caspase-3、Bcelin1、ATG7、LC3Ⅰ/LC3Ⅱ和Actin购自英国Abcam公司。
1.2 细胞培养
SCC-25 细胞置于37 ℃、5%CO2恒温培养箱中用高糖DMEM培养基(含10%胎牛血清和1%青—链霉素)培养,每3 d更换1次培养基,收集细胞时用0.25%胰蛋白酶消化,试验选用对数生长期细胞。
1.3 细胞处理及分组
设计两对shRNA序列(HIPK2-shRNA1、HIPK2-shRNA2)干扰HIPK2 表达,取对数生长期SCC-25细胞,将细胞随机分为4组:Control组、shRNA-NC 组、HIPK2-shRNA1 组 和HIPK2-shRNA2组。Control 组不做处理,shRNA-NC 组转染shRNA-NC 阴性对照载体,HIPK2-shRNA1 组转染HIPK2-shRNA1 慢病毒载体,HIPK2-shRNA2 组转染HIPK2-shRNA2慢病毒载体。
1.4 实时荧光定量PCR(RT-qPCR)检测HIPK2 mRNA水平
用Trizol法从SCC-25细胞中提取总RNA,采用PrimeScrip反转录试剂盒进行反转录成cDNA,通过SYBR Premix Ex Taq说明书配置PCR反应体系,反应条件为:95 ℃30 s,95 ℃10 s,60 ℃30 s,35 个循环。以Actin为内参基因,用2-△△CT计算各目的基因相对表达量。引物序列:HIPK2-shRNA1 上游引物为5'-TGACCACTGTCCACAACCAGCCCTCAG-3',下游引物为5'-TCGCACCGAGTAGCCAGCGTGC-3';HIPK2-shRNA2 上游引物为5'-AGGAAGAGTAAGCAGCACCAG-3',下游引物为5'-TGCTGATGGTGATGACACTGA-3';Actin上游引物为5'-CGATGCCCTGAGGCTCTTT-3',下游引物为5'-TAGTTTCATGGATGCCACAGGAT-3’。
1.5 克隆形成实验检测细胞增殖
将SCC-25 细胞接种至6 孔板,约500 个细胞每孔,按方法“1.3项”进行处理及分组,培养7 d后弃掉上清液,4%多聚甲醛固定20 min,0.1%结晶紫染色15 min,洗净干燥后于显微镜下观察克隆形成数目,计算克隆形成率。细胞克隆形成率(%)=细胞克隆总数/接种细胞数×100%。
1.6 流式细胞仪检测细胞凋亡
取对数生长期细胞SCC-25细胞接种于6孔板,按方法“1.3 项”分组处理,胰酶消化吸收后,PBS 洗涤2 次,加入500 μL 缓冲液悬浮细胞,再加入5 μL磷脂酰丝氨酸蛋白混匀,最后加入碘化丙啶10 μL室温避光反应20 min 通过流式细胞仪检测各组细胞凋亡。
1.7 Western blotting 检测HIPK2、c-Myc、Bax、Bcl-2、Caspase-3、Bcelin1、ATG7、LC3Ⅰ和LC3Ⅱ蛋白表达
各组细胞加入含蛋白酶抑制剂的细胞裂解液提取总蛋白,BCA 法测定蛋白含量。SDS-PAGE 凝胶电泳分离蛋白转移至PVDF 膜。4 ℃下加入HIPK2、c-Myc、Bax、Bcl-2、Caspase-3、Bcelin1、ATG7、LC3Ⅰ和LC3Ⅱ一抗(1∶1 000)孵育过夜,TBST清洗后加入HRP-IgG(1∶10 000),加入电化学发光显色液显色。以GAPDH 为内参,ImageJ 软件分析各组细胞目的蛋白与GAPDH比值。
1.8 裸鼠移植瘤模型的建立
20 只雄性Balb/c 裸鼠购自武汉大学动物实验中心,5 周龄,体重(20±2)g,许可证号:SCXK(鄂)2019—0004,在特定的无病原体条件下饲养。将裸鼠随机分为两组:Control 组和HIPK2-shRNA2 组,取方法“1.3 项”处理后的Control 组和HIPK2-shRNA2 组处于对数生长期的SCC-25 细胞,分别注射于裸鼠后背部靠近腋窝处皮下(1×107个/mL,0.2 mL/只)。达成瘤标准(瘤径≥0.5 cm)进行后续实验。处死所有裸鼠,称取肿瘤重量,TUNEL 染色检测细胞凋亡,免疫组化检测Caspase-3 阳性表达率,western blotting检测LC3Ⅰ、LC3Ⅱ蛋白表达水平。
1.9 TUNEL染色
将裸鼠肿瘤组织切片用二甲苯浸洗2 次脱蜡,每次5 min,梯度乙醇(100%、95%、90%、80%、70%)各浸洗1 次,每次3 min。参照TUNEL 凋亡试剂盒说明书,用蛋白酶K 工作液在37 ℃下封闭20 min,PBS 清洗2 次。在每个切片样本上加入TUNEL 反应液50 μL,37 ℃闭光反应60 min。用DAPI 复染10 min后荧光显微镜下观察。
1.10 免疫组化测定察Caspase-3蛋白的表达情况
取各组裸鼠肿瘤组织,常规石蜡包埋制成厚度约4 μm的切片,按免疫组化检测试剂盒说明书进行免疫组化染色,阳性表达为细胞质出现棕黄色颗粒,采用光学显微镜观察Caspase-3在肿瘤组织中的表达情况。
1.11 统计学方法
采用GraphPad Prism 9 软件对数据进行统计分析,计量资料采用均数±标准差()表示,组间比较采用t检验,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组HIPK2 mRNA和蛋白表达水平
与Control 组比较,HIPK2-shRNA1 组、HIPK2-shRNA2组HIPK2 mRNA水平和蛋白表达水平均明显降低(P<0.05),见图1。
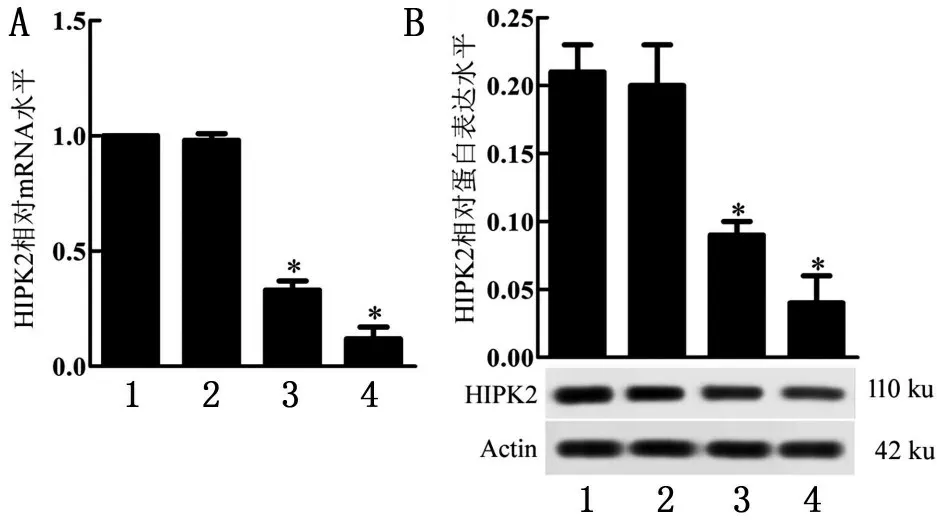
图1 HIPK2 mRNA水平和蛋白表达水平
2.2 HIPK2 短发夹RNA 对SCC-25 细胞克隆形成率的影响
与Control 组比较,HIPK2-shRNA1 组、HIPK2-shRNA2 组细胞克隆形成率明显降低,差异均有统计学意义(P<0.05),见图2。

图2 HIPK2短发夹RNA对SCC-25细胞克隆形成率的影响
2.3 HIPK2 短发夹RNA 对SCC-25 细胞凋亡率的影响
与Control组比较,HIPK2-shRNA1、HIPK2-shRNA2 组细胞凋亡率明显升高,差异均有统计学意义(P<0.05),见图3。

图3 HIPK2短发夹RNA对SCC-25细胞凋亡率的影响
2.4 HIPK2 短发夹RNA 对SCC-25 细c-Myc、Bax、Bcl-2、Caspase-3蛋白表达的影响
与Control组比较,HIPK2-shRNA1、HIPK2-shRNA2 组c-Myc 蛋白表达明显降低,cleaved Caspase-3/Caspase-3、Bax/Bcl-2 比值显著升高(P<0.05),见图4。

图4 HIPK2短发夹RNA对SCC-25细c-Myc、Bax、Bcl-2、Caspase-3蛋白表达的影响
2.5 HIPK2短发夹RNA 对SCC-25细胞Bcelin1、ATG7、LC3Ⅰ、LC3Ⅱ蛋白表达的影响
与Control 组比较,HIPK2-shRNA1 组、HIPK2-shRNA2 组Bcelin1、ATG7 蛋白表达水平和LC3Ⅱ/LC3Ⅰ比值显著升高,差异均有统计学意义(P<0.05),见图5。

图5 HIPK2短发夹RNA对SCC-25细胞Bcelin1、ATG7、LC3Ⅰ、LC3Ⅱ蛋白表达的影响
2.6 HIPK2短发夹RNA 对口腔鳞状细胞癌裸鼠移植瘤模型的影响
与Control 组比较,HIPK2-shRNA2 组裸鼠肿瘤重量降低,Caspase-3阳性细胞数、细胞凋亡率、LC3Ⅱ/LC3Ⅰ比值明显升高(P<0.05),见图6。
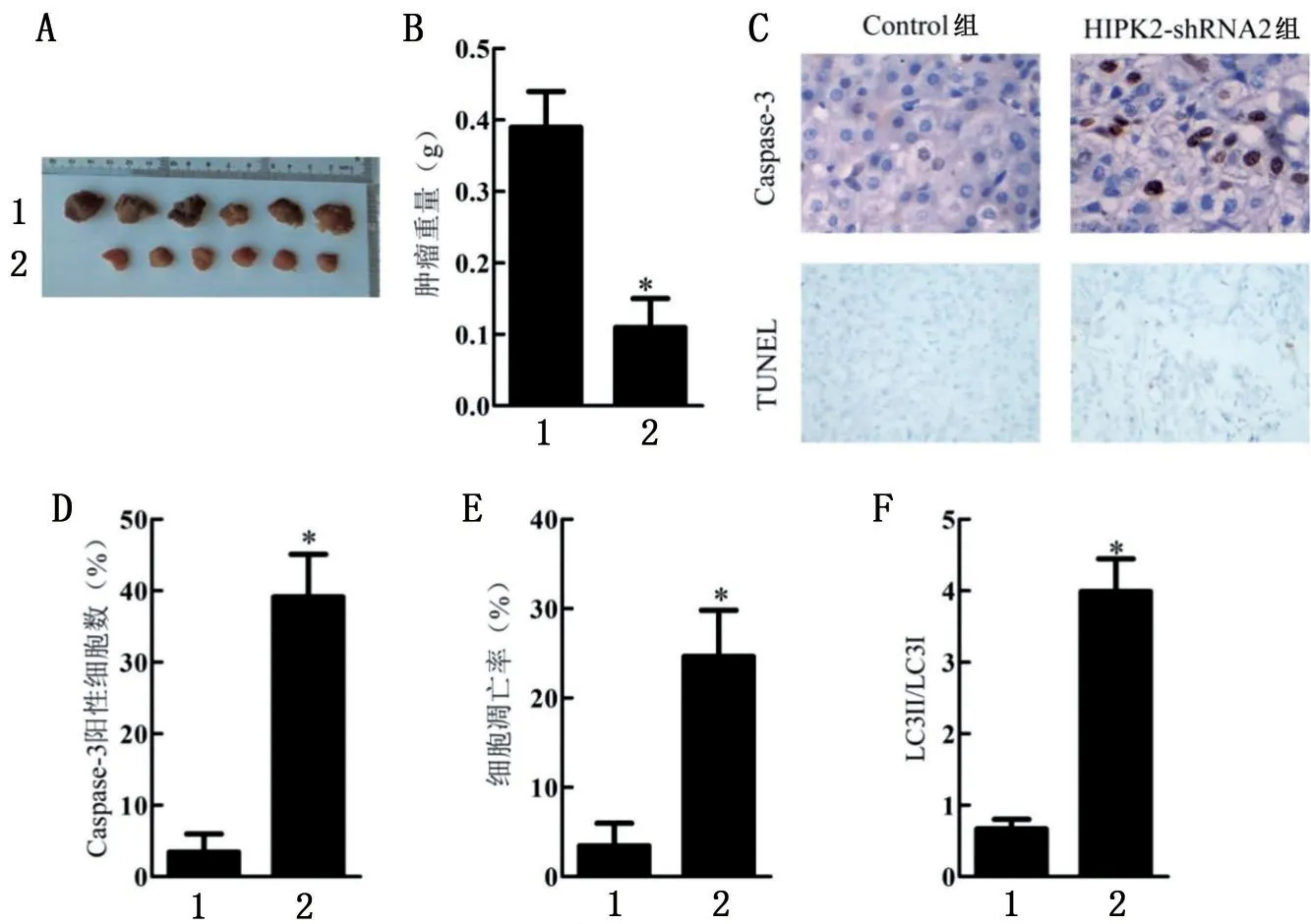
图6 HIPK2短发夹RNA对口腔鳞状细胞癌裸鼠移植瘤模型的影响
3 讨论
OSCC发病机制复杂,涉及多种遗传因素、生活方式和代谢风险,但其具体分子机制尚不明确。因此,需要探索新的分子治疗靶点,并通过更好地阐明分子机制和功能意义来发现OSCC有效的治疗方式。
增殖能力的增强及凋亡的减弱是肿瘤细胞重要的生物学特征,也是肿瘤发生发展的重要生物学基础[9]。抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡是治疗OSCC 的有效手段。c-Myc 为原癌基因,可介导肿瘤细胞无限增殖,促进肿瘤细胞凋亡,相关研究表明,c-Myc高表达可促进OSCC的发生[10]。与细胞凋亡相关的基因Bax 升高能够诱导细胞凋亡,Bcl-2 是细胞凋亡的抑制剂,Bax/Bcl-2 比值能反应细胞凋亡状况[11]。细胞中的Caspase-3一般无活性,以procaspase-3 形式存在,其活化后剪切下游分子,进而诱导细胞凋亡[12]。Cheng等[13]研究发现,HIPK-2 表达降低可一起宫颈癌细胞凋亡增加,增殖减少。Puca 等[14]研究发现,HIPK2 可通过激活p53 抑癌基因细胞凋亡活性,从而促进乳腺癌细胞凋亡。本文研究表明,短发夹RNA沉默HIPK2表达可升高SCC-25 细胞凋亡率,可降低SCC-25 细胞克隆形成率,降低裸鼠移植瘤肿瘤重量,降低c-Myc蛋白表达水平,升高cleaved Caspase-3/Caspase-3、Bax/Bcl-2比值,升高裸鼠移植瘤肿瘤细胞Caspase-3阳性细胞数和细胞凋亡率。提示HIPK2 短发夹RNA 可抑制SCC-25细胞增殖和裸鼠移植瘤肿瘤的生长,并诱导SCC-25细胞和裸鼠移植瘤肿瘤细胞凋亡。
自噬在肿瘤的发生发展中具有促进和抑制的双重作用[15]。Beclin1基因,位于染色体17q21上,可作为抑癌基因参与大部分恶性肿瘤的发生发展,相关研究表明,Beclin1在口腔鳞癌组织中的阳性表达率显著低于癌旁组织,与肿瘤分化及淋巴结转移有关[16]。ATG7是自噬调节的重要蛋白,可通过调节多种酶的活性从而激活细胞的自噬及凋亡过程[17]。自噬蛋白LC3 可分为LC3-Ⅰ和LC3-Ⅱ两种,LC3-Ⅱ定位在双层膜和自噬体上,是自噬体的特异性标志分子,LC3Ⅱ/LC3Ⅰ的比值与自噬泡的数量呈正相关,其比值大小是判定自噬水平的高低的依据[18]。本研究发现,HIPK2 短发夹RNA 具有升高SCC-25细胞Bcelin1、ATG7 蛋白表达水平和LC3Ⅱ/LC3Ⅰ比值,升高裸鼠移植瘤肿瘤细胞LC3Ⅱ/LC3Ⅰ比值。提示HIPK2短发夹RNA可诱导并激活SCC-25细胞和裸鼠移植瘤肿瘤细胞自噬,促进肿瘤细胞凋亡。
综上所述,HIPK2 短发夹RNA 可抑制SCC-25细胞增殖,诱导细胞凋亡和自噬,抑制裸鼠移植瘤模型移植瘤的生长。HIPK2有望成为治疗OSCC的新靶点。

