经导管主动脉瓣置换术后永久起搏器植入预测因子及预后分析
张佳琪 池程伟 刘吉义 赵维龙 孟庆涛 王丽丹 孙凤志 张树龙 刘继红
主动脉瓣狭窄是最常见的获得性心脏瓣膜疾病[1]。对于处于中高手术风险的重度主动脉瓣狭窄患者而言,经导管主动脉瓣置换术(transcatheter aortic valve replacement, TAVR)被证实是最有效的治疗方法之一[2-4]。我国自2010年起开展TAVR,据统计已经有超过7 000例患者在100多家中心接受了手术治疗。TAVR手术可以减轻左室质量、心脏负荷,改善左室功能,且手术创伤小、手术时间短、术后恢复快,因此较外科手术的有效性、安全性更高,心脏血流动力学也会明显改善[5]。
目前自膨式、机械可膨胀式和球囊可膨胀式的人工主动脉瓣膜广泛应用于TAVR中,而在我国,大多数TAVR患者采用自膨式人工主动脉瓣膜。随着新一代瓣膜的出现和手术术式的不断发展,TAVR术后传导阻滞,二次心脏瓣膜植入、瓣周漏以及血管并发症已经明显减少,但心电图提示的高度房室阻滞所致的永久起搏器植入仍是TAVR术后最常见的并发症之一[6]。超声心动图对观察和评估术前术后心脏形态及心功能改善尤为重要。本研究通过比较TAVR术前、术后及术后1个月心电图的变化,分析TAVR患者术后因传导障碍致永久起搏器植入的预测因子,并且通过比较超声心动图的变化,研究TAVR术后患者的预后。
1 资料与方法
1.1 一般资料
入选2019年1月至2021年6月在大连大学附属中山医院心脏中心因严重主动脉瓣狭窄接受TAVR的38例患者。纳入标准:① 符合重度主动脉瓣狭窄的诊断标准;② 经多学科医生小组(由心外科医生、心内科医生、心脏超声医生及麻醉医师组成)确认其无外科手术禁忌证。排除标准:① 合并其他系统疾病且预期寿命短于1年;② 既往行主动脉瓣置换术的患者;③ 左室射血分数(left ventricular ejection fraction,LVEF)<20%;④ 术前植入永久起搏器的患者。
本研究通过大连大学附属中山医院伦理委员会审核,并符合《赫尔辛基宣言》。所有参与此项研究的患者均已签署知情同意书。
1.2 观察指标
根据TAVR术后1个月内是否植入永久起搏器,将38例患者分为起搏器组(8例)与非起搏器组(30例),并分析永久起搏器植入的预测因子。根据左室收缩功能是否降低,将患者分为LVEF<50%组(15例)和LVEF≥ 50%组(23例),并分析2组TAVR的预后。
1.2.1 心电图参数 收集所有患者在术前、术后及术后1个月随访时的标准12导联心电图。心电图记录采用标准校准法(10 mm=1 mV,25 mm/s)。对所有接受TAVR的患者心电图进行了前瞻性分析,分析参数包括心率、心律、电轴、PR间期、房室阻滞的类型、QRS间期、束支阻滞的类型、QT间期及校正的QT间期(QTc)等。所有分析均按照心电图标准化判读方法进行。
1.2.2 心脏彩超参数 所有患者在术前、术后及术后1个月随访时接受超声心动图检查。收集平均主动脉压差(mean pressure gradient,MPG)、主动脉瓣瓣口面积(aortic valve area,AVA)、LVEF和左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)等指标。
1.3 统计学方法

2 基线资料
2.1 总研究人群的基线资料
入选的38例患者平均(74.92±8.67)岁,男性占55.3%。近71%的患者有严重主动脉瓣狭窄(中高手术风险),NYHA分级Ⅲ、Ⅳ级。术前患者MPG (50.82±20.95)mmHg,平均AVA (0.66±0.23)cm2,平均LVEF (51.79±13.19)%,平均LVEDD (52.21±9.81)mm,平均左室后壁厚度(left ventricular posterior wall thickness,LVPWT)(12.63±2.16)mm,平均左室间隔厚度(left interventricular septum thickness,LIVST)(13.53±2.77)mm。患者的美国胸外科医师协会死亡率(STS mortality)平均得分(3.21±2.84)分,欧洲心外科手术评分第2版(EuroScore Ⅱ)平均得分(8.06±8.62)分,美国胸外科医师协会发病率及死亡率(STS morbimortality)平均得分(15.51±8.02)分。37例患者经股动脉途径置入自膨式主动脉瓣膜,1例患者经心尖途径置入自膨式主动脉瓣膜。
2.2 起搏器组和非起搏器组基线资料比较
通过比较起搏器组和非起搏器组的基线特征,发现起搏器组患者的血脂异常发生率更高、肌酐清除率更低,术前STS morbimortality评分更高,且差异有统计学意义(P<0.05)。见表1。
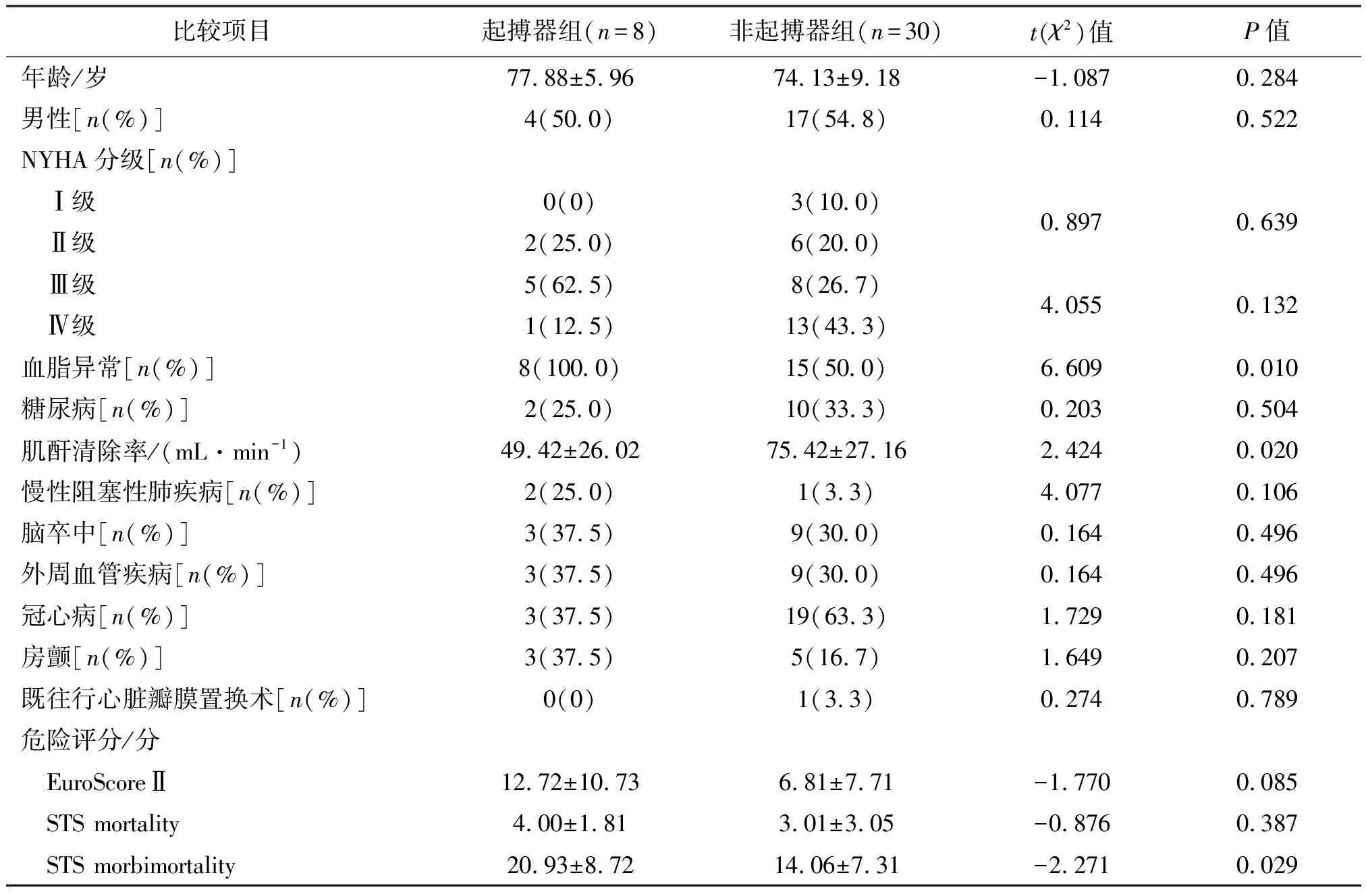
表1 起搏器组和非起搏器组基线特征比较
本研究中,TAVR术后永久起搏器植入最常见的适应证是三度房室阻滞(62.5%),其次为病态窦房结综合征(37.5%)。TAVR术后1个月内行永久起搏器植入术的患者占21.1%。
2.3 起搏器组和非起搏器组术前超声心动图与心电图参数比较
起搏器组与非起搏器组术前超声心动图基线资料比较,MPG差异有统计学意义(P<0.05),其余差异无统计学意义(P>0.05)。起搏器组术前Ⅰ导联T波振幅显著大于非起搏器组[(0.10±0.17) mVvs.(-0.07±0.19) mV,P=0.031]。见表2。

表2 起搏器组和非起搏器组术前超声心动图与心电图参数比较
3 各组术后心电图及超声心动图参数变化
3.1 起搏器组和非起搏器组新发心电传导障碍比较
比较2组患者中新发的房颤、一度房室阻滞、右束支阻滞、左前分支阻滞等心电传导障碍的发生率,差异无统计学意义(P>0.05);起搏器组患者中新发左束支阻滞的发生率显著高于非起搏器组(75.0%vs.16.7%,P=0.004)。见表3。
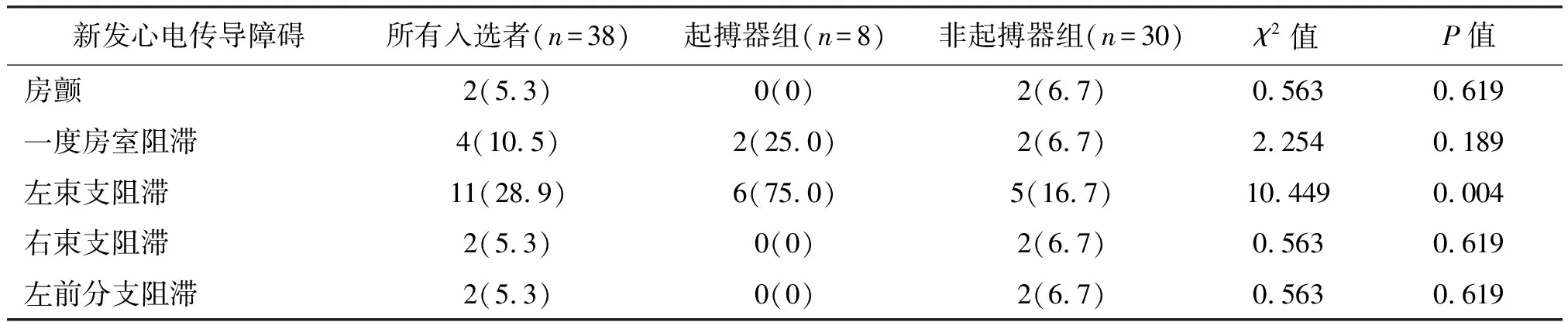
表3 起搏器组和非起搏器组术后新发心电传导障碍比较 n(%)
3.2 经导管主动脉瓣置换术后超声心动图参数比较
比较患者TAVR术前、术后和术后1个月的超声心动图参数,发现主动脉根部内径(aortic root dimension,ARD)的差异无统计学意义(P>0.05);MPG、AVA、AVA/体表面积(body surface area,BSA)在术后及术后1个月均显著改善(P<0.01)。术后、术后1个月LVPWT较术前均明显改善(P<0.05)。LVEF、LVEDD与LIVST在术后1个月明显改善(P<0.05),而术后较术前差异无统计学意义(P>0.05)。见表4。
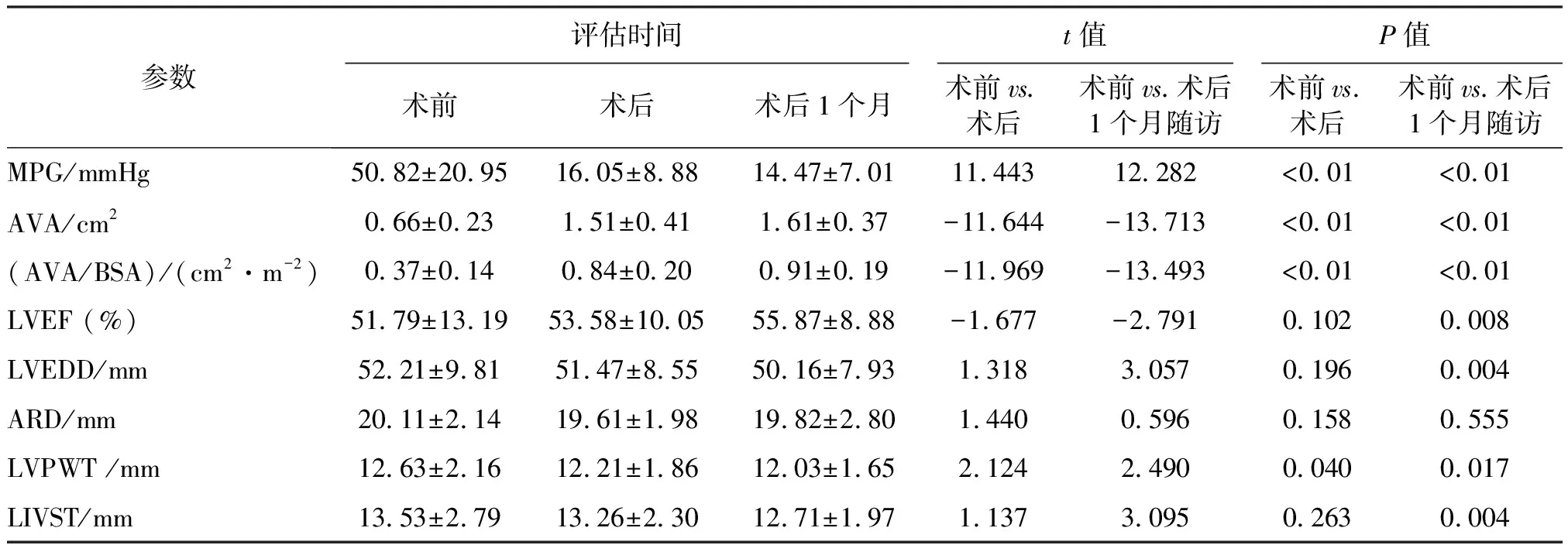
表4 术前、术后及术后1个月超声心动图参数比较
3.3 LVEF<50%组和LVEF≥ 50%组超声心动图参数比较
LVEF<50%组LVEDD术前与术后、术后1个月随访时比较,差异无统计学意义(P>0.05);术后及术后1个月的MPG、AVA、AVA/BSA均较术前显著改善(P<0.01);LVEF术后及术后1个月均较术前明显改善(P<0.01)。见表5。LVEF≥50%组ARD、LVEF术前与术后、术后1个月随访时比较,差异均无统计学意义(P>0.05);术后及术后1个月MPG、AVA、 AVA/BSA较术前均显著改善(P<0.01);LVEDD、LVPWT、 LIVST在术后1个月明显改善(P<0.05),而术后较术前差异无统计学意义(P>0.05)。见表6。

表5 LVEF<50%组术前、术后及术后1个月超声心动图参数比较
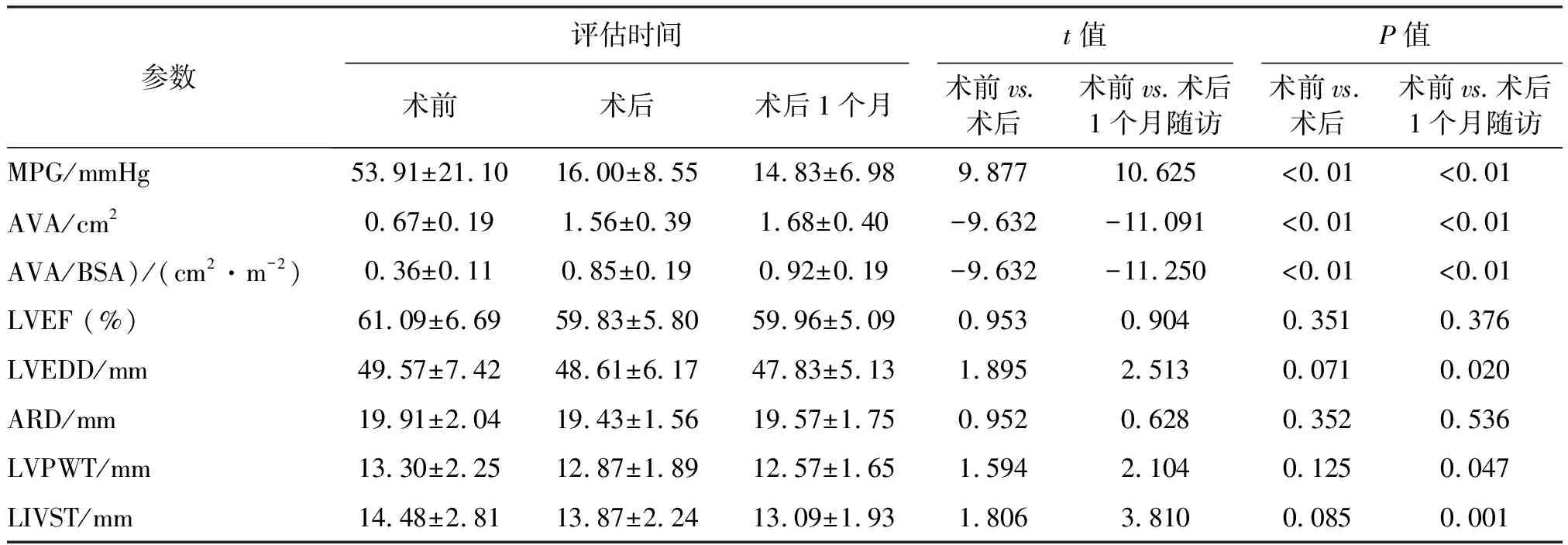
表6 LVEF≥ 50%组术前、术后及术后1个月超声心动图参数比较
为了分析接受TAVR的患者术后永久起搏器植入的预测因素,纳入血脂异常、肌酐清除率、EuroScore Ⅱ评分、STS morbimortality评分、MPG、Ⅰ导联T波振幅、新发左束支阻滞及术前右束支阻滞等变量,进行Firth’s校正的多元Logistic回归分析。应用Backward法剔除多余变量,最终模型中仅保留3个变量(图1)。TAVR术后永久起搏器植入的主要独立预测因子是新发左束支阻滞(Coef3.170,95%CI0.853~7.447,P=0.005)和Ⅰ导联T波振幅(Coef10.894,95%CI1.478~28.012,P=0.018)。在其余的变量中没有发现显著的统计学差异。

虚线右边的变量是永久起搏器植入的预测因子。
4 讨论
4.1 起搏器植入的适应证
本研究表明,TAVR术后永久起搏器植入的最常见指征是三度房室阻滞(62.5%),与既往研究结果一致[7-8]。病态窦房结综合征(37.5%),包括窦房阻滞及有症状的窦性心动过缓,也是术后永久起搏器植入的适应证之一,与Gaede等[9]的研究结果一致。
主动脉瓣与心脏传导系统的解剖学关系是术后发生传导阻滞的基础。房室结作为心脏传导系统的起源,位于科氏三角内;希氏束作为房室结的延伸,穿越中央纤维体,走行于膜间隔,产生左右束支及其分支。传导阻滞的发生机制为手术对房室结和(或)左束支造成直接的机械损伤,如缺血、血肿及水肿等[10-12]。因此,提高手术操作技巧也能在一定程度上减少术后高度房室阻滞的发生。
4.2 永久起搏器植入的高风险基线特征
TAVR术后永久起搏器植入高风险的患者中,可能存在某些异常的基线指标,其或许与术中潜在的传导系统损伤有关。Chen等[12]研究表明,中国人群中,术前存在右束支阻滞的患者在TAVR术后更易产生传导异常,且永久起搏器植入的发生率更高。本研究表明,TAVR术后传导异常可能与术前血脂异常、肌酐清除率较低有关;较高的基线STS morbimortality评分也提示术中传导系统的损伤。因此,强烈建议医生多关注TAVR术前异常的基线指标,以降低术后永久起搏器植入的发生率。
4.3 经导管主动脉瓣置换术后超声心动图的变化
有严重主动脉瓣狭窄和LVEF降低的患者经保守治疗,预后不佳[13]。TAVR能在一定程度上通过改善射血分数、心功能及心脏负荷而改善预后。既往研究表明,左室收缩功能低下的患者对术中的机械损伤造成的缺血、血肿、水肿尤为敏感[14]。本研究表明,MPG、AVA在TAVR术后获得改善;LVEF<50%组患者术后心脏收缩功能立即明显改善,而LVEF≥50%组LVEDD、LVPWT、LIVST在术后1个月才明显改善。Tzikas等[15]研究证实,高风险的重度主动脉瓣狭窄患者TAVR术后1年,左室壁发生显著的逆重构。Lindman等[16]研究发现,主动脉瓣重度狭窄伴严重左室肥厚患者TAVR术后1个月与术后1年,LVPWT均显著改善。因此,主动脉瓣重度狭窄患者可从TAVR中获益,心室重构及心脏收缩功能得到不同程度的改善。
4.4 经导管主动脉瓣置换术术后永久起搏器植入的预测因子
很少有研究评估TAVR术后新发左束支阻滞患者植入永久起搏器的风险,然而,本研究表明,术后新发左束支阻滞和术前较大的Ⅰ导联T波振幅是TAVR术后植入永久起搏器的有力预测因子。但也有研究指出,术前右束支阻滞是TAVR术后永久起搏器植入的预测因子[7,11,17-18]。本研究表明,TAVR术后植入永久起搏器与新发左束支阻滞呈正相关,但与术前右束支阻滞和一度房室阻滞无相关性。由此可推测,TAVR对于传导系统的机械损伤主要影响左束支,而预先存在的右束支阻滞可能形成术后三度房室阻滞。Ⅰ导联T波振幅是永久起搏器植入的预测因子,但其内在机制尚不清楚。此外,文献[19-22]中提及的预测因素,如植入瓣膜类型、瓣膜植入深度在本研究中也均未涉及。关于TAVR术后新发左束支阻滞的管理,至今尚未发布指南,因此,应当谨慎对待相关研究及建议,并进一步开展更深入的研究。
5 小结
本研究中,采用自膨式人工主动脉瓣膜的TAVR术后永久起搏器植入率为21.1%,TAVR术后早期心脏逆重构、心功能及射血分数均在不同程度上得到改善。肌酐清除率较低、存在血脂异常、STS morbimortality评分较高、Ⅰ导联T波振幅较大的患者,术后永久起搏器植入风险较高。新发左束支阻滞和术前较大的Ⅰ导联T波振幅是TAVR患者植入永久起搏器的主要预测因子。
本研究存在一定的局限性。首先,这是一项单中心小样本研究,使用了RV.3.2.2软件和Fisher精确概率检验对数据进行验证,以确保研究结论的可靠性。其次,仅分析术后1个月的随访数据,未能随访术后更长时间的预后。最后,未研究瓣膜植入深度、瓣膜类型等其他因素可能会对TAVR术后传导异常所产生的影响。未来我们将基于本研究成果开展多中心、前瞻性研究,并将瓣膜植入深度、瓣膜类型、手术入路等因素纳入研究,使之更加完善,也使更多患者受益。

