桃不同品种对低温胁迫的生理响应及评价
王召元 田启航 常瑞丰 刘国俭 陈 湖 李永红
(河北省农林科学院 昌黎果树研究所,河北 昌黎 066600)
低温是限制桃树生长发育的主要环境因子之一,在我国华北桃栽培区,冬季绝对低温低,导致桃树冻害现象经常发生,给当地桃产业带来了严重损失,选用抗寒桃品种是解决冻害的最有效途径之一[1]。因此,准确评价不同桃种质的抗寒能力,对种质资源的利用及优良抗寒品种的选育具有重要意义。
抗寒性是桃的一个重要性状,其评价方法已有不少报道,枝条电导法是比较常用的评价方法。通过测定不同温度处理下枝条的相对电导率(REC),拟合Logistic方程求解低温半致死温度(LT50),可以有效的反映桃品种的抗寒能力[2-4]。王小丽等[2]和赵秀梅等[3]利用此方法筛选出‘陇蜜9号’‘陇蜜12号’‘丁家坝青皮桃’‘夏至早红’等高抗寒种质,‘农神蟠桃’‘2010西藏17号’‘2010西藏54号’不抗寒种质。电阻抗法也是有效的抗寒性评价方法,张海旺等[5]研究认为,胞外电阻率和弛豫时间是鉴定桃枝条抗寒性的最佳参数,并鉴定出‘燕红’为高抗寒种质,‘中华寿桃’为不抗寒种质。赵雪辉等[6]和张立磊等[7]研究表明,可溶性糖与抗寒性相关性不显著,电解质渗出率、丙二醛、脯氨酸和可溶性蛋白等指标是桃抗寒性评价的敏感指标。然而桃的抗寒性受多种因素影响,并且不同品种对低温的响应存在差异,单独用某一生理指标难以客观评价抗寒性的强弱。目前,隶属函数法是果树抗寒性评价研究中普遍采用的方法之一,此方法是根据模糊数学原理,计算各构成指标相应的隶属函数值,进行加权得到其综合评估值,可较为全面的对考察对象进行综合评价,评价结果更加准确、客观[8]。目前这一方法已在苹果、核桃和葡萄等果树抗寒性评价中得到广泛应用[8-10]。
本研究通过测定12个桃品种在低温梯度处理条件下的相对电导率、渗透调节物质质量分数(可溶性糖、可溶性蛋白和脯氨酸)、丙二醛质量摩尔浓度和束缚水/自由水的变化,采用隶属函数法对其抗寒性进行综合评价,以期为桃抗寒种质创新以及品种的适宜种植区域划分提供科学依据。
1 材料与方法
1.1 试验材料
试验所用12个桃品种分别为‘承德1号’‘承德2号’‘金奥’‘秋燕’‘秋恋’‘03-22-034’‘02-13-140’‘03-49-079’‘晚蜜’‘庆丰’‘春雪’‘大久保’,定植于河北省农林科学院昌黎果树研究所桃资源圃,露地栽培。圃内土壤为沙壤土,土壤肥力中等,各桃品种以毛桃为砧木,采用2主枝开心形,株行距2 m×5 m,树龄11年,管理水平一致,选取1年生休眠枝条为试验材料。
1.2 试验处理
2019年1月12日,于树冠外围中部随机剪取长势相近、粗度一致的1年生枝条,取枝条样品中部枝段,用自来水洗净,去离子水冲洗3次,滤纸吸干表面水分,两端剪口封蜡。之后每品种随机选取15根枝条为一组,共计8组,装入聚乙烯自封袋中,分别置于GDJS-500L型高低温湿热交变试验箱(苏州市奥贝思环境试验设备有限公司)中进行低温处理,设置0 (CK)、-10、-15、-20、-25、-30、-35 和-40 ℃ 8个低温处理,每处理均以4 ℃/h降温速率降温至目的温度后保持12 h,之后以同样速率升温至0 ℃,保持2 h,后放入0 ℃冰箱中备用。各项指标测定前,需将冷冻枝条于室温(20 ℃)下放置8 h。每个处理3次重复,每个重复处理5根枝条。
1.3 测定指标及方法
1.3.1相对电导率的测定
相对电导率采用电导法测定[11]。将低温处理后的枝条避开芽眼剪成0.3 cm的小段,准确称取2 g,放入30 mL刻度试管中,加入去离子水25 mL,封口,在室温(20 ℃)下浸泡24 h,中间不断摇动试管,用DDS-11A 型电导率仪(上海仪电科学仪器股份有限公司)测定浸提液初始电导率(C1);然后封口,沸水浴30 min杀死组织,静置3~4 h后摇匀,再测定终电导率(C2),重复3次。相对电导率(REC)=C1/C2×100%。
1.3.2枝条萌芽率
枝条萌芽率采用恢复生长法调查[12]。将低温处理后的枝条,置于PR系列微电脑人工气候箱中(南京红龙仪器设备厂)水培培养(25 ℃,3 000 lx),每天换水1次,20 d后调查累计发芽数。待发芽数恒定后,计算萌芽率。萌芽率=萌芽数量/总芽数量×100%,重复3次,每次选取3根枝条。
1.3.3其他生理指标的测定
参照李合生[13]的方法测定各生理指标。丙二醛(MDA)质量摩尔浓度采用硫代巴比妥酸法测定,可溶性糖质量分数采用蒽酮法测定,脯氨酸质量分数采用酸性茚三酮法测定,可溶性蛋白质量分数采用考马斯亮蓝法测定,束缚水与自由水含量采用阿贝折光仪法测定。
1.4 数据处理和分析
试验数据利用Microsolft Excel 2007进行处理,利用SPSS 20.0进行相关性分析(双变量)和差异显著性分析(单因素ANOVA)。参照唐士勇[14]的方法计算低温半致死温度(LT50),将处理温度(x)和相对电导率(y)间的关系用Logistic方程进行拟合,拟合曲线方程为y=K/(1+ae-bx),其中K为相对电导率的饱和值,a、b为方程参数,求该方程的二阶导数并令其等于0,可获得方程曲线的拐点x=—ln(1/a)/b,x即为半致死温度。运用隶属函数法计算各抗寒指标隶属度[15],如果指标与抗寒性呈正相关,指标隶属度计算公式为:
Uij=(Xij-Xjmin)/(Xjmax-Xjmin)
(1)
如果指标与抗寒性呈负相关,指标隶属度计算公式为:
Uij=1-(Xij-Xjmin)/(Xjmax-Xjmin)
(2)
式中:Uij表示i品种j指标的抗寒隶属函数值;Xij表示i品种j指标的测定值;Xjmin表示j指标的最小值;Xjmax表示j指标的最大值。
2 结果与分析
2.1 不同低温处理对桃枝条相对电导率的影响
不同低温处理对桃枝条相对电导率的影响见图1。随着温度的降低,各品种枝条相对电导率均呈逐渐上升的趋势,整体变化呈“S”形曲线,但上升的速率存在差异。说明不同桃品种对低温胁迫响应一致,枝条相对电导率变化趋势出现明显拐点时所处的温度各不相同。

图1 不同低温处理下桃枝条相对电导率的变化Fig.1 Changes of relative elective conductivities of peach branches under different low-temperature treatment
利用Logistic方程结合相对电导率计算不同桃品种的LT50,可以直接反映枝条对低温的敏感和耐受程度,LT50越低,抗寒性越强[12]。由表1可见,各品种Logistic方程拟合的相关系数为0.767~0.865,均大于临界相关系数(r=0.707,α=0.05),拟合度较好,各品种LT50介于-24.30~-17.88 ℃。根据LT50得出12个桃品种抗寒性顺序为‘秋恋’>‘晚蜜’>‘秋燕’>‘承德2号’>‘大久保’>‘03-49-079’>‘承德1号’>‘庆丰’>‘02-13-140’>‘03-22-034’>‘春雪’>‘金奥’。将各品种相对电导率与LT50进行相关性分析,结果表明温度为-15、-25、-30和-40 ℃的处理,相对电导率与LT50极显著正相关,相关系数分别为0.735、0.789、0.821和0.850。
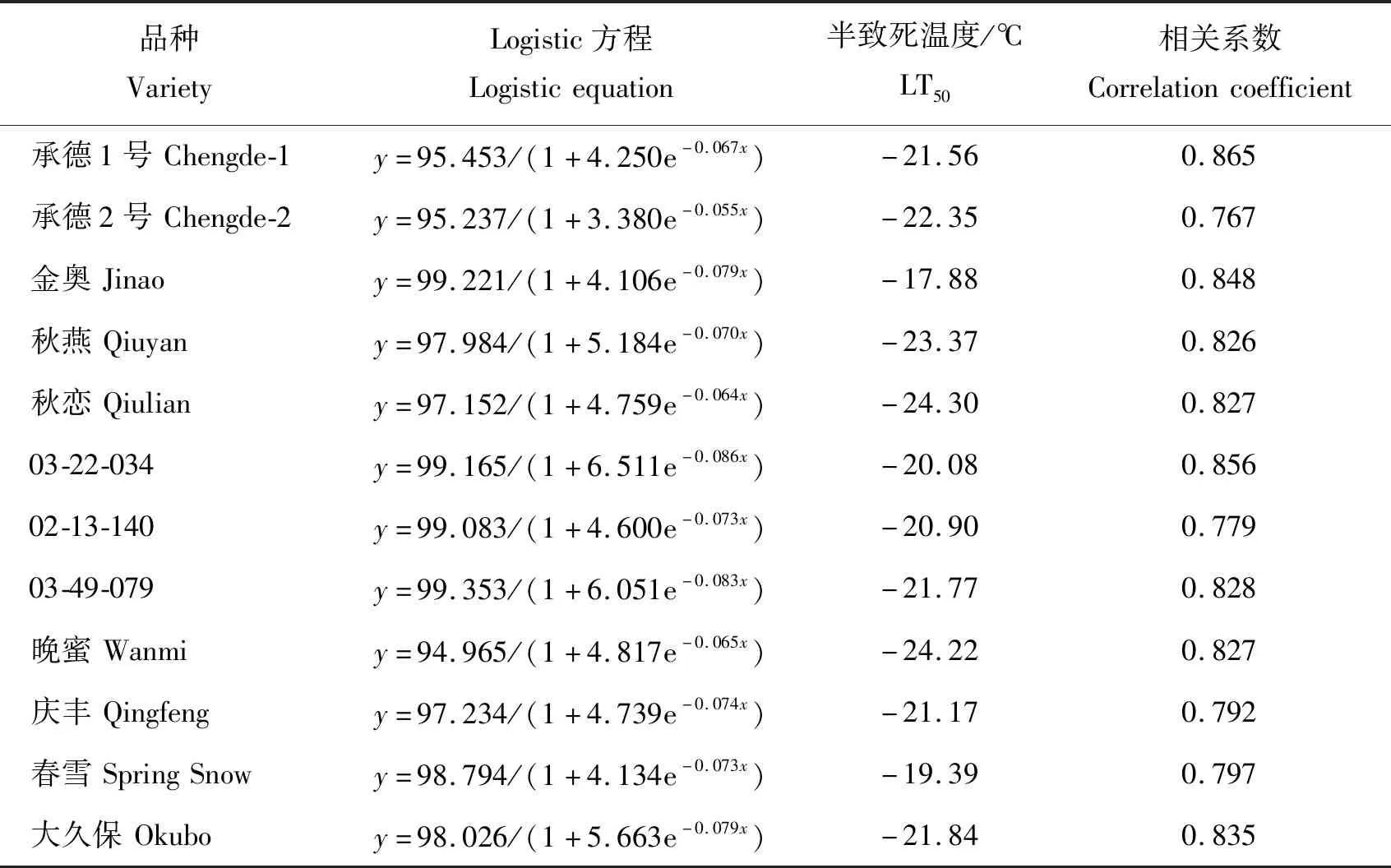
表1 12个桃品种Logistic方程及半致死温度Table 1 The Logistic equation and semilethal temperature (LT50)of 12 peach varieties
2.2 不同低温处理对桃枝条发芽率的影响
不同低温处理对桃枝条发芽率的影响见表2,各品种的发芽率随温度的降低呈下降趋势。当温度为-10 ℃时,‘春雪’‘金奥’‘03-22-034’‘03-49-079’‘02-13-140’发芽率首先出现下降;当温度降低到-20 ℃时,各品种的发芽率急剧下降,其中‘秋恋’‘春雪’‘金奥’与其他品种相比,枝条发芽率差异显著;当温度低于-30 ℃,各品种发芽率均为0。-20 ℃时各桃品种的发芽率大小顺序为‘秋恋’>‘晚蜜’>‘秋燕’>‘大久保’>‘03-49-079’>‘承德2号’>‘承德1号’>‘庆丰’>‘02-13-140’>‘03-22-034’>‘春雪’>‘金奥’,与根据LT50所得的抗寒性排序基本一致。将各品种发芽率与LT50进行相关性分析,结果表明温度为-10、-15和-20 ℃的处理,发芽率与LT50呈极显著负相关,相关系数分别为-0.811、-0.908和-0.944。
2.3 不同低温处理对桃枝条束缚水/自由水比值的影响
不同低温处理对桃枝条束缚水/自由水比值的影响见图2。随着处理温度的降低,各品种枝条束缚水/自由水比值均呈“先升高后降低”的变化趋势,但各品种束缚水/自由水比值达到峰值所对应的温度不同。‘金奥’‘春雪’‘03-22-034’‘03-49-079’‘庆丰’束缚水/自由水比值达到峰值时的温度为-15 ℃,‘承德2号’‘晚蜜’‘秋恋’‘秋燕’束缚水/自由水比值达到峰值时的温度为-30 ℃,其他品种束缚水/自由水比值在-20 ℃达到峰值。在整个降温过程中,‘秋恋’‘承德2号’束缚水/自由水比值增加较多,分别较对照增加了130.18%和123.70%,‘金奥’‘大久保’束缚水/自由水比值增加较少,分别较对照增加了63.20%和66.92%。将各品种束缚水/自由水比值与LT50进行相关性分析,结果表明温度为-30 ℃的处理,束缚水/自由水比值与LT50呈极显著负相关,相关系数为-0.875。
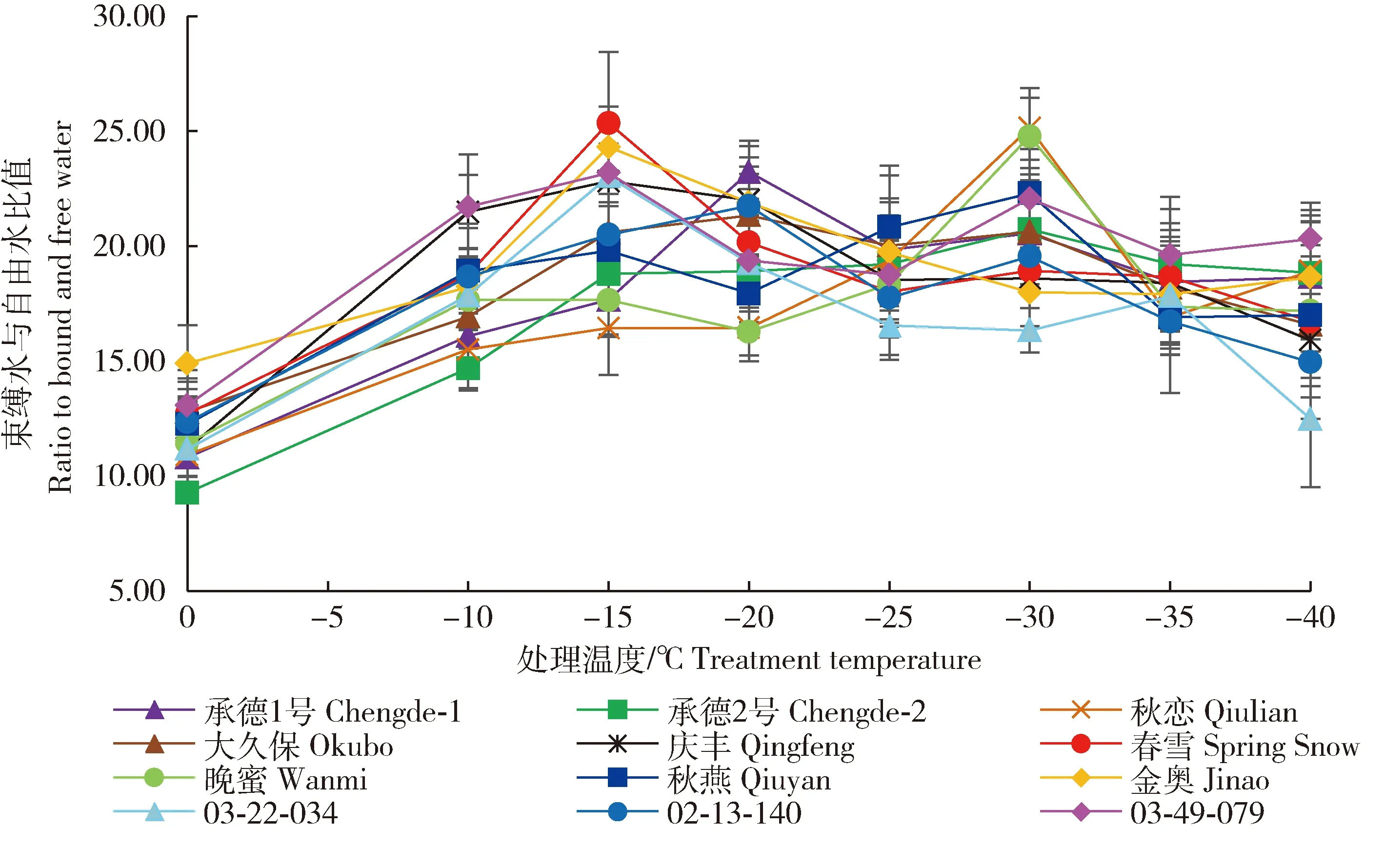
图2 不同低温处理下桃枝条束缚水与自由水比值的变化Fig.2 Changes of ratios to bound and free water of peach branches under different low-temperature treatment
2.4 不同低温处理对桃枝条丙二醛质量摩尔浓度的影响
不同低温处理对桃枝条丙二醛质量摩尔浓度的影响见图3。随着处理温度的降低,各品种枝条丙二醛质量摩尔浓度均呈“先升高后降低”的变化趋势,但各品种的丙二醛质量摩尔浓度达到峰值所对应的温度不同。‘春雪’‘金奥’和‘03-22-034’的丙二醛质量摩尔浓度达到峰值时的温度为-20 ℃,‘晚蜜’的丙二醛质量摩尔浓度达到峰值时的温度为-35 ℃,其他品种的丙二醛质量摩尔浓度分别在-25 ℃和-30 ℃达到峰值。在整个降温过程中,‘金奥’‘春雪’‘03-22-034’的丙二醛质量摩尔浓度较高,‘晚蜜’‘秋恋’‘秋燕’的丙二醛质量摩尔浓度较低;‘秋恋’‘晚蜜’‘秋燕’的丙二醛质量摩尔浓度增加较少,分别较对照增加了33.39%、45.27%和48.12%,‘承德1号’‘承德2号’‘庆丰’‘02-13-140’的丙二醛质量摩尔浓度增加较多,均较对照增加了80.00%以上。将各品种丙二醛质量摩尔浓度与LT50进行相关性分析,结果表明:0、-10、-15、-20、-25、-30、-35 和-40 ℃的温度处理,丙二醛质量摩尔浓度均与LT50呈极显著正相关,相关系数分别为0.722、0.833、0.888、0.888、0.887、0.926、0.790和0.746。

图3 不同低温处理下桃枝条丙二醛质量摩尔浓度的变化Fig.3 Changes of MDA molalities of peach branches under different low-temperature treatment
2.5 不同低温处理对桃枝条可溶性糖质量分数的影响
不同低温处理对桃枝条可溶性糖质量分数的影响见图4。随处理温度的降低,各品种枝条可溶性糖质量分数呈“升-降-升-降”的变化趋势。分别在-15 ℃和-30 ℃达到质量分数高峰,且第2个峰值大于第1个峰值。在整个降温过程中,‘秋恋’‘晚蜜’可溶性糖质量分数增加较多,分别较对照增加了310.94%和228.90%,‘春雪’增加较少,较对照增加了64.80%。将各品种可溶性糖质量分数与LT50进行相关性分析,结果表明温度为-15、-25和-30 ℃的处理,可溶性糖质量分数与LT50呈极显著负相关,相关系数分别为-0.744、-0.797和-0.824。

图4 不同低温处理下桃枝条可溶性糖质量分数的变化Fig.4 Changes of soluble sugar mass fractions of peach branches under different low-temperature treatment
2.6 不同低温处理对桃枝条可溶性蛋白质量分数的影响
不同低温处理对桃枝条可溶性蛋白质量分数的影响见图5。随处理温度的降低,除‘02-13-140’‘03-49-079’外,各品种枝条可溶性蛋白质量分数均呈“先升高后降低”的变化趋势,但各品种达到峰值所对应的温度不同。在-25 ℃时,‘承德2号’‘03-22-034’‘02-13-140’‘金奥’‘春雪’‘大久保’可溶性蛋白质量分数达到峰值,其余品种可溶性蛋白质量分数在-30 ℃达到峰值。在整个降温过程中,‘晚蜜’‘秋燕’‘秋恋’可溶性蛋白质量分数增加较多,分别较对照增加了73.48%、79.27%和85.91%,‘03-22-034’‘金奥’可溶性蛋白质量分数增加较少,分别较对照增加了41.52%和 43.08%。将各品种可溶性蛋白质量分数与LT50进行相关性分析,结果表明温度为-30 ℃的处理,可溶性蛋白质量分数与LT50呈极显著负相关,相关系数为-0.794。

图5 不同低温处理下桃枝条可溶性蛋白质量分数的变化Fig.5 Changes of soluble protein mass fractions of peach branches under different low-temperature treatment
2.7 不同低温处理对桃枝条脯氨酸质量分数的影响
不同低温处理对桃枝条脯氨酸质量分数的影响见图6。随处理温度的降低,各品种枝条脯氨酸质量分数总体呈“升-降-升-降”的变化趋势。在-15 ℃时,‘承德1号’‘03-22-034’‘秋燕’‘晚蜜’‘庆丰’‘春雪’‘大久保’脯氨酸质量分数达到第1个峰值,而其他品种脯氨酸质量分数在-20 ℃时达到第1个峰值,之后各品种脯氨酸质量分数出现小幅度的下降,在-30 ℃时,除‘03-22-034’外,各品种脯氨酸质量分数均达到第2 个峰值,且第2个峰值高于第1个峰值。在整个降温过程中,‘金奥’‘春雪’脯氨酸质量分数较低,增加较少,分别较对照增加了67.82%和41.25%,‘秋恋’‘晚蜜’脯氨酸质量分数较高,增加较多,分别较对照增加了101.69%和108.82%。将各品种脯氨酸质量分数与LT50进行相关性分析,结果表明温度为0、-10、-15、-25、-30和-40 ℃的处理,脯氨酸质量分数与LT50呈极显著负相关。相关系数分别为-0.757、-0.723、-0.793、-0.774、-0.896和-0.795。

图6 不同低温处理下桃枝条脯氨酸质量分数的变化Fig.6 Changes of proline mass fractions of peach branches under different low-temperature treatment
2.8 桃各抗寒指标的相关性分析
通过以上分析可以看出,各品种-30 ℃时的6个生理指标和-20 ℃的枝条萌芽率均与LT50极显著相关,并且品种间差异显著。因此,选取枝条发芽率(-20 ℃)和6个生理指标值(-30 ℃)进行相关性分析,结果见表3。从表中可以看出,相对电导率与丙二醛质量摩尔浓度之间呈显著正相关,与可溶性蛋白质量分数之间无相关性,其他各指标之间均存在极显著相关关系。由此可见,各抗寒指标间均存在一定的联系,它们提供的信息会有一定的重叠和疏漏,因此在桃抗寒性鉴定中,不能依赖单个或少数几个指标进行评价,应用多个抗寒指标进行综合评价。

表3 桃枝条各抗寒指标间相关系数Table 3 Correlation coefficient of cold resistance indexes of peach branches
2.9 不同桃品种抗寒性综合评价
为了全面、客观地反映不同桃品种的抗寒能力,运用隶属函数法,以7个抗寒指标隶属度的平均值对12个桃品种枝条抗寒性进行综合评价,平均隶属度越大,抗寒性越强,反之抗寒性越弱。结果如表4所示,12个桃品种的平均隶属度为0.11~0.98,‘金奥’的平均隶属度最小,‘秋恋’的平均隶属度最大,根据平均隶属度的大小可得12个桃品种枝条抗寒性强弱顺序为:‘秋恋’>‘晚蜜’>‘秋燕’>‘03-49-079’>‘承德2号’>‘承德1号’>‘大久保’>‘庆丰’>‘02-13-140’>‘03-22-034’>‘春雪’>‘金奥’。此排序结果与LT50的排序结果基本一致。

表4 不同桃枝条抗寒性指标隶属函数值Table 4 Subordinate function value of cold resistance indexes of different peach branches
3 讨论与结论
基于电解质外渗量测定开发的电导法是植物上应用比较广泛的抗寒性鉴定方法[16-17],电导率结合Logistic方程,可对LT50进行预测,预测结果与物种的田间表现基本一致[18-19]。本研究中,12个桃品种枝条的相对电导率,随处理温度下降呈“S”形曲线增加,并且在不同的处理温度下,抗寒性强的品种相对电导率较低,抗寒性弱的品种相对电导率较高,这与赵国栋等[12]和李桂荣等[20]的研究结果一致。‘承德1号’‘承德2号’为承德平泉地区的野生桃品种,平泉地区1月份平均最低气温-17 ℃,历史最低气温达到-26 ℃以下,在平泉地区这2个品种均没发生明显冻害,而在实验室条件下,‘承德1号’‘承德2号’的LT50分别为-21.56、-22.35 ℃,抗寒表现显著低于平泉田间。可能与试验低温持续时间长、温度变化的速率较快有关,说明应用电导法可以快捷的判定桃品种间的抗寒性强弱,但半致死温度受试验取材和试验控制条件等方面制约,与品种实际可忍受的低温极限值存在一定的差异,马小河等[21]和李远发等[22]在酿酒葡萄和麻风树上的研究也有类似情况。本研究结果中‘晚蜜’‘大久保’‘庆丰’‘春雪’‘金奥’的LT50与之前的研究结果有一定差异[23],但抗寒性的强弱顺序基本一致,可能与取材时间或试验条件不同有关,还有待于进一步验证。
恢复生长法是评价植物抗寒性的最直观和可靠的方法,由于桃枝条难以生根、形成愈伤组织,枝条遭受低温伤害的程度,主要通过芽对低温的敏感性反映出来,通过统计枝条的发芽率,可以直接确定枝条抗寒性强弱,所得结果与LT50所得抗寒性排序基本一致。
丙二醛是膜脂过氧化分解的最终产物,其质量摩尔浓度可以反映植物遭受冻害的程度[24]。葡萄上的研究表明[25-26],枝条中丙二醛质量摩尔浓度随着温度的降低呈逐渐增加的趋势。而本研究发现,随着温度的降低,丙二醛质量摩尔浓度先升高后降低,不同品种达到峰值所对应的温度不同,这与藕丹等[27]在毛白杨上的研究结果一致,可能与树种有关。抗寒性强的桃品种丙二醛质量摩尔浓度低,变化幅度小,达到峰值对应的温度低,说明丙二醛质量摩尔浓度、变化幅度和达到峰值时的温度可以作为桃抗寒性的鉴定指标。
在低温条件下,植物体通过提高可溶性糖、可溶性蛋白、脯氨酸等渗透调节物质质量分数,降低细胞液渗透势,从而提高机体的抗寒性[28]。抗寒性强的桃品种渗透调节物质质量分数较高,增加的幅度大。这与李斌等[29]和李萍萍[30]在海棠和扁桃上的研究结果一致。本研究中,当温度下降到-25 ℃时,各品种可溶性蛋白质量分数呈上升趋势,在此期间,枝条内部可能产生了其他种类的可溶性蛋白,如抗冻蛋白(AFPs)、离子通道蛋白或酶类等功能性蛋白质[31],这些功能性蛋白质可能影响了脯氨酸和可溶性糖的合成,导致在-25 ℃和-20 ℃时,脯氨酸和可溶性糖质量分数出现小幅降低,当温度进一步降低,这些功能性蛋白质活性钝化,脯氨酸和可溶性糖质量分数又呈增加趋势,当温度低于-30 ℃时 枝条组织结构被破坏,细胞严重受损,可溶性糖、可溶性蛋白和脯氨酸在植物体内正常合成受到抑制,质量分数降低。
植物的抗寒能力与机体内的水分变化息息相关。束缚水冰点为-25~-20 ℃,不易结冰;自由水可自由移动,0 ℃以下就会结冰[32]。低温条件下,桃枝条通过自身生理调节,增加束缚水含量,提高束缚水与自由水比值,减缓自由水结冰对细胞膜系统的破坏,抗寒性强的桃品种比值达最大时对应的温度较低,并且增加的幅度大,这与陈佰鸿等[32]和刘钰玺等[33]在葡萄上的研究结果一致。因此,束缚水/自由水比值的变化可以作为鉴定桃枝条抗寒性强弱的指标之一。
植物抗寒性是受多种因素影响的复杂的生理过程,用任何单一的生理指标难以全面客观地反映植物抗寒性的强弱。本研究利用隶属函数法对12个桃品种的7个生理指标进行综合分析,得出其抗寒性强弱顺序与单独运用LT50或恢复生长法所得抗寒性结果基本一致,表明该方法适用于桃抗寒性评价。本研究认为各桃品种抗寒性强弱依次为:‘秋恋’>‘晚蜜’>‘秋燕’>‘03-49-079’>‘承德2号’>‘承德1号’>‘大久保’>‘庆丰’>‘02-13-140’>‘03-22-034’>‘春雪’>‘金奥’。目前,这12个桃品种,部分为我国不同桃产区的优良品种,某一桃产区进行引种栽培时,应以产区内已有的本研究中涉及的品种为参考,对拟引入品种的抗寒性进行科学预判,避免抗寒性不适宜带来的生产损失。

