丝氨酸蛋白酶抑制剂Serpin1对东亚飞蝗酶学免疫的影响
李贝贝,田 野,闫多子,李红梅,曹广春,
刘明娜1,张泽华1,2,王广君1,2*
(1. 中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193;2. 农业农村部锡林郭勒草原有害生物科学观测实验站/国家林业和草原局内蒙古草地有害生物监测防控国家长期科研基地,内蒙古锡林浩特 026000;3. 河北农业大学植物保护学院,河北保定 071001;4. 中国农业科学院植物保护研究所/农业农村部—CABI生物联合实验室,北京 100193)
与哺乳动物获得性免疫不同,昆虫在面对病原菌时,主要依靠自身天然免疫反应来抵抗病原菌的入侵。昆虫体内的酶学相关免疫反应是昆虫先天性免疫中重要的组成部分,这些酶系变化情况在一定程度上可以反映昆虫与病原物之间的相互作用,体现病原菌的致病力,同时反映昆虫对外源物质的抗性程度(王正浩, 2016)。昆虫体内免疫相关酶类主要包括保护酶、解毒代谢酶类,其中保护酶系主要包括超氧化物歧化酶(SOD)、过氧化物酶(POD)及过氧化氢酶(CAT)等(李周直等, 1994);代谢解毒酶主要包括谷胱甘肽S-转移酶(GSTs)、多功能氧化酶(MFO)、乙酰胆碱酯酶(AchE)、羧酸脂酶(CarEs)及全脂酶(ESTs)等(Bolter and Chefurka, 1990; Lietal., 2007)。
丝氨酸蛋白酶抑制剂(serine protease inhibitors, Serpins)是丝氨酸蛋白酶抑制剂超家族中最大的一类,在动物、植物、微生物和病毒中广泛存在(Olson and Gettins, 2011),主要通过调控丝氨酸蛋白酶级联反应,参与昆虫的体液免疫反应(Tong and Kanost, 2005)。Serpins通过不可逆的结合丝氨酸蛋白酶,形成非共价复合物,调控昆虫体液免疫反应的Toll通路和黑化反应(Lawetal., 2006),一方面使免疫反应迅速剧烈的进行,另一方面将免疫反应限定到在一定的程度与范围内,保护宿主自身免受伤害(Hanetal., 2000)。
金龟子绿僵菌Metarhiziumanisopliae是一种非常重要的昆虫病原真菌,研究表明绿僵菌对蝗虫有较好的防治效果(雷仲仁和问锦曾, 2004)。本实验室前期研究发现Serpin1蛋白能降低绿僵菌对飞蝗的毒力(李贝贝等, 2020)。为进一步明确Serpin1的作用机制,本实验测定了在绿僵菌处理蝗虫的同时,加入Serpin1蛋白对东亚飞蝗体内保护酶、解毒代谢酶共6种酶活力的影响,从酶学水平探索了Serpin1抑制绿僵菌毒力的原因,为进一步明确Serpins的功能提供了参考。
1 材料与方法
1.1 供试真菌
金龟子绿僵菌菌株IMI330189由中国农业科学院植物保护研究所保藏。将IMI330189菌株接种在PDAY固体培养基上,28℃培养7 d,将孢子粉刮下,低温干燥后采用血球计数板计算总孢子含量,并通过萌发培养基检测萌发率,计算活孢子含量。其中活孢子量=总孢子含量×萌发率。4℃储存备用。
1.2 供试蝗虫及饲养方法
东亚飞蝗Locustamigratoriamanilensis卵购于河北沧州。蝗卵在人工气候培养箱中孵化,温度30℃±2℃,相对湿度为60%±5%,光周期L ∶D=14 h ∶10 h。将孵化后的蝗蝻转移到60 cm×50 cm×70 cm规格的养虫笼中饲养至3龄备用,温度30℃±2℃,光周期L ∶D=14 h ∶10 h。
1.3 Serpin1蛋白的提取
将含有serpin1基因的大肠杆菌EscherichiacoliBL21菌株接种至LB液体培养基中,37℃摇床培养过夜,2%转接至200 mL LB培养基中,37℃培养2 h(OD值0.5~0.6),加入IPTG至终浓度为0.5 mmol/L,28℃培养10 h。12 000 r/min离心、收集菌体,加入10 mL PBS缓冲液洗两次,重悬,超声破碎20 min,离心取上清,采用8M尿素法变性,在采用梯度复性的方法获得活性的Serpin1蛋白,采用BCA定量法,进行SDS-PAGE电泳,测定Serpin1蛋白的含量,-80℃冰箱储存备用。
1.4 杀虫活性测定方法
实验共设4个处理。处理1:金龟子绿僵菌IMI330189孢子粉;处理2:Serpin1蛋白;处理3:金龟子绿僵菌IMI330189孢子粉+Serpin1蛋白;处理4:对照(大肠杆菌BL21(pET-21b)经ITPG诱导后提取的蛋白)。根据前期实验结果,设置本实验各处理中绿僵菌孢子粉和Serpin1蛋白含量,详见表1(李贝贝等, 2020)。

表1 不同处理所用的饵剂组分及浓度
饵剂配制方法:每个处理分别称取10 g麦麸,加入5%植物油,混匀,按照表1每个处理中孢子和蛋白的含量,依据绿僵菌孢子粉中的活孢子含量和Serpin1蛋白原始浓度,分别计算、并称量所需的孢子粉和蛋白,加入麦麸中,混匀,各自均分成5份,分别放入灭菌的培养皿中备用。
杀虫活性测定方法:将预先饥饿处理12 h的3龄蝗蝻放入无菌的生测筐中,每筐30头为1个重复,将分好的饵剂分别放入装有蝗蝻的生测筐中,每个处理5筐(重复5次)。饲喂24 h后将饵剂取出,用新鲜麦苗饲喂至实验结束,温度30℃,光照16 L ∶8 D。每日记录死亡和存活数,并计算累计死亡率。
1.5 蝗虫蛋白酶提取液的制备
实验处理和蝗虫饲喂方法同1.4,在东亚飞蝗蝗蝻开始饲喂麦苗的当天开始,在每个处理的 5个重复中各取蝗虫1头,每个处理共取5头,连续取样5 d(王正浩, 2016)。将每头蝗蝻分别置于研钵中,加入液氮研磨成粉,倒至1.5 mL EP管中,加入1 mL trizol冰浴匀浆。将匀浆液在4℃下12 000 rpm离心20 min,取上清液作为酶提取液备用。
1.6 保护酶活性测定
超氧化物歧化酶(SOD)和过氧化物酶(POD)试剂盒购自南京建成生物工程公司,操作步骤按说明书的方法进行。酚氧化酶(PO)活性测定参照罗万春的方法(罗万春, 2010)。每个样本重复测定5次。
1.7 解毒酶活性测定
多功能氧化酶(MFO)活性测定参照Han等的方法(Hanetal., 1998);谷胱甘肽S-转移酶(GSTs)活性测定参照Oppenoorth和Welling的方法(Oppenoorth and Welling, 1976);乙酰胆碱酯酶(AChE)酶活测定参照高希武的方法(高希武, 1991)。每个样本重复测定5次。
1.8 虫体提取液总可溶性蛋白含量测定
以牛血清蛋白BSA为标准蛋白,参照Bradford方法测定(Bradford, 1976),每个样本重复测定3次。
1.9 数据处理
所有酶活测定数据采用Softmax Pro 6.1软件进行记录。本实验各酶活数据利用SPSS 19.0进行数据分析,采用Duncan法进行多重比较。
2 结果与分析
2.1 东亚飞蝗Serpin1蛋白对绿僵菌致病力的影响
东亚飞蝗的累计死亡率在不同处理组中的变化趋势见图1。在金龟子绿僵菌IMI330189处理组,东亚飞蝗蝗蝻从第3天起开始死亡,至第11天时累计死亡率达到80.6%;从第3天到第11天,每天的累计死亡率都显著高于对照(P<0.05)。在Serpin1蛋白单独处理组,从第1天至第11天,东亚飞蝗蝗蝻的累计死亡率都很低,且与对照无显著差异(P>0.05)。将Serpin1蛋白和绿僵菌IMI330189孢子混合处理东亚飞蝗后,第1天和第2天的累计死亡率与其他各组无显著性差异,第3天和第4天累计死亡率与对照组和Serpin1单独处理组之间都无显著差异(P>0.05),但显著低于绿僵菌IMI330189单独处理组(P<0.05);从第5天至第11天,每天的累计死亡率较对照组和Serpin1单独处理组都显著升高(P<0.05),但仍低于相同时间内绿僵菌IMI330189单独处理组的累计死亡率,且差异显著(P<0.05)。上述结果表明Serpin1蛋白能够显著降低绿僵菌对东亚飞蝗蝗蝻的致病力,使东亚飞蝗蝗蝻的死亡率降低。
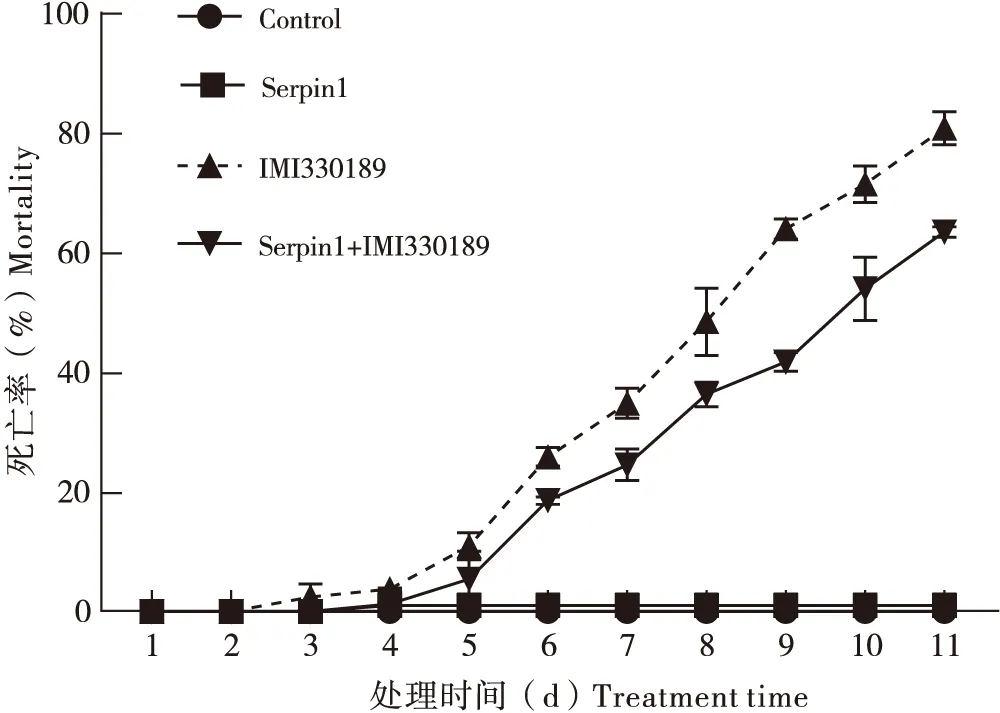
图1 不同处理后东亚飞蝗蝗蝻的死亡率Fig.1 Mortality of Locusta migratoria manilensis treated from different treatments
2.2 Serpin1蛋白对东亚飞蝗保护酶活性的影响
2.2.1对超氧化物歧化酶(SOD)活性的影响
不同处理组的SOD的活性表明(图2-A),Serpin1蛋白处理组在第4天和第5天的SOD活性显著高于对照组,在其它天内两组间无显著性差异。绿僵菌IMI330189处理组在处理的5 d内的SOD活性均高于对照组,且第2天和第4天的差异显著。绿僵菌IMI330189+Serpin1蛋白混合处理组在前4 d的SOD活性均显著高于对照组,且高于绿僵菌IMI330189处理组。总体上讲,Serpin1蛋白处理和绿僵菌处理后东亚飞蝗体内的保护酶SOD活性呈上升趋势;绿僵菌IMI330189与Serpin1蛋白混合后,SOD活性较绿僵菌IMI330189单独处理组呈升高的趋势。
2.2.2对过氧化物酶(POD)活性的影响
不同处理组的POD的活性表明(图2-B),Serpin1蛋白处理组在第4天的POD活性显著高于对照组,在其它天内两组间无显著差异。绿僵菌IMI330189处理组除第1天外,在其它天内的POD活性均显著高于对照组。绿僵菌IMI330189+Serpin1蛋白混合处理组在处理的第2、第3和第5天,其POD活性显著低于绿僵菌IMI330189单独处理组,在其它天内差异不显著。总体来说,Serpin1蛋白处理和绿僵菌处理后飞蝗体内的POD活性呈现上升的趋势,绿僵菌IMI330189+Serpin1蛋白混合处理组的POD活性较绿僵菌IMI330189单独处理组呈下降趋势。
2.2.3对酚氧化物(PO)酶活性的影响
不同处理组的PO的活性表明(图2-C),Serpin1蛋白处理组除第4天外,在其它天内的PO活性显著高于对照组。绿僵菌IMI330189处理组在处理的第1、第3和第5天的PO活性显著高于对照组,在其它天内两组差异不显著。绿僵菌IMI330189+Serpin1蛋白混合处理组在第1天的PO活性显著高于对照组和绿僵菌IMI330189处理组;第3天时,绿僵菌IMI330189+Serpin1蛋白混合处理组显著高于对照组,但与绿僵菌IMI330189处理组无显著差异,在其它天内3组差异不显著。总体来讲,Serpin1蛋白处理和绿僵菌处理后飞蝗体内的PO活性呈现上升的趋势,且在第1天上升最为明显;绿僵菌IMI330189+Serpin1蛋白混合处理组的PO活性较绿僵菌IMI330189单独处理组在第1天呈现上升的趋势,后期二者之间无显著差异。

图2 不同处理组对东亚飞蝗保护酶活性比较Fig.2 Comparison of protective enzymes activity of Locusta migratoria manilensis in different treatment groups注:A,超氧化物歧化酶活性;B,过氧化物酶活性;C,酚氧化酶活性。各酶活性是处理组酶活与对照组酶活的比值。图中不同字母代表0.05水平差异显著性。Note:A, SOD activity; B, POD activity; C, PO activity. The value of enzymes activities of treatment group divided by control group. Different letters in the figure represented the significance of difference at the 0.05 level.
2.3 Serpin1蛋白对东亚飞蝗解毒酶活性的影响
2.3.1对多功能氧化酶(MFO)活性的影响
不同处理组的MFO的活性表明(图3-A),Serpin1蛋白处理组除第4天外,在其它天内的MFO活性显著高于对照组。绿僵菌IMI330189处理组在处理的第2、第3和第5天的MFO活性较对照组显著上升,在其它天内差异不显著。绿僵菌IMI330189+Serpin1蛋白混合处理组除处理的第5天外,其它天数时其MFO活性显著高于对照组,且在第2、第3和第4天,其混合处理组的MFO活性显著高于绿僵菌IMI330189单独处理组,在第1天和第5天时,其MFO活性显著低于绿僵菌IMI330189单独处理组。总体上看,绿僵菌单独处理组和Serpin1蛋白处理组的MFO活性较对照均呈现上升的趋势,绿僵菌IMI330189+Serpin1蛋白混合处理组的MFO活性高于绿僵菌单独处理组。
2.3.2对谷胱甘肽-S-转移酶(GSTs)活性的影响
不同处理组的GSTs的活性表明(图3-B),Serpin1蛋白处理组在第2天和第4天的GSTs活性显著高于对照组,在第3天时的GSTs活性显著低于对照组。绿僵菌IMI330189处理组在第1、第3和第4天的GSTs活性显著低于对照组,在第2天和第5天时,其GSTs活性显著高于对照组。绿僵菌IMI330189+Serpin1蛋白混合处理组在处理后的第2天和第4天的GSTs活性显著高于对照组,在第3天显著低于对照组,且除第5天外,绿僵菌IMI330189+Serpin1蛋白混合处理组的GSTs活性显著高于绿僵菌IMI330189处理组。总体上看,Serpin1蛋白处理后,东亚飞蝗体内GSTs活力呈现升高再降低的趋势;绿僵菌IMI330189处理后,其GSTs活力呈现升高-降低-再升高的趋势;绿僵菌IMI330189与Serpin1蛋白混合后,比绿僵菌单独处理时,GSTs活力在前期呈现上调的趋势。
2.3.3对乙酰胆碱酯酶(AChE)活性的影响
不同处理组的AChE的活性表明(图3-C),Serpin1蛋白处理组在第1、第3和第4天的AChE的活性均显著高于对照组;第5天时,Serpin1蛋白处理组的AChE活性显著低于对照组。绿僵菌IMI330189处理组在处理后第1、第2和第4天的AChE活性显著高于处理组;第5天时,绿僵菌IMI330189处理组显著低于对照组。绿僵菌IMI330189+Serpin1蛋白混合处理组在处理后第2天和第3天时的AChE活性显著高于对照组和绿僵菌IMI330189单独处理组;在第1天和第4天时,显著低于绿僵菌IMI330189单独处理组。总体上看,Serpin1蛋白处理组和绿僵菌处理后飞蝗体内的AChE活性呈先上升后降低的趋势,绿僵菌IMI330189+Serpin1蛋白混合处理组的AChE活性较绿僵菌IMI330189单独处理组前期呈先升高后降低的趋势。

图3 不同处理组对东亚飞蝗解毒酶活性比较Fig.3 Comparison of detoxifying enzymes activity of Locusta migratoria manilensis in different treatments注:A,多功能氧化酶活性;B,谷胱甘肽-S-转移酶活性;C,乙酰胆碱酯酶活性。各酶活性是处理组酶活与对照组酶活的比值。图中不同字母代表0.05水平差异显著性。Note:A, MFO activity; B, GSTs activity; C, AChE activity. The value of enzymes activities of treatment group divided by control group. Different letters in the figure represented the significance of difference at the 0.05 level.
综上所述,将Serpin1蛋白与绿僵菌IMI330189混合处理东亚飞蝗后,与绿僵菌IMI330189单独处理相比,东亚飞蝗体内的MFO、GST、SOD、PO的活力升高,POD的活力降低,AChE的活力呈现先上升后降低的趋势,在这些酶活性的综合调节下,最终造成混合处理组的死亡率较绿僵菌单独处理组显著降低。
3 结论与讨论
昆虫在病原物侵染时,会诱导自身的免疫反应以抵抗并消除病原菌,其中酶学反应是免疫的重要组成部分(Desneuxetal., 2007)。前期研究发现饲喂绿僵菌孢子粉后,东亚飞蝗体内的保护酶呈现先上升后下调的趋势,多功能氧化酶和活性氧呈现出先降低后升高的趋势(郭隆隆, 2019)。Serpins可以通过调控体内丝氨酸蛋白酶级联反应,从而调控昆虫免疫过程(Olson and Gettins, 2011)。本实验通过测定Serpin1蛋白与绿僵菌混合处理东亚飞蝗后的死亡率,证明Serpin1能够有效抑制绿僵菌对东亚飞蝗的侵染,降低东亚飞蝗的致死率。因此,明确serpins对蝗虫体内免疫相关酶的影响,对于揭示Serpins抑制绿僵菌毒力的机制、明确Serpins的功能具有重要意义。
超氧化物歧化酶(SOD)和过氧化物酶(POD)能够清除超氧化物阴离子自由基O2-和H2O2,在昆虫抵御病原菌的侵染中起到重要作用。贾苗研究发现,将吡虫啉与绿僵菌混合处理东亚飞蝗,可致使东亚飞蝗体内的保护酶SOD和POD的活性升高(贾苗, 2017)。表明绿僵菌侵入后可能造成东亚飞蝗体内O2-增多,使虫体的保护酶系统开启,诱导并增强SOD活性来清除O2-,并进一步诱导体内的POD活性升高以清除过多的H2O2(李周直等, 1994)。本研究发现,Serpin1蛋白处理组和绿僵菌IMI330189与Serpin1蛋白混合组SOD活力较绿僵菌单独处理组表现为升高的趋势,表明Serpin1蛋白能够进一步提高东亚飞蝗体内SOD活力,增强虫体消除机体吞噬或包囊病原体等过程中所产生的过量活性氧的能力,保护昆虫避免因过多活性氧造成自身损伤。Serpin1蛋白处理组的POD的酶活性显著升高,而绿僵菌IMI330189与Serpin1蛋白混合组POD的酶活性表现为降低的趋势,推测可能是因为绿僵菌的侵入菌丝在东亚飞蝗体内大量萌发,致使体内的POD活性受到抑制,确切原因需要进一步深入探索。
当病原菌侵入时,昆虫会催化自身黑化反应以清除外来病原物,其中酚氧化酶(PO)是催化黑化反应的重要因子(Duan and Otvosi, 2001)。在分子氧存在条件下,PO能把酚类物质氧化成醌类物质,最终再聚合成黑色素参与到免疫防御过程中,与此同时其氧化过程中形成的醌类物质可协助杀死被包被的微生物(Cerenius and Soderhall, 2004)。如当白僵菌Beauveriabassiana侵入冈比亚按蚊Anophelesgambiae时,白僵菌体内的分生孢子、菌丝均可以诱导冈比亚蚊产生黑色素并引发黑化反应,阻碍白僵菌在虫体内的生长发育(Yassineetal., 2012)。本研究发现,在绿僵菌侵入的前期,东亚飞蝗的PO活性显著高于对照组,表明东亚飞蝗黑化反应被激活以抵抗绿僵菌的侵染,并在绿僵菌侵染前期发挥作用;Serpin1蛋白单独处理后PO活性表现出升高趋势,将绿僵菌IMI330189与Serpin1蛋白混合后,东亚飞蝗体内PO活性进一步升高,表明Serpin1蛋白能够有效增强东亚飞蝗的黑化反应,提高东亚飞蝗的免疫力。
多功能氧化酶(MFO)的成分包括细胞色素和黄素蛋白等,其中起主要作用的是细胞色素P450。病原菌进入昆虫体内,昆虫体内的氧化型P450与之结合形成复合物,后被NADPH还原,最后结合并激活氧,裂解成产物并合成水,最终降解病原菌的毒性(Zhouetal., 2010)。贾苗研究发现,用绿僵菌与环氧虫啶联合处理东亚飞蝗时,致使东亚飞蝗体内的解毒酶MFO活性显著升高(贾苗, 2017)。罗林珍采用不同杀虫剂处理韭菜迟眼蕈蚊BradysiaOdriphaga幼虫时,发现不同杀虫剂均可使韭菜迟眼蕈蚊体内的MFO活性呈现出升高的趋势(罗林珍, 2017)。这些研究都进一步明确了MFO的解毒功能。本研究发现,饲喂绿僵菌后东亚飞蝗体内的MFO活性升高,表明虫体在积极分解绿僵菌的毒性;Serpin1蛋白单独处理后PO活性表现出升高趋势,将绿僵菌IMI330189与Serpin1蛋白混合后,东亚飞蝗体内的MFO活性较绿僵菌单独处理组呈现增高趋势,表明Serpin1蛋白能增强东亚飞蝗体内多功能氧化酶活性,提高东亚飞蝗降解绿僵菌毒素的能力。
谷胱甘肽-S-转移酶(GSTs)的解毒作用主要体现在能够催化还原谷胱甘肽,使其通过与各种有害化学物质的亲电子基团相结合,最终形成硫醚氨酸促使各种毒性物质排出体外。当昆虫受到有毒物质的胁迫时,通过增加GSTs的表达量来增加其本身的解毒能力,达到缓解毒害的目的(周先碗, 1999)。蒋兴川等研究发现草地贪夜蛾Spodopterafrugiperda幼虫在受到甲氨基阿维菌素苯甲酸盐刺激时,其体内的GSTs活力会呈现先降低后升高再降低的趋势(蒋兴川等, 2019)。麦扁盾蝽Eurygasterintegriceps经球孢白僵菌及次生代谢产物侵入的中期,体内的GSTs活力显著升高(Zibaeeetal., 2009)。本研究发现,东亚飞蝗经绿僵菌侵染后,GSTs表现出先升高再降低的趋势,表明绿僵菌的侵入引起东亚飞蝗分泌GSTs来抵抗绿僵菌的入侵,后期绿僵菌菌丝在东亚飞蝗体内大量增殖,使体内的免疫系统紊乱,造成GSTs活力降低。经Serpin1蛋白单独处理,GSTs也表现出升高的趋势,且将绿僵菌IMI330189与Serpin1蛋白混合后,GSTs的活力较绿僵菌单独处理组呈现增高的趋势,表明Serpin1蛋白能够增强GSTs的活性,提高东亚飞蝗的解毒能力,以抵抗病原菌的侵染。
乙酰胆碱酯酶(AchE)是昆虫体内重要的神经系统酶,在昆虫神经化学传递中起着至关重要的作用。它主要是通过迅速分解虫体的乙酰胆碱,防止因乙酰胆碱积累造成的神经传递阻断,将有毒物质转化为无毒物质,从而降低病原物对昆虫的毒害作用(Fournier and Mutero, 1994; 唐培安等, 2007)。当使用有机磷杀虫剂侵染处理果蝇Drosophilia和麦二叉蚜Schizaphisgraminum时,它们体内的AchE活性显著升高,从而降低了对杀虫剂的敏感性(Zhu and Gao, 1999)。王龙江等研究发现,红火蚁SolenopsisinvictaBuren感染白僵菌后,其体内乙酰胆碱酯酶也呈现先上升后下降的趋势,表明病原物侵染可以诱导昆虫体内乙酰胆碱酯酶上调,从而增强对病原物的抵抗力(王龙江等, 2010)。本研究中,经过绿僵菌侵染后,东亚飞蝗体内的AChE活性也呈现先升高再降低的趋势,推测东亚飞蝗通过提高分解乙酰胆碱酯的能力从而抵抗绿僵菌的侵入,后随着绿僵菌大量增殖,体内乙酰胆碱含量升高,导致神经阻断而酶活力下降。经Serpin1蛋白处理,AChE活性表现出升高的趋势,且绿僵菌IMI330189+ Serpin1蛋白混合组的AChE活性较绿僵菌单独处理组先升高再降低,推测前期Serpin1蛋白的增加导致蝗虫分解乙酰胆碱的能力增强,从而迅速降低绿僵菌的毒力,后期AChE活性降低可能是Serpin1蛋白为防止体内过多的AChE破坏东亚飞蝗自身的神经系统,导致虫体因过度免疫而死亡。
本实验通过测定Serpin1蛋白与绿僵菌IMI330189混合后对东亚飞蝗体内保护酶和解毒酶等6种免疫相关酶的影响,证明Serpin1蛋白能够有效调控东亚飞蝗的体内相关酶的活力,提高东亚飞蝗的免疫力,从而降低绿僵菌对东亚飞蝗的致死率,为进一步明确Serpins的功能提供了参考。

