lncRNA ihha-as在斑马鱼早期胚胎发育中的功能研究
欧阳奇,李小灯,远长悦,李婧琳,韩 梅,胡 翔
(湖南师范大学生命科学学院,省部共建淡水鱼类发育生物学国家重点实验室,中国 长沙 410081)
lncRNA是指生物体内长度大于200 nt且不具有编码作用的一类长链非编码RNA[1]。虽然大多数lncRNA不具备编码蛋白的功能,但是在生命活动中起着至关重要的作用。有研究表明lncRNA参与了X染色体失活[2]、染色体修饰[3]、转录激活和干扰[4];此外还与生物体的生长发育、代谢与分化、肿瘤产生之间有着密切联系。
斑马鱼为硬骨鱼,主要在印度东部、孟加拉国、巴基斯坦和缅甸水域中生活,因鱼体两侧条纹类似斑马而得此名[5]。斑马鱼不仅具有个体小、胚胎透明、体外受精、生长和发育周期短、单次产卵数较高、便于体外观察和实验等优势外,更重要的是斑马鱼的组织和器官与人体极为相似,且斑马鱼的基因与人类的相似度高达87%。此外成年斑马鱼的心脏具有可再生功能,因此斑马鱼成为研究脊椎动物心脏再生模型的首选模式生物之一[6]。
心血管系统的发生包括心脏血管的形成以及血细胞的产生[7]。心脏作为胚胎发育中第一个形成的功能性器官,为血液循环提供持续动力,以满足机体在生长发育过程中对循环和代谢的需求。心脏发育几个重要过程分别是心脏前体细胞分裂分化、心管形成、心脏环化、心腔分隔,最终形成高度功能化的组织器官[8,9]。如今心血管和心脏发育引起的疾病较多,已经严重危害到人类生命健康[10,11]。在心脏发育中lncRNA有着不可替代的作用。
Ihha-as是存在于基因ihha附近的一条反义lncRNA,而基因ihha已经被报道与斑马鱼多处发育有关[12,13],但是ihha-as在斑马鱼早期发育中的表达及功能研究至今没有,在心脏发育过程中的作用目前也无文献报道。本研究以斑马鱼为实验材料,通过半定量和定量分析、整体原位杂交实验、morpholino敲低和挽救等实验来研究ihha-as在斑马鱼胚胎早期发育中的功能,探讨其在斑马鱼心脏发育中的作用。
1 材料和方法
1.1 材料
1.1.1 Tu系斑马鱼 购买于中国科学院武汉水生生物研究所。
1.1.2 Morpholino 根据lncRNA ihha-as序列特征,由美国Gene Tools(https://www.gene-tools.com/)公司合成,序列为:GCCGA ACTAC AACCC GGACA TCATC。
1.1.3 试剂 DIG Mix、DIG-AP 抗体、Blocking Reagent(Roche公司);20×PBS、多聚甲醛、甲基纤维素、甲酰胺、蛋白酶K(上海生工公司);肝素(Aladdin公司);tRNA和Trizol(Invitrogen公司);胰酶粉末(Sigma公司)。
1.2 方法
1.2.1 生物信息学分析 根据NCBI(https://www.ncbi.nlm.nih.gov/)、ZFLNC(http://www.zflnc.org/)、UCSC(http://genome.ucsc.edu/)、NONCODE(http://www.noncode.org/)等数据库对ihha-as进行序列分析。
1.2.2 荧光定量PCR 按照TaKaRa公司SYBR试剂说明书进行qPCR来检测相关基因的表达情况,引物序列见表1。

表1 特异性引物序列Tab. 1 Specific primer sequence
1.2.3 Ihha-as重组质粒构建 按酶切体系,37 ℃ 1 h,再进行产物胶回收;按连接体系,将酶切后的胶回收产物按照一定比例混合均匀后,置于22 ℃条件下进行DNA连接反应1.5~2.5 h;再进行转化,在长了菌落的培养皿中挑选单菌落,小摇2~3 h后,进行菌液常规PCR来筛选阳性结果,然后进行质粒测序,确定是否构建成功。
1.2.4 体外转录 选择HindⅢ将质粒进行线性化后合成反义探针,然后再将其进行琼脂糖凝胶电泳检验;用DNA胶回收试剂盒将线性化质粒回收;将2 μL线性化产物与2 μL DIG-Mix/dNTP、2 μL T7 RNA聚合酶、4 μL 5×Transcript buffer、1 μL Ribolock Rnase Inhibitor、9 μL RNase-free水混合均匀后,于37 ℃体外转录2 h;在37 ℃下,加2 μL Dnase I除去模板DNA 20 min,即得到转录产物。
1.2.5 斑马鱼胚胎原位杂交
1)胚胎的收集与固定 收集不同发育时期的胚胎(24 hpf加入0.003% PTU减少黑色素的形成),加入1 mL 4%多聚甲醛固定过夜(14 hpf之前的胚胎先固定后破膜,14 hpf之后的先破膜后固定);胚胎固定好之后,弃去溶液。然后在室温下,将固定好的胚胎置于摇床上,利用25%,50%,75%及100%甲醇依次进行洗脱,每次5 min;最终于管内加入1mL 100%甲醇于-20 ℃冰箱中保存。
2)原位杂交第一天 使用75%,50%及25%的甲醇梯度洗涤胚胎,每次5 min;再加1 mL PBST溶液,常温下摇床处理4次,每次5 min;弃去PBST,将不同时期的胚胎加入稀释后的蛋白酶K(10 mg·L-1)进行消化,吸去消化液,加1 mL PBST溶液,常温下摇床处理2次,每次5 min;加入1 mL 4% PFA,摇床固定处理40 min;1 mL PBST洗5 min,共4次;加入预混液(500 μL PBST+500 μL HYB),洗涤5 min;每管加入500 μL预热好的HYB溶液,于65 ℃分子杂交炉中处理3~4 h;弃液,RNA探针以1 mg·L-1的浓度加入200 μL HYB溶液中,于65 ℃分子杂交炉中进行杂交,过夜。
3)原位杂交第二天 将RNA探针回收,保存于-80 ℃;加入1 mL 65 ℃的HYB,75%HYB,50%HYB及25%HYB溶液于管中,放入 65 ℃水浴锅中依次洗涤,每次10 min,期间进行轻微摇晃;弃液,加入1 mL 65 ℃预热好的2×SSC,65 ℃水浴锅中处理2 min;弃液,加入1 mL 65 ℃预热好的0.2×SSC,65 ℃水浴锅中处理15 min,处理3次;弃液,加入1 mL MABT,75%MABT,50%MABT及25%MABT室温下摇床依次处理5 min;弃液,加入800 μL阻断溶液,室温下摇床处理3~4 h;弃去阻断溶液,加入1 mL稀释抗体(V(地高辛抗体)∶V(阻断溶液)=1∶5 000),4 ℃摇床过夜。
4)原位杂交第三天 弃去地高辛抗体的阻断试剂,加入800 μL 1%小牛血清的MABT试剂,常温下摇床处理10 min;弃液,加入800 μL MABT试剂,常温下洗8次,每次15 min;弃去MABT溶液,加入500 μL BCL Buffer,室温下摇床洗3次,每次5 min;弃去BCL Buffer,将BM Purple AP Substrate与BCL Buffer按体积比1∶1配成染色液,每管加500 μL染色液,4 ℃下摇床进行,且本步骤用锡箔纸避光;染色结束后,加入1 mL PBST终止显色反应;加入1 mL PBS溶液将其漂洗3次,并在体式显微镜下观察原位杂交结果,对每个胚胎及时进行图像采集。
2 结果
2.1 Ihha-as生物信息学分析
根据NCBI(https://www.ncbi.nlm.nih.gov/)、ZFLNC(http://www.zflnc.org/)、UCSC(http://genome.ucsc.edu/)及NONCODE(http://www.noncode.org/)等数据库以及相关文献分析发现,ihha-as是由斑马鱼9号染色体(小鼠5号,人类7号)产生的一个大约1 666 bp的单外显子反义lncRNA。在NCBI上进行blast序列比对,发现斑马鱼与小鼠和人之间具有一个长度大约为240 bp的高度相似序列(如图1A);另外在UCSC上将斑马鱼与青鳉、刺鱼、河豚、热带爪蟾、小鼠及人类7种生物基因组进行比较,结果显示,在ihha-as100~400 bp附近该7种生物基因组具有极高的保守性(如图1B),预测该区域为ihha-as的功能区,对斑马鱼早期胚胎发育至关重要。

图1 Ihha-as生物信息学分析图Fig. 1 Bioinformatics analysis of ihha-as
2.2 Ihha-as时空表达
首先针对不同时期各挑选30枚正常发育、形态完整的斑马鱼胚胎进行固定,接着利用ihha-as的反义探针对固定好的胚胎进行整体原位杂交,检测ihha-as的特异性表达情况。结果发现ihha-as在斑马鱼早期胚胎发育期间均有表达,尤其是在48 hpf和72 hpf时集中表达于斑马鱼心脏、头部和脊索(如图2A)。然后以斑马鱼成鱼不同组织器官的cDNA为模板,β-actin作为对照,进行半定量PCR和qPCR。结果发现ihha-as在心脏中的表达较高,而在肌肉、肠和卵巢中较低,在其他组织中表达量无明显差异(如图2B,C),这表明ihha-as对斑马鱼心脏发育至关重要,且检测到的时空表达结果与生物信息学预测结果基本一致,因此可说明lncRNA ihha-as对斑马鱼心脏发育有着重要的意义。
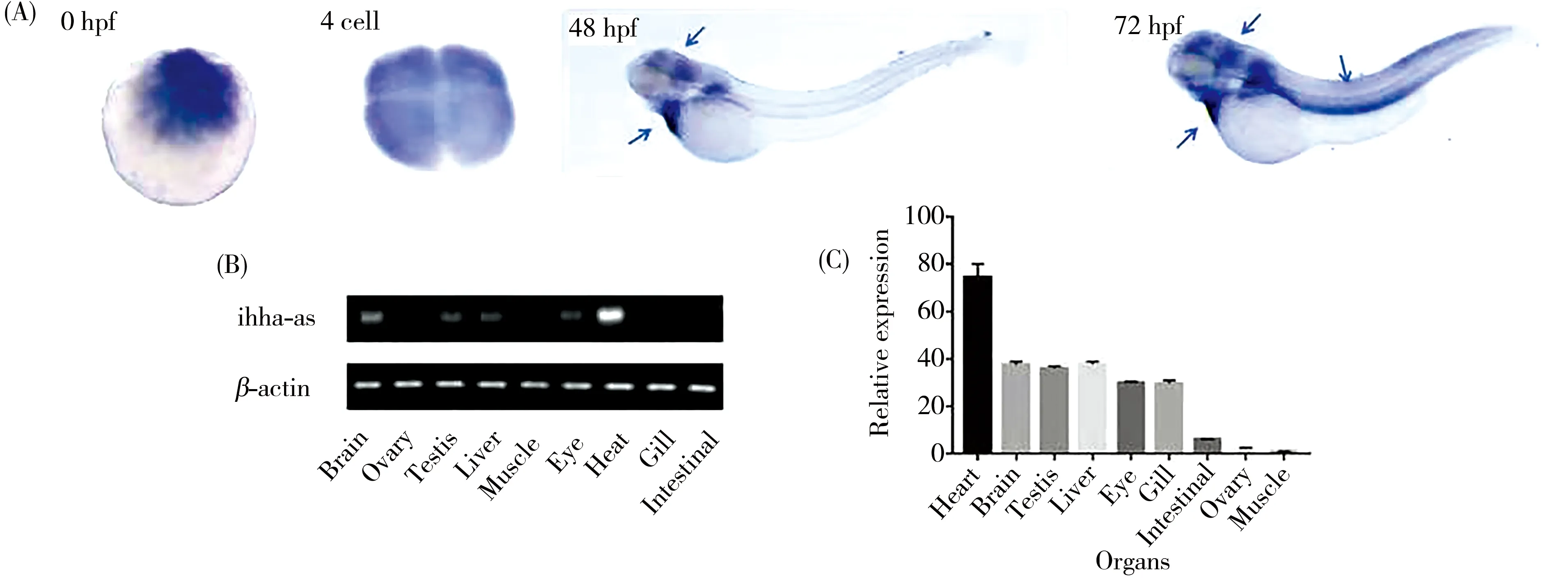
图2 Ihha-as时空表达图(n=30)Fig. 2 Ihha-as spatiotemporal expression (n=30)
2.3 Ihha-as-morpholino敲低和挽救对斑马鱼胚胎发育的影响
挑选受精5 min后、发育完整的斑马鱼胚胎进行显微注射,每一个组别各注射200枚胚胎。注射control-morpholino,ihha-as-morpholino敲低和ihha-as挽救后,ihha-as-morpholino注射组与对照组相比死亡率与畸形率都大大提高,而将morpholino与ihha-as共注射进行挽救时,笔者发现死亡率和畸形率大大降低,正常率明显提高(如图3A),表明其对斑马鱼早期胚胎发育至关重要。同时与control-morpholino组相比,ihha-as注射组的胚胎出现发育迟缓,心包水肿,心脏静脉窦出血,心率加快,尾部骨骼弯曲,色素沉着减少等缺陷,将ihha-as与morpholino共注射挽救时,发现该症状明显缓解,心包水肿与心脏出血明显降低,畸形率大大减少(如图3B)。

图3 Ihha-as-morpholino敲低和ihha-as挽救后表型结果图Fig. 3 Phenotypic results after the ihha-as-morpholino knockdown and ihha-as rescue
2.4 Ihha-as-morpholino敲低和挽救对心脏发育的影响
为了更好地探究ihha-as在斑马鱼早期心脏发育中的作用,笔者收集显微注射后48 hpf斑马鱼胚胎,每组各30枚,固定处理好后,选择心脏标记基因amhc,vmhc和cmlc2作为探针,进行斑马鱼整体胚胎原位杂交。结果显示:cmlc2组中ihha-as-morpholino敲低后,心脏未发生环化,呈线性状,心脏发育迟缓,挽救后心脏线性化有所缓解,心脏形态清晰;amhc组中ihha-as-morpholino敲低后,amhc表达范围变小,染色变浅,说明心房发育缺陷,挽救后心房表达区域变大,染色加深,心房结构有所恢复;vmhc组中ihha-as-morpholino敲低后,vmhc表达范围变小,染色变深,说明心室发育迟缓,同时流出道染色不明显,说明流出道发育有缺陷,挽救后心室形态结构完整,心室功能得到恢复(如图4)。

图4 Ihha-as-morpholino敲低和ihha-as挽救后心脏标记基因原位杂交图(n=30)Fig. 4 In situ hybridization of heart marker genes after the ihha-as-morpholino knockdown and ihha-as rescue(n=30)
3 讨论
在脊椎动物发育过程中心血管系统是最先形成并行使功能的系统之一,心脏作为该系统的主要器官之一,其作用就是进行血液循环。心脏发育过程中受到众多基因及信号通路的调控,且受到一定遗传因素的影响。在心脏前体细胞分化形成之后,就会发生细胞融合进而形成一个管状器官——心管。心管在经历一系列的形态变化后会形成具有一定形状的房室结构和具有一定角度的成熟心脏,这一过程称之为心脏环化[14]。心脏环化的机制较为复杂,TGF-β家族、nkx2及nodal等均与心脏的正确环化有关[15]。心脏正确环化能保证斑马鱼早期胚胎中正常的血液运输,且为其生长发育提供一定的动力。若心脏未正确环化会产生心包水肿、心房心室形态过大或过小等问题,从而严重影响心脏形态和泵血功能[16]。
lncRNA作为近年来生物学的一个研究热点,对其报道很多。在众多的长链非编码RNA中,发现大量与脑和眼睛等神经系统、骨骼和肌肉等运动系统发育相关的lncRNA[17],但与心脏发育相关的lncRNA报道相对较少。曾有研究表明lncRNA uc.4的过表达直接影响斑马鱼的胚胎发育从而致使心脏畸形。该lncRNA通过调控心脏的相关表达基因,从而参与心肌发育、心脏神经细胞的分化等心脏发育过程[18]。本课题组通过生物信息学分析筛选了几条具有高度保守性且与心脏发育相关的lncRNA,ihha-as就是其中一条具有特异性表达的lncRNA。ihha是Hedgehog信号通路中的一个信号分子,研究发现Hedgehog信号通路在胚胎发育、细胞的增殖分化和组织形成中起关键性的作用[19-21]。ihha作为Hedgehog信号通路中的一员,已经被报道与斑马鱼多种组织器官发育有关,如骨骼发育、食道形成,但是其反义lncRNA ihha-as在斑马鱼心脏发育形成过程中所起的作用至今无人研究。
目前许多靶基因在组织器官中的表达情况只进行了生物信息学预测,没有在个体水平上进行准确的时空表达定位,这样导致实验结果不具备说服力。本研究以斑马鱼为模式生物,利用半定量PCR和qPCR、原位杂交等多种实验方法确定了ihha-as在斑马鱼中的时空表达。结果显示:时空表达结果与生物信息学分析预测高度吻合,在早期胚胎发育过程中,ihha-as在心脏中出现特异性表达,说明ihha-as对于早期胚胎的心脏发育至关重要。通过morpholino干扰ihha-as的表达,导致斑马鱼的胚胎出现了心包水肿、心脏静脉窦出血等形态及功能上的变化,而这些变化都直接阻碍血液进入心脏[22]。
RNA干扰是利用反义RNA与正义RNA结合形成双链RNA来特异性抑制目的基因表达的现象,通过人为的引入与目的基因序列一模一样的双链RNA,诱导内源性mRNA降解,阻止基因表达。因此RNA干扰也被认为是一种高效的抑制特定基因表达的干扰方法。但是研究发现,在斑马鱼中利用RNA干扰,其效果不稳定。而morpholino干扰却能够轻松解决这一问题。因此为了敲低ihha-as的表达,研究ihha-as的功能,本实验利用morpholino干扰了ihha-as的表达,ihha-as-morpholino敲低后,斑马鱼心脏发育异常,挽救后斑马鱼畸形症状有所改善。
综上所述,本研究运用生物信息学、半定量PCR及qPCR、整体原位杂交、morpholino干扰等多种实验技术检测了ihha-as的时空表达、过表达情况、敲低和挽救后表达情况,证明ihha-as在斑马鱼早期胚胎和心脏发育中具有至关重要的作用。

