老年非M3型急性髓系白血病化疗前后营养状态评估与营养支持研究
王薇,何璇,贾蕾,马欢
1. 四川大学华西医院血液内科/四川大学华西护理学院,四川成都610041;2. 绵阳市中心医院消化内科,四川绵阳621000
急性髓系白血病(acute myeloid leukemia,AML)是临床常见的血液系统恶性肿瘤疾病,2015年我国癌症中心的统计数据显示,我国每年白血病患病人数为7.53 万,死亡人数超过5.34 万,其中AML 占成人白血病65%[1]。AML 多发生于老年人群,以发热、贫血、感染、肝脾及淋巴结肿大等症状为主要临床表现,治疗极为棘手[2]。化疗是现阶段临床治疗AML 的常用方法,经过积极治疗可延长患者生存周期,使患者获益,但较多资料[3-4]显示,化疗在杀死肿瘤细胞的同时,也会抑制正常细胞的增殖和分化,诱导细胞凋亡和线粒体功能发生紊乱,损害全身机能,引起恶性营养不良,影响疗效,增加患者死亡风险。老年AML患者由于体能状态较差、并发症多、异常染色体核型比例和耐药基因表达多,多种不利因素导致其对化疗耐受性较差,预后极不理想[5]。研究[6]证实,癌症患者的预后与营养的关系密不可分,营养不良越严重,患者化疗不良反应越明显,预后越差,而缺乏营养状况评估与合理的营养支持干预是其中重要原因。基于此,本研究探讨老年非M3 型AML 患者化疗前后营养状态及营养支持应用状况,以期为提高化疗效果和改善患者预后提供依据。
1 资料与方法
1.1 一般资料 选择2019年1月—2020年1月于四川大学华西医院血液内科就诊的147 例老年非M3 型AML 患者。纳入标准:(1)经外周血、骨髓细胞学和染色体等检查,参考非M3 型AML 相关诊断标准[7],患者外周血或骨髓原始细胞比<0.200;(2)年龄≥65岁;(3)生命体征平稳,预计生存期≥3 个月;(4)临床资料完整;患者同意配合本研究,签订知情同意书。凡符合上述所有标准的病例方可纳入本研究。排除标准:(1)合并其他恶性肿瘤;(2)M3 型AML 患者。M3 型AML 诊断标准为①骨髓中以异常的多颗粒早幼粒细胞为主,大于30%非红系有核红细胞(NEC);②伴重现性遗传学异常急性髓系白血病亚型下的APL 伴PML/RARQ 阳性;③ML/RARQ 融合基因阳性或染色体/FISH 证实t(15;17)(q22;q12);(3)心、肝、肾严重障碍;(4)难以配合治疗或中途失访者。具有上述任意1 项标准的病例不纳入本研究。入院24 h内由营养师和专业医务人员采用患者主观整体评估法(PG-SGA)[8]评估患者的营养状态,根据评估结果,将PG-SGA 评分≤3 分的69 例患者设为对照组,将PG-SGA 评分≥4 分的78 例患者设为干预组。经比较,2 组患者性别、年龄、病程和FAB 分型[7]等一般资料差异无统计学意义0.05),具有可比性。本研究获本院伦理委员会审批。
1.2 方法
1.2.1 化疗方案 所有患者均给予低强度传统化疗方案,诱导缓解方案为DA 方案,即柔红霉素(海正辉瑞制药有限公司,国药准字H33020925)30~45 mg/m2,d1~d3+阿糖胞苷(国药一心制药有限公司,国药准字H20055127)100 mg/(m2·d),d1~d7;HA 方案,即高三尖杉酯碱(山东齐都药业有限公司,国药准字H20030443)2~4 mg/d,d1~d7+阿糖胞苷100 mg/(m2·d),d1~d7;HAG 预激方案,即高三尖杉酯碱1 mg/d,d1~d14+阿糖胞苷15~20 mg/m2,1 次/12 h+人粒细胞集落刺激因子(杭州九源基因工程有限公司,国药准字S10980030)300 g/d,d1~d14];CAG 方案,即阿柔比星(深圳万乐药业有限公司,国药准字H10910092)10 mg/d×(4~8)d+阿糖胞苷15~20 mg/m2,1 次/12 h+人粒细胞集落刺激因子300 g/d,d1~d14。上述方案若1 个疗程未获得完全缓解(CR),则进行第2 个疗程,方案同1 疗程,2 个疗程未达CR视为无效。
1.2.2 营养支持 对照组常规饮食,每日热量供给为25~30 kcal/kg,蛋白质0.6~0.8 g/kg,不另补维生素及矿物质。干预组予营养支持,由专业营养师根据PGSGA 评估结果,参考文献[9],结合患者营养状况及胃肠道功能制定具体的营养支持治疗方案,合理搭配蛋白质、脂肪及碳水化合物,确保营养素的摄入与质量,每日热量供给为45 kcal/kg,蛋白质1.2 g/kg(优质蛋白为主),补充维生素A、E、C,根据检测结果在膳食中加入适量的微量元素钙和锌,少食多餐,避免食用油腻、辛辣和高糖食物,减少不必要的肝肾负担。轻度营养不良患者开始阶段蛋白质的供给量为每日推荐量的2/3,脂肪占全日量20%,无营养不耐受后逐渐增加至正常需求量;中度营养不良患者,在上述饮食的基础上若出现频繁呕吐,无法进食或发热时,可配置短肽型和整蛋白型营养混合制剂口服或管饲,以保证营养素摄入;重度营养不良者提供优质蛋白>50%,以不饱和脂肪酸为主,避免进食高糖淀粉类食物。鼓励患者经口进食,因频繁呕吐而无法进食者可采取短期管饲的肠内营养,必要时采用肠外营养。营养支持与化疗同时进行。
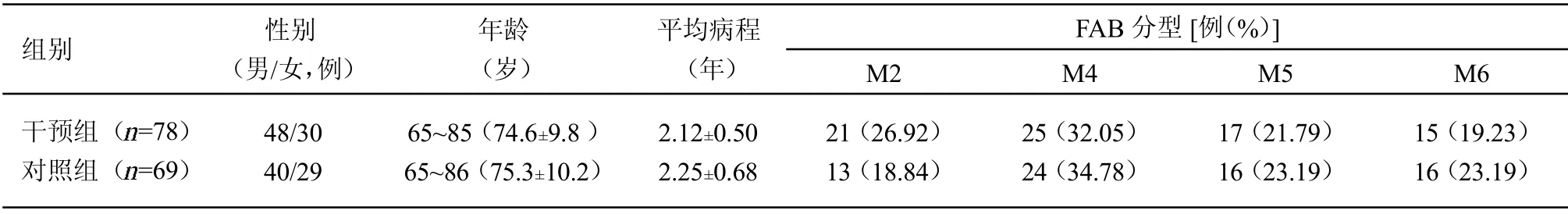
表1 2 组临床资料比较
1.3 观察指标与方法
1.3.1 化疗前营养状况[8]记录化疗前患者PG-SGA 评价情况。PG-SGA 量表包含2 个部分,第1 部分由患者填写,包括远期及近期体质量变化、过去和目前的进食情况、与饮食摄入相关症状、活动及身体功能;第2 部分由医务人员填写,包括影响营养状况的疾病、应激状态和体格检查。对上述2 个部分进行综合评定,之后评估患者的营养状态,分别设为4 个等级,评价标准:PG-SGA 评分于0~1 分的患者暂不需要营养干预,可定期进行例行评估;PG-SGA 评分于2~3 分的患者暂不需要营养干预;PG-SGA 评分于4~8 分的患者需要进行营养干预;PG-SGA 评分≥9 分的患者极需改善症状的同时需要营养干预。
1.3.2 营养摄入 记录2 组患者化疗期间蛋白质、脂肪和碳水化合物三大营养素的摄入量。
1.3.3 人体测量学参数 于化疗前和化疗后1 个月,测量2 组体质量指数(body mass index,BMI)、腰臀比、上臂肌围、上臂围。
1.3.4 实验室生化指标检测 于化疗前和化疗后1 个月,使用日立3500 全自动生化分析仪测定患者的血清总蛋白(TP)、前清蛋白(PA)、清蛋白(ALB)、铁转蛋白(TF)等水平。
1.3.5 不良反应 记录患者化疗后不良反应主要包括恶心呕吐、腹泻、白细胞减少、乏力和心烦失眠等。
1.3.6 化疗效果评估 化疗3 个周期后,依据《血液病诊断与疗效标准》[10]判定疗效,分为完全缓解(CR),即骨髓原始细胞<0.05,外周血ANC≥1.0×109/L,PLT计数≥100×109/L,无髓外浸润;部分缓解(PR),即骨髓原始细胞为0.05~0.25,外周血指标与CR 标准一致。总体缓解(OR)例数=CR 例数+PR 例数。
1.4 统计学分析 采用SPSS 21.0 统计软件进行数据分析。经正态性检验与方差齐性检验后,正态分布且方差齐性的计量资料以均数±标准差()表示,组间比较行独立样本 检验,组内比较用配对样本 检验;偏态分布的资料采取秩和检验。以例数和百分率表示计数资料,采用2或连续性校正2检验。0.05 表示差异有统计学意义。
2 结果
2.1 化疗前患者营养状况 147 例老年非M3 型AML患者中,PG-SGA 评分≥4 分者78 例,占53.06%;不同年龄患者的 PG-SGA 评分比较无统计学差异>0.05),但年龄≥75 岁患者中PG-SGA 评分≥9 分占比明显高于<75 岁患者<0.05);不同BMI 患者的PG-SGA 评分存在差异,BMI<18.5 kg/m2患者PGSGA 评分0~1 分占比低于BMI 18.5~24 kg/m2及BMI>24 kg/m2患者,而PG-SGA 评分≥9 分占比高于BMI 18.5~24 kg/m2及BMI>24 kg/m2患者,差异均有统计学意义<0.05)。提示年龄越大且BMI 越低的非M3 型AML患者营养不良的发生风险越高。见表2。

表2 不同年龄、BMI 患者化疗前PG-SGA 评分比较
2.2 2 组患者化疗期间蛋白质、脂肪和碳水化合物日人均摄入量比较 干预组蛋白质及脂肪摄入量明显高于对照组,差异有统计学意义<0.05)。提示在非M3型AML 患者化疗期间予营养支持,可提高患者蛋白质和脂肪等营养摄入情况,进而改善其营养状况。见表3。
表3 2 组患者化疗期间蛋白质、脂肪和碳水化合物日人均摄入量比较(±s)

表3 2 组患者化疗期间蛋白质、脂肪和碳水化合物日人均摄入量比较(±s)
注:与对照组比较,△<0.05
组别 蛋白质(g) 脂肪(g) 碳水化合物(g)干预组( =78)对照组( =69)88.34±5.81△85.32±4.47 80.15±14.52△68.46±12.10 342.12±50.36 329.98±44.10
2.3 2 组化疗前后人体测量学参数比较 化疗前,2 组BMI、腰臀比、上臂肌围和上臂围等人体测量学参数差异无统计学意义0.05);化疗后,2 组BMI、腰臀比和上臂围均较同组化疗前明显降低,干预组均高于对照组<0.05)。提示化疗可引起老年非M3 型AML 患者脂肪存储减少和肌肉萎缩,给予患者营养支持可减少脂肪流失和肌肉萎缩。见表4。
表4 2 组化疗前后人体测量学参数比较(±s)
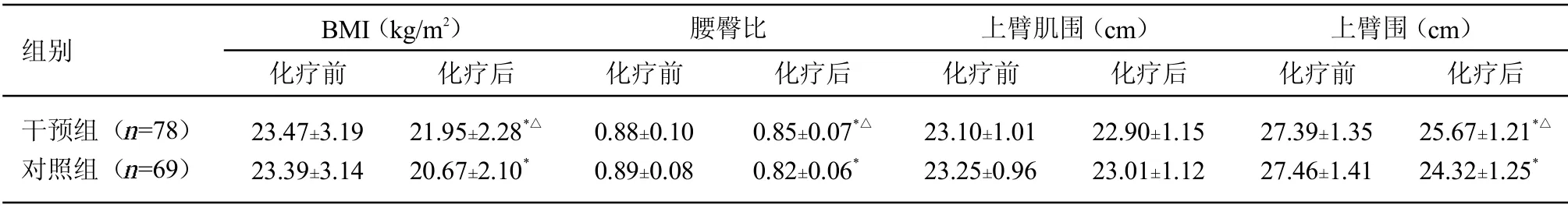
表4 2 组化疗前后人体测量学参数比较(±s)
注:与同组化疗前比较,<0.05;与对照组化疗后比较,△<0.05
组别 BMI(kg/m2)化疗前 化疗后腰臀比化疗前 化疗后上臂肌围(cm)化疗前 化疗后上臂围(cm)化疗前 化疗后干预组( =78)对照组( =69)23.47±3.19 23.39±3.14 21.95±2.28*△20.67±2.10*0.88±0.10 0.89±0.08 0.85±0.07*△0.82±0.06*23.10±1.01 23.25±0.96 22.90±1.15 23.01±1.12 27.39±1.35 27.46±1.41 25.67±1.21*△24.32±1.25*
2.4 2 组实验室生化指标值比较 化疗前,2 组TP、PA、ALB 和TF 水平差异均无统计学意义>0.05);化疗后,2 组TP、PA、ALB 和TF 水平较同组化疗前明显降低,干预组均高于对照组,差异均有统计学意义<0.05)。提示化疗可引起老年非M3 型AML 患者营养代谢异常,增加营养不良风险,而加强营养支持可促进患者机体分解代谢水平正常,纠正营养不良。见表5。
表5 2 组实验室生化指标值比较(±s)
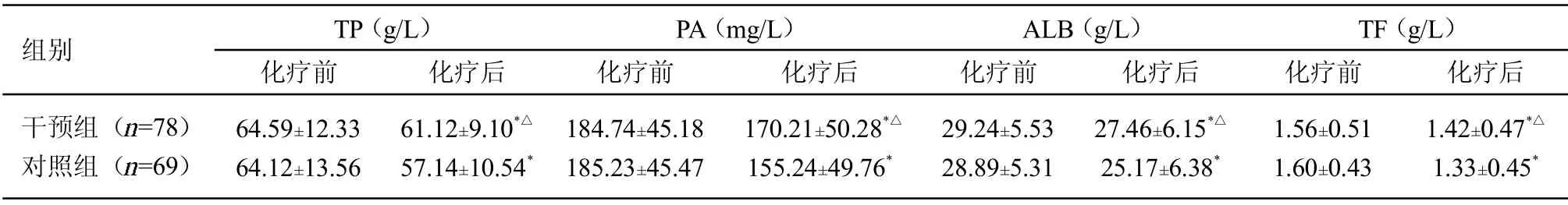
表5 2 组实验室生化指标值比较(±s)
注:与同组化疗前比较,<0.05;与对照组化疗后比较,△<0.05
组别 TP(g/L)化疗前 化疗后PA(mg/L)化疗前 化疗后ALB(g/L)化疗前 化疗后TF(g/L)化疗前 化疗后干预组( =78)对照组( =69)64.59±12.33 64.12±13.56 61.12±9.10*△57.14±10.54*184.74±45.18 185.23±45.47 170.21±50.28*△155.24±49.76*29.24±5.53 28.89±5.31 27.46±6.15*△25.17±6.38*1.56±0.51 1.60±0.43 1.42±0.47*△1.33±0.45*
2.5 2 组化疗期间不良反应比较 干预组患者不良反应总发生率显著低于对照组<0.05)。提示在老年非M3 型AML 患者化疗时给予营养支持可减少化疗相关不良反应发生。见表6。

表6 2 组化疗期间不良反应比较[例(%)]
2.6 2 组化疗效果比较 干预组患者的CR 率和OR 率均显著高于对照组<0.05)。提示在老年非M3 型AML 患者化疗的同时予营养支持可一定程度上提升化疗效果。见表7。

表7 2 组化疗效果比较[例(%)]
3 讨论
AML 为常见白血病类型,死亡率高达62%,严重危及患者生命健康和生活质量,是当前临床面临的一大难题[11]。据流行病学调查统计,约3/4 的AML患者在55~65 岁以上发病,其中位诊断年龄为67 岁[12]。老年AML 起病缓慢,加之老年AML 患者多伴有其他脏器疾病,易被误诊或漏诊,治愈率不高。化疗是AML 的有效干预手段,但相关研究指出,在化疗和肿瘤的双重作用下,患者往往会发生各种程度营养不良,而营养不良会进一步降低患者对化疗药物的耐受性,增加并发症风险,导致化疗效果下降,延长住院时间,甚至缩短患者生存周期[13]。因此,评估老年AML 患者化疗期间营养状况并对患者予以规范和有效的营养支持治疗显得尤为重要。
据统计,我国肿瘤患者营养不良发生比例超过40%,晚期患者高达80%,其中约40%患者因营养不良而死亡[14]。AML 属于慢性消耗性疾病,老年患者身体素质差,合并基础疾病多,长期化疗更易处于营养不良状态。PG-SGA 是在主观整体评估(SGA)基础上发展而来,适用于肿瘤患者的营养状况评估,其以能有效反映恶性肿瘤患者营养状态而被国内外学者认可[15]。本研究中,采用PG-SGA 对147 例老年非M3 型AML 患者进行营养状态评估,结果显示,PGSGA 评分≥4 分患者占比53.06%,其中年龄≥75 岁患者中PG-SGA评分≥9 分占比明显高于<75 岁患者;BMI<18.5 kg/m2患者PG-SGA 评分0~1 分占比低于BMI 18.5~24 kg/m2及BMI >24 kg/m2患者,而PG-SGA评分≥9 分占比高于BMI 18.5~24 kg/m2及BMI >24 kg/m2患者,说明老年非M3 型AML 患者普遍存在营养不良现象,且年龄越大和BMI 越低,患者营养不良发生率越高,分析其原因可能与老年患者各脏器生理功能减弱、机体免疫功能下降和体重降低等有关[16]。
国外1 项研究[17]纳入30 例AML 患者及33 例急性淋巴细胞白血病(ALL)患者,对比患者化疗前及化疗后1 个月营养摄入量及PG-SGA 评分,发现大多数患者处于营养缺乏或营养不良状态,需要营养干预。AML 患者受肿瘤细胞影响而出现体内能量、碳水化合物、脂肪及蛋白质代谢异常改变,营养水平较差,化疗会使患者出现呕吐和食物量下降等不良反应,导致机体营养摄入不足,以至于化疗期间营养不良较为常见[18]。而相关研究指出,营养不良可导致并发症和死亡率上升,其严重程度与疾病不良预后密切相关[19]。近年来随着对肿瘤患者营养代谢认识的进一步加深,临床更倾向于在化疗期间评估患者营养状态,并给予规范和有效的营养支持治疗,以改善患者的营养状况,提升化疗效果。本研究根据PG-SGA 的营养状况评估结果,对78 例PG-SGA 评分≥4 分的老年非M3 型AML 患者予以对症营养支持治疗,结果显示,化疗3 个周期后,各组人体测量学参数(BMI、腰臀比和上臂围)及实验室生化指标(TP、PA、ALB 与TF)较同组化疗前明显降低,且对照组显著低于干预组,说明化疗可能会引起老年非M3 型AML 患者营养不良及代谢失衡状态,在化疗期间给予有效的营养支持治疗十分必要。临床常用的营养支持方法分为肠内营养和肠外营养2 种,二者各有利弊,应视患者胃肠道功能情况而定。闫晓红等[20]对192 例白血病化疗患者给予肠内营养支持,发现观察组三角肌皮皱厚度、上臂围测量值及血红蛋白最低值均明显高于对照组,与本研究结果基本相符。孟广强等[21]研究认为,营养不良会增加化疗不良反应,降低疗效,预后不理想。本研究显示,干预组不良反应发生率显著低于对照组,CR 率及OR 率显著高于对照组,说明在老年非M3 型AML 患者化疗期间给予对症营养支持可有效降低化疗不良反应,提升疗效。研究[22]认为,营养不良患者普遍存在细胞免疫功能缺陷,营养状况越差,其免疫系统受损越严重,化疗相关不良反应越多。因此,关注并改善老年非M3 型AML 患者化疗期间营养状况,对降低化疗不良反应、提升化疗效果以及提高患者生存质量有积极的临床意义。然而,目前临床对营养状况评价的标准尚未达成共识,本研究可能为老年非M3型AML 患者化疗期间营养状况的评价提供新思路。
综上所述,老年非M3 型AML 患者营养不良较为常见,应准确评估患者的营养状况,并根据患者营养状况在化疗期间给予对症营养支持,以改善患者的营养状况,降低化疗不良反应,提升化疗效果。本研究仍存在不足之处,如:纳入样本量较少,仅观察患者营养支持治疗后的短期疗效,并且未统计患者生存期限等,在后续工作中,将增加病例和延长随访时间进一步研究论证。

