番茄MYB44基因敲除载体构建研究
●娄红梅 杨庆玲 向小雪(重庆大学生物工程学院 重庆 404100)
基因编辑技术的出现,为基因功能的深入研究和作物有益性状的改良提供了重要的技术支撑。CRISPR/Cas系统基因编辑技术,具有载体构建过程简单、编辑效率高,可对特异功能基因进行敲除,因此在植物中得以广泛应用[1]。
CRISPR-Cas系统包含CRISPR基因座和Cas基因(CRISPR关联基因)两部分[2]。CRISPR是原核生物基因组内的一段重复序列,分布在40%已测序细菌和90%已测序古细菌中。CRISPR基因序列主要由前导序列(leader)、重复序列(repeat)和间隔序列(spacer)构成。前导序列:富含AT碱基,位于CRISPR基因上游。重复序列:长度20~50 bp碱基且包含5~7 bp回文序列。间隔序列:是被细菌俘获的外源DNA序列。细菌的免疫系统会对外源遗传物质产生记忆,再次入侵时CRISPR/Cas系统就会精准 识别[3]。
Cas基因编码的Cas蛋白在防御过程中至关重要。目前已经发现了Cas1~Cas10等多种类型的Cas基因。CRISPR/Cas基于Cas基因和CRISPR序列分成3种类型(Ⅰ、Ⅱ和Ⅲ型),其中属于TypeⅡ型的CRISPR/Cas9最为普遍[4]。
Cas9蛋白切割靶标基因造成双链断裂后,会优先启动编辑受体中的非同源末端连接修复途径,使得切割位点发生碱基的插入缺失(Indel),当Indel位于基因外显子且碱基数不是3的倍数时,便会造成密码子的移码突变。如果2个等位基因同时发生相同的编辑,则形成纯合突变,若2个基因同时发生不同的编辑,则产生双等位突变,两种突变均能实现基因的敲除[5]。
MYB转录因子是植物中数量最多的转录因子家族之一,参与植物生长发育和代谢的各个方面。MYB转录因子具有共同的结构特征,C端是包含酸性氨基酸的转录激活功能域,N端末端包含一段高度保守的MYB结构域。MYB结构域通常是由1~4个不完全重复(Repeat. R)的序列构成,每段重复序列含有50~53个氨基酸残基,并且每隔约18个氨基酸中间存在着1个色氨酸 残基[6]。
根据所含相邻重复序列的数量差异,MYB家族可以分为不同的亚类。在c-MYB蛋白中3个重复序列的名称分别为R1、R2和R3,MYB蛋白按照与c-MYB重复序列的相似性,将家族成员 分 为4R-MYB、3R-MYB、1R-MYB、R2R3-MYB四类[7]。MYB基因作为一类转录因子,可参与细胞形态发生、叶绿体发育、植物激素信号转导、种子休眠、植物昼夜节律、次生代谢等 过程[8]。
通过对MYB44基因序列进行生物信息学分析,发现番茄中MYB44属于MYB家族转录因子,与已报道的拟南芥中的MYB44高度同源。研究表明,拟南芥中的MYB44基因参与调节ABA介导的对干旱、盐度和损伤等非生物胁迫的耐受性。在盐胁迫条件下,拟南芥植株中MYB44启动子激活,诱导MYB44转录本增加,在拟南芥植株中超表达MYB44有助于提高其耐盐性[9]。而在干旱胁迫下超表达MYB44,拟南芥植株表现出叶片卷曲、叶片白化、蒸腾作用加快等特征,表明该基因参与干旱胁迫调节过程[10]。若发生机械损伤或花瓣掉落,相应部位的MYB44会被迅速大量激活,进一步启动防御基因的转录,提高植物抗性。因此,研究番茄中MYB44基因的功能,有助于提高番茄植株非生物胁迫的 抗性。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料 野生型番茄AC++、大肠杆菌感受态DH5α、质粒pKSE-401、helper菌、农杆菌LBA4404。
1.1.2 试验仪器 恒温摇床、光照培养箱、超净工作台、电泳仪、凝胶成像仪、恒温水浴锅、电子天平、灭菌锅、PCR仪、恒温金属浴、离心机、紫外分光光度计。
1.2 试验方法
根据前期已经克隆得到的MYB44基因序列(图1),设计sgRNA靶位点序列,退火制备sgRNA双链,再与线性pKSE-401-Cas9载体连接获得重组载体,将重组载体转化DH5α感受态细胞,再对其进行PCR鉴定及序列比对分析。

图1 MYB44基因及sgRNA序列
2 结果
2.1 靶向MYB44的sgRNA设计
根据MYB44基因的NCBI登录号XM_010317694.3, 找出外显子区域。再利用在线数据库(http://crispr.mit.edu)设计MYB44基因的sgRNA,序列为5′-TAGCCCG ACTTCTTAATGGG-3′,长 度 是20 bp,GC含量达到50%,并包含PAM识别位点。
2.2 重组载体的构建
利用限制性内切酶BbsⅠ对pKSE-401载体进行切割,从而获得一个14 800 bp的线性载体和一个1221 bp的短片段,并将sgRNA寡核苷酸单链以逐步降温的方法退火形成双链,利用连接酶solutionⅠ将sgRNA与线性载体在16℃中连接2~4 h。
2.3 转化
将冻存的大肠杆菌感受态细胞(每管100 μL)置于冰上融化,取连接产物在冰上预冷2 min后加入其中,轻轻拨动5~10次,在冰上放置 30 min,42℃的水浴锅中热激90 s后迅速放冰上 5 min,在超净工作台中加入700 μL LB液体培养基,在37℃ 150 r/min的摇床中孵育60 min,之后7000 r/min离心3 min,吸去部分上清液,留 100 μL重悬沉淀,并涂布于含卡那抗性的LB平板,干后用封口膜封闭,置于37℃恒温培养箱内倒置培养12~16 h。
2.4 菌斑检测
在超净工作台挑出单菌后,以通用型引物U6-26p-F和U6-26t-R对重组载体进行PCR鉴定,正确结果为423 bp大小片段,试验结果与预期一致,初步判断sgRNA与pKSE-401载体准确连接(图2),将阳性克隆菌液送至上海生工进行测序,结果显示插入片段无突变基因,表明MYB44基因的敲除载体构建成功。
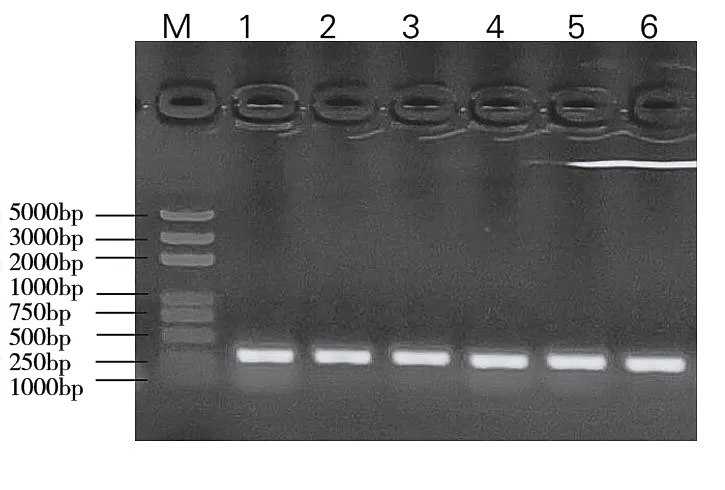
图2 重组载体pKSE-401-Cas9-sgRNA的PCR鉴定
2.5 三菌合一
将上述测序正确的大肠杆菌以及helper菌分 别接种于含有卡那霉素的固体LB培养基上,培养16 h。农杆菌LBA4404则接种于含有利福平和链霉素的YEB固体培养上,暗培养3 d,将3种 菌混合涂布于YEB培养基上,28℃暗培养1 d。 第2天将3菌混合物重新接种到YEB(SM+Kan+Rif) 中筛选重组农杆菌,28℃暗培养3 d。挑取单菌落进行PCR检测,条带正确后摇菌保存菌种。
2.6 CRISPR/Cas9/MYB44 农杆菌转化番茄子叶
将番茄AC++种子进行次氯酸钠消毒后,置于4℃冰箱中过夜,使得种子发芽时间一致。在恒温摇床中培养2 d,将萌发的种子播种到不含抗生素的MS培养基上,于光照环境培养,直至种子萌发长出两片子叶,将子叶两端剪掉,中间部分伤口朝下置于培养基(IAA+ZT)中进行预培养,第2天于超净工作台中进行农杆菌侵染后,再将子叶两端翘起放回平板中,28℃暗培养2 d。将子叶转移到含有IAA+ZT+Kan+Carb的MS培养基中培养,两端伤口1/2插入到培养基中,将培养皿放入光照培养箱中培养,15 d左右形成愈伤组织。将其转移至组培瓶中继续培养,待分化出幼苗后,切取幼苗转移到生根培养基中(Kan+Carb),将生根的组培苗进行继代。
3 结果分析
针对已生根的组培苗,取少量叶片进行基因组DNA的提取,并通过引物MYB44-F和MYB44-R进行PCR扩增,得到884 bp大小的片段后,将PCR产物送往上海生工公司进行测序,其结果与野生型WT的序列进行比较,得到的结果为sgRNA靶序列发生了3种不同类型的编辑,即形成3个独立的株系(图3)。
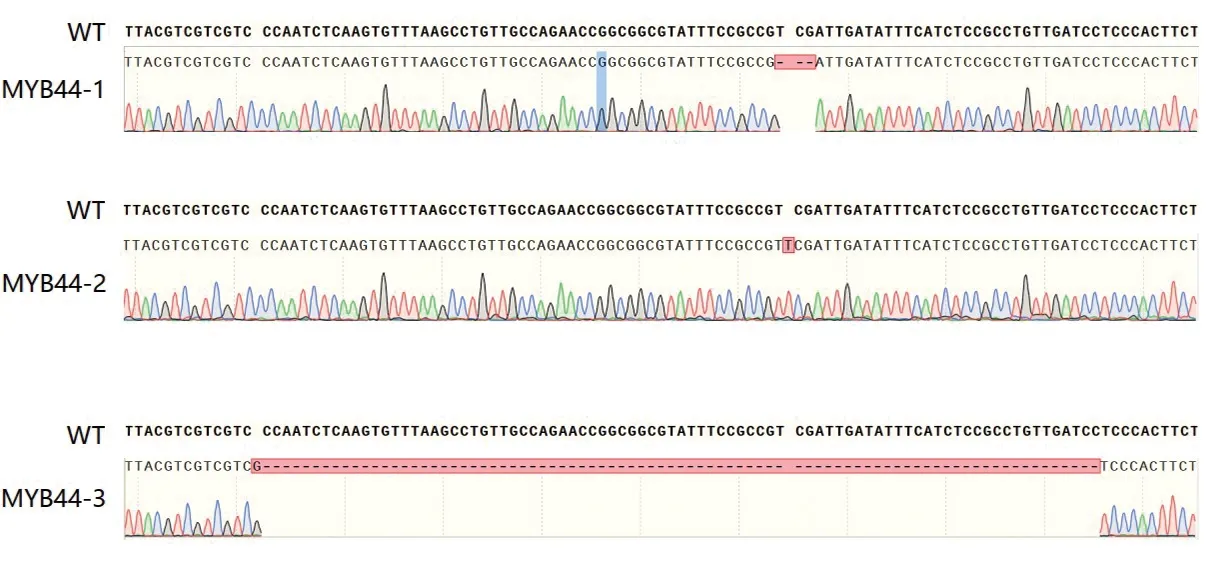
图3 重组载体pKSE-401-Cas9-sgRNA的测序结果
4 讨论与展望
CRISPR/Cas系统是植物基础研究和应用的重要工具,因其强大的编辑能力,已经获得数百种具有改良农业性能的农作物品种[11]。CRISPR/Cas9作为植物中特定基因靶向突变的一种手段,2014年首次在番茄中用于探究基因功能,首先构建SlSHR基因的缺失突变体,通过侵染番茄根组织,发现SlSHR基因影响下游靶标基因SISCR的表达,并导致番茄根毛变短,这与拟南芥中观察到的表型一致,证明了该基因的保守性[12]。2014年Brooks等[13]对番茄SLAGO7基因进行研究,设计了2个靶位点序列的载体,并采用侵染叶片的方法进行遗传转化试验,通过检测发现T0代植株接近1/2的位点均发生突变,再次对突变植株进行PCR检测,最终得到一个纯合体,一个小片段缺失突变体,两个嵌合体。2017年,在番茄中构建CRISPR筛选文库,用于研究富含亮氨酸重复序列的受体样激酶亚家族(LRR-XⅡ)基因的功能[14]。结果表明,CRISPR/Cas9技术能够在番茄中实现精准编辑并通过种系稳定传播,以期通过该技术提高番茄产量、品质以及抗胁迫,抗病能力。

