BC02 复合佐剂成分协同增强机体固有免疫应答的分析
李军丽,付丽丽,杨阳,王国治,赵爱华
中国食品药品检定研究院结核病疫苗和过敏原产品室,北京 102629
非活性抗原,尤其是纯化的重组亚单位蛋白抗原,通常免疫原性较差,需要额外的组分来帮助其刺激机体形成基于抗体或效应T 细胞功能的保护性免疫,而正是这些被称为佐剂(adjuvant)的附加组分提供了增强疫苗抗原免疫原性所需的帮助。人们将佐剂加入疫苗有两种不同的原因:首先,基于抗体效价或预防病原体感染的能力,如增加疫苗适应性范围[1-2],降低抗原使用剂量并减少免疫针次等[3];其次,引导适应性反应的类型,实现免疫应答定性改变,产生针对特定病原体最有效的免疫形式。如加强记忆T 细胞的形成[4-6],增加免疫应答启动阶段的速度[7-9],改变抗感染反应的广度、特异性或亲和力等[9-10]。
目前,常用的佐剂包括传统的弗氏佐剂、铝盐佐剂、MF59 佐剂、AS03 佐剂以及针对模式识别受体开发的新型佐剂CpG-DNA、Poly I:C 及单磷酰脂质A等。随着免疫佐剂研究的不断深入,发现单独使用某一种佐剂,对改善抗原的反应强度、免疫力维持时间、免疫耐受等作用有限,而使用复合佐剂的疫苗比使用单一佐剂的疫苗可诱导更强的免疫应答。因此,将不同类型佐剂配伍研制复合佐剂成为佐剂发展的新趋势。然而,在人类或动物中广泛使用的单一或复合佐剂,大部分为经验性开发,对其体内外作用的分子机制尚不完全清楚。有研究数据表明,大多数佐剂先通过接合固有免疫系统的组分来增强特异性T 和B 细胞应答,而并非直接作用于淋巴细胞[11-13]。因此,以固有免疫应答为切入点着手研究佐剂作用机制具有重要意义。
本室在前期研究中发现,复合佐剂BC02(BCG CpG DNA combination adjuvant system 02)集组成成分Al(OH)3无机盐佐剂和BC01 生物佐剂的优势,可同时诱导机体形成Th1 和Th2 型免疫应答[14-15]。此外,复合佐剂BC02 组成成分在激活小鼠巨噬细胞参与固有免疫应答中具有协同增强作用[16]。本研究在前期体外细胞试验的基础上,进一步探讨BC02复合佐剂组成成分在诱导机体固有免疫应答上的协同增强作用,通过对其在体内作用的相关分子机制的深入研究以加快推进该系列佐剂的临床转化。
1 材料与方法
1. 1 实验动物 SPF 级 C57BL / 6 小鼠,雌性,6 ~ 8周龄,体重18 ~ 20 g,购自中国食品药品检定研究院实验动物资源研究所。动物许可证号:SCXK(京)2017-0013。本研究中涉及的所有动物操作均遵循实验动物福利伦理审查指南,并得到本院伦理委员会的批准。
1. 2 主要试剂及仪器 A(lOH)3佐剂Alhydrogel®购自美国Invivogen 公司;BC01 生物佐剂和BC02 复合佐剂由中国食品药品检定研究院结核病疫苗和过敏原产品室保存及配制;RNAlater 购自美国Thermo Scientific 公司;TransScript One-Step gDNA Removal、cDNA Synthesis SuperMix 试剂盒和 TransTap High Fidelity(Hifi)PCR SuperMixⅠ试剂盒购自北京 TransGen Biotech 公司;Mouse Transcriptome Assay 2. 0基因芯片购自美国Affymetrix 公司。
1. 3 小鼠免疫及解剖 将C57BL / 6 小鼠随机分为4 组:实验组分别肌肉注射100 μL A(lOH)3佐剂、BC01 佐剂和BC02 复合佐剂,对照组肌肉注射等量PBS 溶液。免疫后6 h,将各组部分小鼠安乐死,解剖取腹股沟淋巴结,于-20 ℃预冷的RNAlater 溶液中保存,待分离总RNA。各组剩余小鼠分别于免疫后24、48 和72 和96 h 安乐死,解剖取右后肢内侧注射部位肌肉组织,经10%中性福尔马林溶液固定,进行组织HE 染色和免疫荧光染色分析。
1. 4 总RNA 提取及cDNA 合成 腹股沟淋巴结经PBS 洗涤2 次后,用 1 mL Trizol 裂解淋巴结,将裂解物与200 μL 氯仿混匀,室温静置3 min;4 ℃,12 000 × g 离心10 min,分离水相与有机相;吸取水相至新离心管中,将异丙醇按1 ∶1 比例加至水相中,颠倒混匀后置-20 ℃ 2 h;4 ℃,12 000 × g 离心10 min,获得总RNA 沉淀;每管加入1 mL 75%乙醇洗涤沉淀 2 次,4 ℃,7 500 × g 离心 5 min;弃上清,沉淀室温放置干燥5 ~ 10 min;溶于无RNase 水。采用 Nanodrop 分别计算 A260/280和 A260/230值,并分析纯化后总RNA 的数量和质量。cDNA 合成按反转录试剂盒说明书进行。
1. 5 基因芯片操作及数据分析 生物素标记片段化的cDNA,用 GeneChip®Hybriding Oven 645 将标记的cDNA 与基因芯片45 ℃杂交16 h;杂交结束后,芯片经GeneChip®Fluidics Station 450 进行 Streptavidinphycoerythrin 洗染,采用 GeneChip®Scanner 3000 7G和Affymetrix Command Console 软件扫描获取图像。基因芯片数据经Robust Multi-Array Average(RMA)算法归一化后,采用Partek®GenomicsSuite®对每组4 个独立样本的基因表达数据进行统计分析。显著差异表达基因(significantly differentially expressed gene,SDEG)使用 Ingenuity Pathway Analysis(IPA)软件进行GO 分析和信号通路网络分析。
1. 6 信号通路中富集的SDEG 的检测 采用qPCR法。无RNase 水调平反转录合成的cDNA 模板浓度。反应体系 20 μL:10 μL ChamQ SYBR qPCR Master Mix,6. 5 μL 去离子水,3 μL 10 倍稀释的 cDNA 模板,0. 5 μL 引物。利用Premier 5. 0 软件设计引物,引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。反应条件:95 ℃预变性4 min;94 ℃变性 30 s,60 ℃退火 30 s,72 ℃延伸 45 s,共 35 次循环;72 ℃后延伸10 min。以β-actin 为内参基因。试验重复3 次。

表1 巨噬细胞吞噬功能相关基因qPCR 引物序列Tab. 1 The qPCR primer sequences for genes related to phagocytic function of macrophages
1. 7 组织病理学检测 不同佐剂免疫小鼠解剖后,注射部位肌肉组织修块、脱水、石蜡包埋并切成5 μm 厚度切片,经HE 染色和免疫荧光染色后扫描载玻片保存为NanoZoomer 数字病理图像,不同视野下拍照并分别评估注射部位炎性细胞的招募情况及细胞表面MHC-Ⅱ分子表达水平。
1. 8 统计学分析 采用SPSS 16. 0 软件进行统计学分析,结果以平均数 ± 标准差表示。不同实验组间差异比较采用单因素方差分析,以P < 0. 05 为差异有统计学意义。柱形图采用GraphPad Prism 8 软件(美国GraphPad Software 公司)绘制。
2 结 果
2. 1 不同佐剂免疫后小鼠全基因组转录谱整体分析 主成分分析(principal component analysis,PCA)显示,PC1、PC2 和 PC3 在 X 轴、Y 轴和 Z 轴方差的可重复性分别为28. 6%、17. 9%和8. 9%,各佐剂免疫小鼠组间数据集聚类彼此不同,组内生物学重复样本数据集聚类紧密(图1A)。进一步比较不同佐剂免疫后小鼠转录谱总体变化,在调整原始背景信号参数后,通过One-way ANOVA 分析各微阵列中38 535 个探针的表达值并制作火山图(图1B、C、D)。以上下调倍数≥2 或P < 0. 05 作为阈值,分别鉴定出 542、1 154 和 1 185 个 SDEG。这些 SDEG 中,相较于PBS 对照组,Al(OH)3佐剂、BC01 佐剂和BC02复合佐剂组中各有约 1. 10%(422 / 38 535)、2. 79%(1 077 / 38 535)和 2. 97%(1 143 / 38 535)的基因表达被上调,而有约0.31%(120/38 535)、0.20%(77/38 535)和0.11%(44/38 535)的基因表达被下调。

图1 不同佐剂免疫后小鼠全基因组转录谱整体分析Fig. 1 Whole genome transcription profile of mice immunized with different adjuvants
2. 2 佐剂成分对免疫细胞活化网络激活的协同增强作用 佐剂免疫后6 h,小鼠免疫细胞活化网络被明显激活。该网络中的27 个基因被富集,其中Al(OH)3佐剂显著上调CHI3L1 和mir-15 基因表达,下调GSTP1、CCNB2、NLK、EBF1、TP53、let-7 和 mir-15 基因表达(图 2A)。BC01 佐剂显著上调 CD14、FOS、IL1A和 Saa-3 基因表达,下调 GSTP1、CCNB2、NLK、TP53、ARRB2、let-7、CD69 和 mir-15 基因表达(图 2B)。BC02复合佐剂则在Al(OH)3佐剂和BC01 佐剂上调或下调相关基因的集合上,显著上调MSR1、Ccl9、CCL2、FCER1G 和 MT-ND6 基因,并显著下调 QKI、ATM、MKI67、CRADD、PHKA2 和 ULBP1 基因(图 2C)。
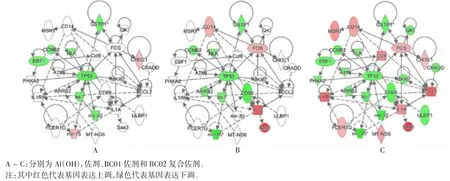
图2 BC02 复合佐剂成分对免疫细胞活化网络激活的协同增强作用Fig. 2 BC02 compound adjuvant components synergistically enhance activation of immune cell activation network
2.3 佐剂成分对免疫细胞招募信号网络激活的协同增强作用 不同佐剂免疫后,免疫细胞招募信号网络被显著激活(图3A)。BC02 复合佐剂免疫后6 h,参与中性粒细胞、巨噬细胞及髓样细胞等招募相关基因 C5RA1、CCL2、CcI9、CD14、FOS、CHI3L1、CcI7、HCK、IL1A 和CD5L 被显著上调。且与单一佐剂Al(OH)3和 BC01 相比,BC02 复合佐剂成分协同显著增强 CCL2、CcI9 及 HCK 基因的表达(图 3B)。注射部位肌肉组织切片HE 染色分析及浸润细胞表面MHC-Ⅱ分子特异性荧光标记分析发现,BC02 复合佐剂注射后24 h,注射部位肌肉组织中炎性细胞浸润数量和MHC-Ⅱ分子荧光信号强度高于相同时间点单一佐剂Al(OH)3、BC01 及PBS 对照组。随着时间的延长,BC02 复合佐剂组浸润的炎性细胞数量和MHC-Ⅱ分子荧光信号强度均有所增加(图4A、B)。
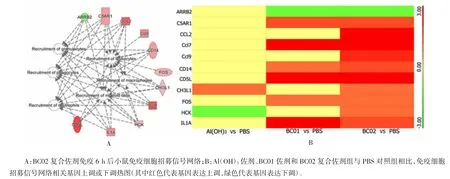
图3 BC02 复合佐剂成分对免疫细胞招募信号网络激活的协同增强作用Fig. 3 BC02 compound adjuvant components synergistically enhance activation of immune cell recruitment signaling network
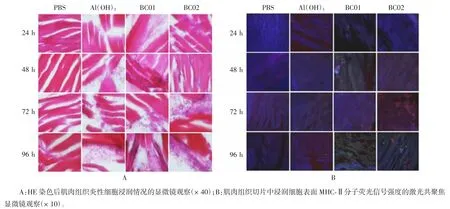
图4 不同佐剂免疫小鼠后各个时间点注射部位免疫细胞招募情况分析Fig. 4 Analysis of recruitment of immune cells in injection sites with different adjuvants
2. 4 佐剂成分对巨噬细胞吞噬功能的协同增强作用BC02 复合佐剂免疫后6 h,巨噬细胞吞噬功能信号网络被显著激活(图5A)。与单一Al(OH)3佐剂相比,其吞噬功能相关基因CD14、CLEC6A、FCER1G、HCK、MARCO、MSR1 和 SPIC 被显著上调,MYO5A 和SH3KBP1 基因被下调。而与BC01 佐剂相比,FCERIG、HCK 和 MSR1 基因被显著上调,mir-142、mir-30 和SH3KBP1 基因被下调(图5B),表明BC02 复合佐剂组成成分间具有协同增强单核巨噬细胞系统吞噬功能的作用。qPCR 法进一步验证巨噬细胞吞噬功能相关SDEG 发现,BC02 复合佐剂与Al(OH)3单一佐剂比较,CD14、CLEC6A、FCER1G、HCK、MARCO、MSR1和SPIC 基因被显著上调,且变化比率差异有统计学意义(F 分别为 13. 032、9. 273、17. 901、7. 791、23. 128、11. 083 和 15. 066,P 均 < 0. 05);同时,BC02 复合佐剂与Al(OH)3单一佐剂比较,MYO5A 和SH3KBP1基因被显著下调,且变化比率差异有统计学意义(F分别为 19.157 和 21.381,P 均 < 0.05)。见图 6。
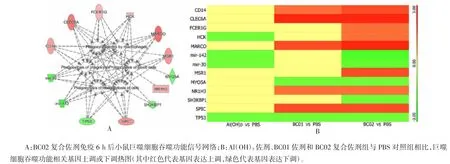
图5 BC02 复合佐剂成分对巨噬细胞吞噬功能的协同增强作用Fig. 5 BC02 compound adjuvant components synergistically enhance phagocytic function of macrophages
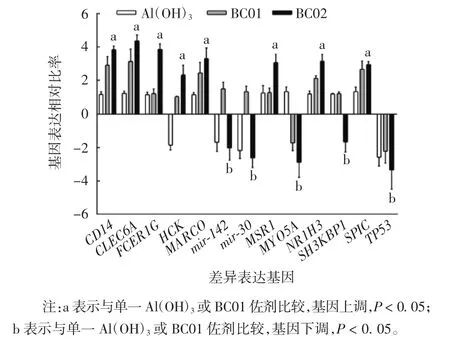
图6 巨噬细胞吞噬功能基因的的qPCR 分析Fig.6 Analysis of phagocytic function of macrophages by qPCR
2. 5 佐剂成分对肿瘤坏死因子-α(tumornecrosisfactorα,TNF-α)信号通路网络激活的协同增强作用 不同佐剂免疫后,TNF-α 信号通路网络被激活(图7A)。在富集到TNF-α 信号通路作用网络相关的42 个基因中,A(lOH)3佐剂免疫后上调其中1 个基因,下调13 个基因,BC01 佐剂免疫后上调8 个基因,下调12个基因,而复合佐剂BC02 免疫后上调20 个基因,下调22 个基因。且BC02 复合佐剂组成成分协同上调CCL2、CcI9、FCER1G、HCK、IL1RN、LIPG、MAFF、MEFV、MYL6B、RPS12 和 SLC15A3 基因表达(图 7B)。

图7 BC02 复合佐剂成分对TNF-α 信号通路网络激活的协同增强作用Fig. 7 BC02 compound adjuvant components synergistically enhance activation of TNF-alpha signaling network
2. 6 佐剂成分对CCL2 相互作用网络激活的协同增强作用 不同佐剂免疫后,趋化因子CC 亚家族成员CCL2[单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)]相互作用网络被激活(图 8A)。在富集到CCL2 相互作用网络相关的49 个基因中,A(lOH)3佐剂免疫后上调其中1 个基因,下调13 个基因;BC01 佐剂免疫后上调9 个基因,下调13个基因;而复合佐剂BC02 免疫后上调24 个基因,下调25 个基因。且BC02 复合佐剂组成成分协同上调CCL2、FCER1G、FGL2、HCK、IL1RN、LIPG、MAFF、MSR1、RPL35A、RPS12、RPS14、SLC15A3、TGM1 和ZNF575 基因表达(图 8B)。
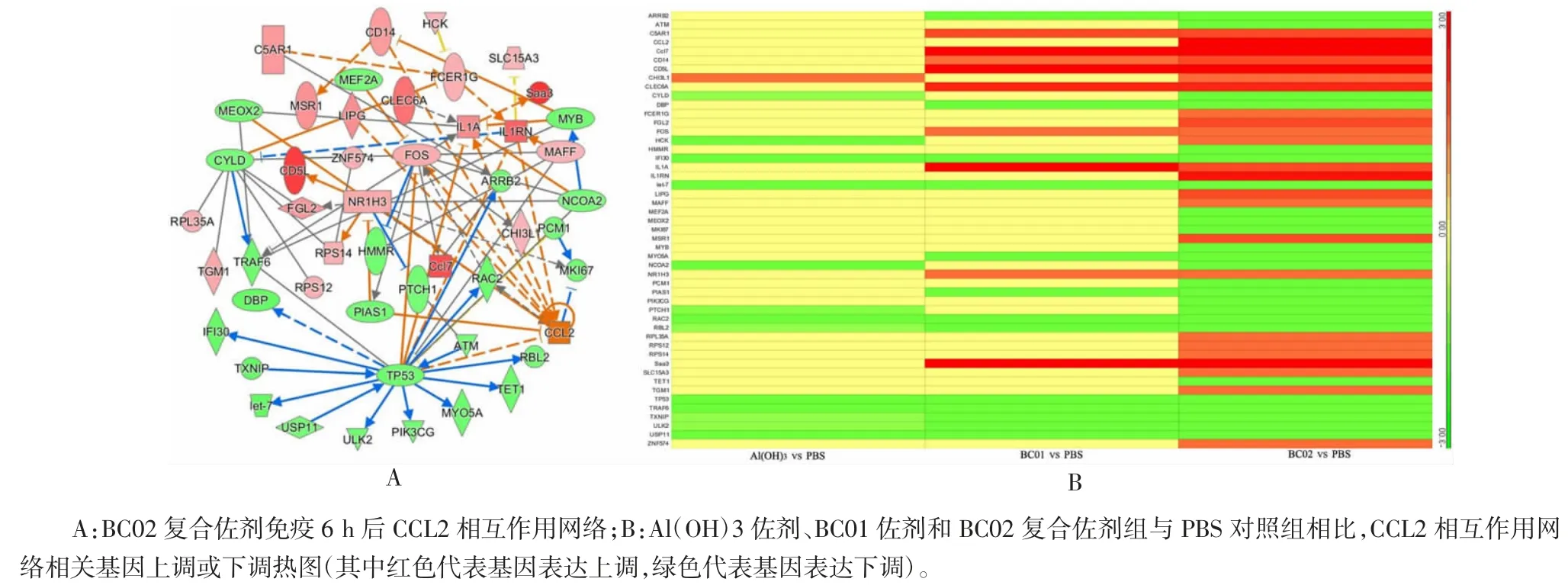
图8 BC02 复合佐剂成分对CCL2 相互作用网络激活的协同增强作用Fig. 8 BC02 compound adjuvant components synergistically enhance activation of CCL2-interaction network
3 讨 论
多数临床或实验用途的佐剂长期以来一直被认为在诱导免疫应答过程中充当免疫刺激剂、抗原贮库或被动媒介物的角色。尽管有些佐剂本身就是固有免疫应答的刺激成分(如细胞因子佐剂等)或绕过固有免疫应答受体的介导而直接激活信号途径(如毒素等),但大多数免疫佐剂往往均是充当模式识别受体(pattern recognition receptor,PRR)的配体,首先参与固有免疫应答的激活。目前,人们对复合佐剂的研究越来越多,但在免疫增强效应方面,不同复合佐剂的免疫刺激效果不同,同一复合佐剂也因佐剂成分的配比不同而在免疫效果上具有显著差异。这一方面为复合佐剂提供了巨大的研究空间,另一方面也提醒研究者,复合佐剂成分是否存在协同增强作用是复合佐剂研究能否不断深入的关键。
临床批准的传统Al(OH)3佐剂主要通过形成抗原的长效存储库或通过促进APC 对抗原的摄取来起作用,但事实上更多的研究表明,固有免疫应答中NLRP3 炎性体的激活以及引发细胞坏死性凋亡和内源性危险信号尿酸的释放,在Al(OH)3佐剂活性中起更主要的作用[17-19]。Al(OH)3佐剂主要诱导高度极化的Th2 型细胞免疫应答,几乎所有的蛋白质抗原均形成Th2 型细胞依赖性抗体同型反应,但其并不依赖TLR 的存在来增强机体抗体的产生[20]。BC01 生物佐剂则是一种从减毒牛型结核分枝杆菌中提取的富含未甲基化CpG 基序的天然CpG-DNA[21]。我们在前期研究中发现,其通过TLR-9 受体的介导激活固有免疫应答中NF-κB 和MAPKs 信号通路,诱导巨噬细胞TNF-α 和MCP-1 的产生及增强细胞表面分子 MHC-Ⅱ、CD40、CD80 和 CD86 的表达[22]。此外,BC01 佐剂同Al(OH)3佐剂一起使用能够明显逆转铝佐剂诱导的Th2 型免疫反应[23],且体外细胞试验也发现两者具有协同增强巨噬细胞参与固有免疫应答的作用[16]。
本研究采用全基因表达谱方法比较复合佐剂BC02 及其组成成分Al(OH)3佐剂和BC01 佐剂在免疫6 h 后对机体固有免疫应答激活的作用,通过GO 富集和信号通路网络分析后发现,BC02 复合佐剂组成成分具有协同增强免疫细胞活化网络激活及免疫细胞招募信号网络激活作用。含佐剂类疫苗注射后,注射部位形成局部炎症反应,在多种细胞因子和趋化因子的作用下,各类免疫细胞开始向注射部位浸润,激活抗原提呈细胞(antigen presen-ting cell,APC)并加速抗原摄取和提呈。注射部位中性粒细胞、嗜酸 / 碱性粒细胞和单核巨噬细胞等炎细胞浸润是固有免疫应答启动的第一步,被招募的炎性细胞在外源物质诱导下上调MHC-Ⅱ分子的表达,加速抗原片段提呈给CD4+T 细胞,从而激活适应性免疫应答。病理切片分析可见,BC02 复合佐剂注射部位肌肉组织HE 染色和免疫组化结果均表明其对炎性细胞的招募能力显著高于单一佐剂Al(OH)3和BC01,且该结果与上述小鼠表达谱芯片中免疫细胞活化及招募信号网络激活相一致。单核巨噬细胞系统除具有直接吞噬和杀伤病原体的功能,还具有参与抗原加工、递呈免疫调节的重要作用,吞噬功能的变化对于判断佐剂免疫后机体单核巨噬细胞的功能,了解机体非特性免疫状态具有重要意义。本研究发现,BC02 复合佐剂免疫后巨噬细胞吞噬功能显著增强,且效果优于单一佐剂。此外,TNF-α 信号通路网络激活和CCL2 相互作用网络激活,与前期体外细胞试验中BC02 复合佐剂成分协同增强巨噬细胞活化,促进高水平TNF-α 和MCP-1 细胞因子产生的结果相一致[16]。
综上所述,本研究结果表明,构成复合佐剂BC02的Al(OH)3无机盐佐剂与BC01 生物佐剂在激活机体固有免疫应答上具有协同加强作用。这些结果不仅进一步验证了前期的体外细胞试验,而且更好地从体内水平了解复合佐剂BC02 的免疫调节机制,对于加速该系列佐剂的临床应用起到重要支撑作用。

