乐伐替尼脂质体的制备及处方工艺优化研究
周艳艳,朱柯武,沈润溥,袁喜英,骆 翔*
(1.绍兴文理学院,浙江 绍兴,312000;2.浙江创新生物有限公司,浙江 绍兴,312000)
全球范围内,肝癌的死亡率在所有恶性肿瘤中排在第二位[1-2],而晚期肝癌的愈后效果尤其不好[3]。因此,开发一种肝癌靶向药物,尤其是针对晚期肝癌的靶向药物具有重大社会和经济效益。

Fig.1 The structure of Lenvatinib图1 乐伐替尼化学结构式
乐伐替尼(Lenvatinib,Len)(图1)是一种多靶点酪氨酸激酶抑制剂,可作用于血管内皮生长因子受体 1~3 型(VEGFR 1~3)、成纤维细胞生长因子受体 1~4 型(FGFR 1~4)、RET、KIT以及血小板衍生生长因子受体 α(PDGFR-α)等产生新生血管抑制和抗肿瘤作用[4-5]。2015 年2月,由日本卫材公司研发甲磺酸乐伐替尼胶囊——乐卫玛(LenvimaTM)成功获得 FDA 批准用于晚期放射性-碘难治性分化型甲状腺癌的治疗[6],随后又相继批准用于肾癌联合用药治疗和肝癌的临床一线用药[5]。乐伐替尼是肝癌新药中最耀眼的明星,其临床客观缓解率是索拉非尼的 327%(40.6%vs12.4%),无进展生存期是索拉非尼的 203%(7.3 个月vs3.6 个月)[7];相较于索拉菲尼,针对中国肝癌患者的总生存期提高了 5 个月(15 个月vs10.2 个月,P= 0.02620)[8]。因此,乐伐替尼显著优于上一代肝癌靶向药物索拉菲尼。
尽管乐伐替尼的临床效果优异,但其仍存在一些不良反应。乐伐替尼胶囊(LenvimaTM)需要通过口服给药,易出现消化道不良反应,例如:口腔炎、腹泻、呕吐等,严重者导致消化道出血,甚至胃肠道穿孔和瘘道形成[9-10]。有研究报道,部分患者使用乐伐替尼出现了高血压和动脉血栓栓塞等不良反应[11],只能选择降低给药频率或更换其他药物。因此,亟需开发一种生物相容性好、肿瘤靶向性高的新型乐伐替尼药物制剂。
脂质体(Liposome)是由磷脂和(或)胆固醇为基本膜材构建而成具有类似生物膜双分子层结构的封闭囊泡[12]。脂质体已在药物递送系统中得到了广泛的应用,其具有良好的生物相容性、生物可降解性、无毒无免疫原性等优势[13-14],尤其是脂质体可以利用单核吞噬细胞系统(Mononuclear phagocyte system,MPS)被动靶向肝脏[15-16]。
本研究采用被动载药和主动载药两类工艺制备 Len 脂质体,以 Len 脂质体包封率和体外释放为指标,通过处方工艺优化筛选出最优制备方法,为 Len 脂质体的产业化开发提供研究基础与科学依据。
1 材料和方法
1.1 药物与试剂
甲磺酸乐伐替尼(Lenvatinib mesylate,Len,济南凯恩医药科技有限公司,HPLC 纯度 ≥ 99%,批号:190401);氢化大豆磷脂(Hydrogenated soybean phospholipids,HSPC,德国Lipoid GmbH公司,批号:525600-2180653-01/026-031(6));胆固醇(Cholesterol,CH,上海艾韦特医药科技有限公司,批号:B40333);葡聚糖凝胶 G50(Sephadex G50,北京索莱宝科技有限公司,批号:S8151);氯型 717 型阴离子交换树脂(国药集团化学试剂有限公司,批号:20180309);柠檬酸(C6H8O7·H2O,西陇化工股份有限公司,批号:1029054-01-09);磷酸钠(Na3PO4,天津希恩思生化科技有限公司,批号:S-42550);磷酸二氢钾(KH2PO4,上海麦克林生化科技有限公司,批号:P815662);氢氧化钠(NaOH,上海麦克林生化科技有限公司,批号:S817968);异丙醇(C3H8O,上海麦克林生化科技有限公司,批号:I811925);无水乙醇(C2H6O,上海麦克林生化科技有限公司,批号:E809061);甲醇(CH4O,上海麦克林生化科技有限公司,批号:M813907);其余试剂均为分析纯。
1.2 仪器
DF-101S 集热式恒温加热磁力搅拌器(巩义英峪予华仪器厂);RE-52CS-1 旋转蒸发仪(上海亚荣生化仪器厂);JY92-IIN 超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);TG16-WS型台式高速离心机(湖南湘仪离心机仪器有限公司);UV2700 紫外可见分光光度计(岛津企业管理(中国)有限公司);Zetasizer Nano ZS90 马尔文激光粒度仪(英国马尔文仪器有限公司);JEM-1011 透射电子显微镜(日本电子株式会社);Agilent 1200 高效液相色谱(HPLC)及其色谱工作站测定(美国安捷伦科技有限公司);C18 色谱柱(5 μm,250 mm×4.6 mm,迪马科技有限公司);SYWF-50 水浴恒温震荡器(天津莱玻特瑞仪器设备有限公司);TopPette 微量移液器(北京大龙兴创实验仪器有限公司);透析袋(截留分子量 10 kDa,美国光谱医学公司)。
1.3 Len 紫外检测波长测定与标准曲线建立
首先,采用异丙醇 / 水(90 / 10,v/v)配制 Len 药物溶液,药物浓度为 0.1 mg/mL。然后,以异丙醇 / 水(90 / 10,v/v)作为空白溶剂,利用 UV2700 紫外分光光度计对 0.1 mg/mL 的 Len药物溶液进行 200~800 nm 全波长扫描,确定最适 Len 紫外检测波长。
精密称定 Len 原料药 10.0 mg,置于 100 mL 量瓶中,以异丙醇/水(90 / 10,v/v)溶解并稀释至刻度,制成质量浓度为 100 μg·mL-1的 Len 溶液作为储备液。分别精密移取储备液 0.5、1.0、2.0、3.0、4.0 mL 置于 10 mL 量瓶中,以异丙醇/水(90 / 10,v/v)稀释至刻度,即得质量浓度分别为 5.0、10.0、20.0、30.0、40.0 μg·mL-1的 Len 系列标准溶液。在最适波长处测定吸光度值,并以 Len 溶液吸光度(A)对 Len 浓度(C, μg·mL-1)进行线性回归,建立标准曲线。
1.4 被动载药工艺
为了便于比较,若无特殊说明,统一采用经典的脂质体处方,其组成为 HSPC / CH / Len =100 mg / 33 mg / 5 mg,制备 10 mL 脂质体,考察以下 3 种的 Len 脂质体制备工艺。
1.4.1 薄膜分散法
精密称定处方量的 HSPC 和 CH 置于 500 mL 圆底烧瓶中,加入 10 mL 无水乙醇,完全溶解 HSPC 和 CH 之后,在 65 ℃ 水浴加热,转速为 30 rpm,真空度为 0.09 MPa 条件下,旋转蒸发除去无水乙醇,在圆底烧瓶壁上形成脂质膜;然后,精密称定 10 mg Len,完全溶解于10 mL含有 10% 乙醇的水溶液中,将 Len 溶液加入圆底烧瓶中,在转速为 30 rpm,室温常压条件下水化脂质膜 30 min;利用超声波细胞粉碎仪分散脂质体,采用 100W 分散 2 min,200W 分散 4 min,将脂质体通过 0.8 μm 微孔滤膜整粒,即得 Len 脂质体。
1.4.2 逆相蒸发法
精密称定处方量的 HSPC 和 CH 置于 500 mL 圆底烧瓶中,加入 30 mL 二氯甲烷/异丙醚混合溶剂(50 / 50,v/v),完全溶解 HSPC 和 CH;然后,精密称定 10 mg Len,完全溶解于 10 mL含有 10% 乙醇的水溶液中,将 Len 溶液加入圆底烧瓶中,在水浴超声中快速振摇分散,形成W / O 型乳剂;在 65 ℃ 水浴加热,转速为 30 rpm,真空度为 0.09 MPa 条件下,旋转蒸发完全除去有机溶剂,采用蒸馏水稀释脂质体至 10 mL;利用超声波细胞粉碎仪分散脂质体,采用 100 W分散 2 min,200 W 分散 4 min,将脂质体通过 0.8 μm 微孔滤膜整粒,即得 Len 脂质体。
1.4.3 改良乙醇注入法
精密称定处方量的 HSPC 和 CH 置于 25 mL 西林瓶中,加入 0.5 mL 无水乙醇,在恒温加热磁力搅拌器 65 ℃ 水浴加热,完全溶解 HSPC 和 CH,加入磁力搅拌子,挥发除去大部分乙醇;然后,精密称定 10 mg Len,完全溶解于 10 mL 含有 10% 乙醇的水溶液中,将加热至 65℃的 Len 溶液快速加入西林瓶中;在 65 ℃ 水浴,60 rpm 转速条件下,孵育 20 min;利用超声波细胞粉碎仪分散脂质体,采用 100 W 分散 2 min,200 W 分散 4 min,将脂质体通过 0.8 μm微孔滤膜整粒,即得 Len 脂质体。
1.5 pH 梯度法
pH 梯度法制备 Len 脂质体时,统一采用经典的脂质体处方,其组成为 HSPC / CH / Len =100 mg / 33 mg / 5 mg,制备10 mL脂质体,考察不同主动载药条件下制备的 Len 脂质体。
首先,采用改良乙醇注入法制备空白脂质体,将处方量的 HSPC 和 CH 置于 10 mL 西林瓶中,加入 0.5 mL 无水乙醇,在恒温加热磁力搅拌器 65 ℃ 水浴加热,完全溶解 HSPC 和 CH,加入磁力搅拌子,挥发除去大部分乙醇;然后,将加热至 65 ℃ 的 200 mM pH 3.0 柠檬酸-柠檬酸钠缓冲液 4 mL 快速加入西林瓶中;在 65 ℃ 水浴,60 rpm 转速条件下,孵育 20 min;利用超声波细胞粉碎仪分散脂质体,采用 100 W 分散 2 min,200 W 分散 4 min,将脂质体通过 0.8 μm微孔滤膜整粒,即得空白脂质体,磷脂浓度为 25 mg/mL。
然后,在冰水浴条件下,使用 Na3PO4溶液将脂质体外水相调节至 pH 7.0,即得梯度脂质体,磷脂浓度为 20 mg/mL。
最后,移取 0.5 mL 梯度脂质体,加入 1 mL Len 溶液(1 mg/mL),以药脂比 1 / 10(w/w)进行载药,在 60 ℃ 下孵育 20 min,采用冰水浴终止载药 3 min,即得 pH 梯度法制备的 Len脂质体。
1.5.1 水化介质浓度
为了比较不同水化介质浓度对 pH 梯度法制备 Len 脂质体的影响,本实验配制了 50、100、200、300、400 mM 的柠檬酸-柠檬酸钠缓冲液作为水化介质制备空白脂质体,其余步骤均按照“1.4”项下进行。
1.5.2 外水相阴离子
为了研究外水相阴离子(柠檬酸根阴离子)对 pH 梯度法制备 Len 脂质体的影响,本实验采用氯型 717 型阴离子交换树脂微柱(柱体积约为 2 mL)置换空白脂质体外水相柠檬酸根阴离子,移取 0.5 mL 空白脂质体上样于阴离子交换树脂微柱顶端,2 000 rpm 离心 2 min,收集洗脱下来的空白脂质体,调节脂质体外水相 pH,制备梯度脂质体,其余步骤均按照“1.4”项下进行。
1.5.3 跨膜 pH 梯度
为了考察不同跨膜 pH 梯度对 pH 梯度法制备 Len 脂质体的影响,本实验通过调节空白脂质体外水相至 pH 4.0、5.0、6.0、7.0、8.0,即分别制备跨膜 pH 梯度分别为 1.0、2.0、3.0、4.0、5.0 的梯度脂质体,其余步骤均按照“1.4”项下进行。
1.5.4 载药温度
为了研究不同载药温度对 pH 梯度法制备 Len 脂质体的影响,本实验通过调节梯度脂质体载药过程的孵育温度至 30、40、50、60、70 ℃,其余步骤均按照“1.4”项下进行。
1.5.5 药脂比
为了考察不同药脂比对 pH 梯度法制备 Len 脂质体的影响,本实验通过调节梯度脂质体载药过程中 Len / HSPC 的比例至 1/5、1/10、1/20、1/30、1/40(w/w),其余步骤均按照“1.4”项下进行。
1.6 Len 脂质体包封率测定[17]
采用葡聚糖凝胶 G50 制备成凝胶微柱(柱体积约为 1 mL)离心法测定 Len 脂质体包封率。移取两份 100 μL Len 脂质体,一份直接置于 5 mL 量瓶中,加 200 μL 蒸馏水,加入异丙醇 / 水(90 / 10,v/v)至刻度并摇匀,采用紫外分光光度计于 260 nm 处测定吸光度,记为 Abefore;另一份上样于葡聚糖凝胶 G50 微柱顶端,2 000 rpm 离心 2 min,继续加 100 μL 蒸馏水于柱顶端,2 000 rpm 离心 2 min 洗脱,连续操作 2 次合并洗脱液,将合并洗脱液转移至 5 mL 量瓶中,加入异丙醇/水(90 / 10,v/v)破乳并稀释至刻度摇匀后,采用紫外分光光度计于最适吸收波长处测定吸光度,记为 AafterLen 脂质体包封率(Encapsulation efficiency,EE)。计算公式为:
EE(%) = Aafter/ Abefore× 100%
1.7 粒径和 Zeta 电位测定[18]
取适量 Len 脂质体,经蒸馏水稀释后移取 1.5 mL 于样品池内,采用基于动态光散射原理的Zetasizer nano ZS90 粒径测定仪测定脂质体的粒径;然后,将稀释完的样品装入 Zeta 电位样品池中,利用 Smoluchowski 方程将测得的微粒迁移率转换为Zeta电位。
1.8 微观形态表征
将 Len 脂质体稀释至磷脂浓度 10 mg/mL,吸取 20 μL 脂质体滴加在覆盖碳膜的铜网上,用2%(w/v)磷钨酸进行负染 1 min,用滤纸吸取剩余液体,红外灯下烘干后,置于透射电镜下观察 Len 脂质体的微观形态并拍照。
1.9 体外释放性质考察
分别精密移取含有 2 mg Len 的游离 Len 溶液(Len-S)、被动载药 Len 脂质体(Len-PCL)、主动载药 Len 脂质体(Len-R-CL),分别加入至透析袋中,两端夹好后,置于 100 mL释放介质(含有 0.5% (w/v) Tween 80 的 10 mM PBS)中,在 37 ± 2℃ 恒温、避光、20 rpm条件下水浴恒温震荡孵育。分别于 0、0.5、1、2、4、8、12、24 h 分别吸取 1.0 mL 透析液,并补加等量同温空白释放介质。
透析液用 0.45 μm 的微孔滤膜过滤,取续滤液用 HPLC 法测定其中药物浓度。采用 0.05 mM KH2PO4(磷酸调节至 pH 3.0)水溶液与甲醇比例为 30 : 70(v/v)作为流动相[19],Diamonsil C18色谱柱作为固定相,利用安捷伦 1200 HPLC 系统对透析液中的 Len 进行分离和检测。
根据透析液中的药物浓度计算制剂的累计药物释放量,计算公式如下:
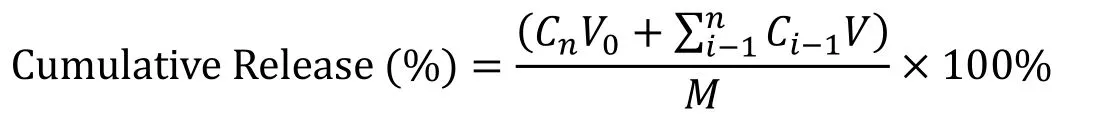
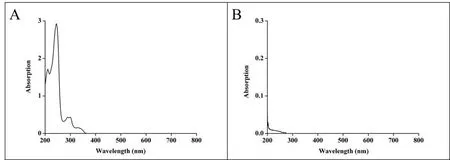
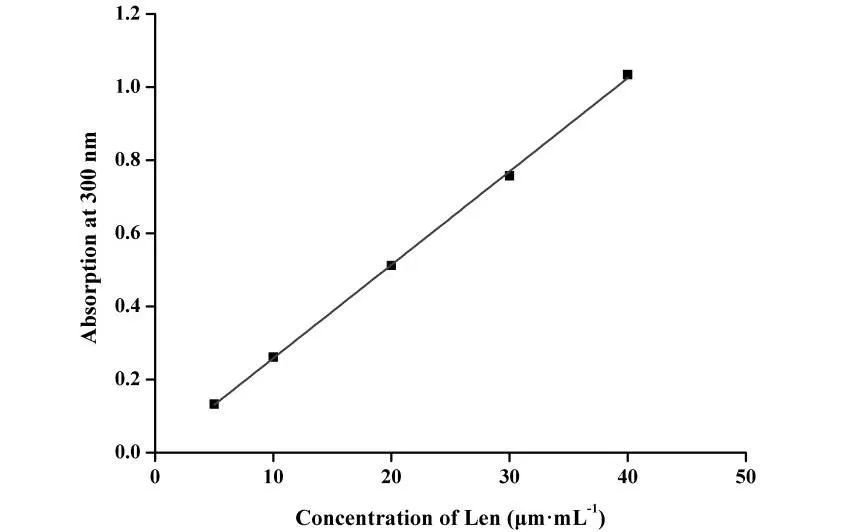
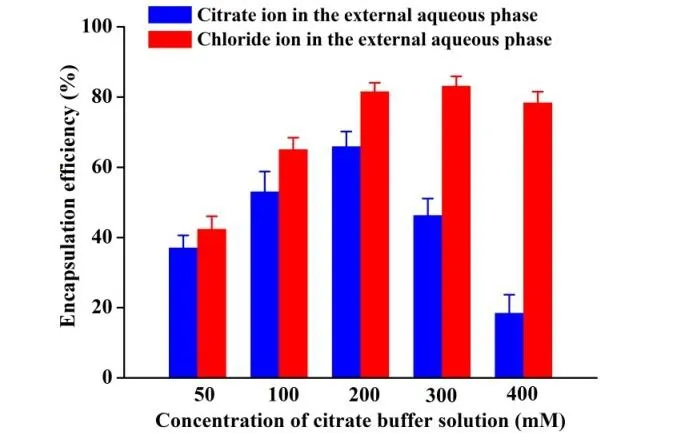
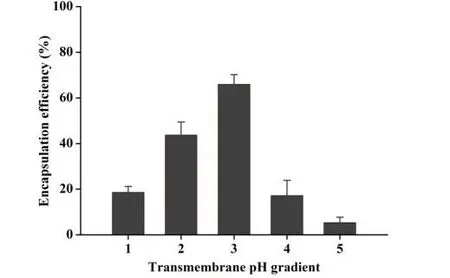
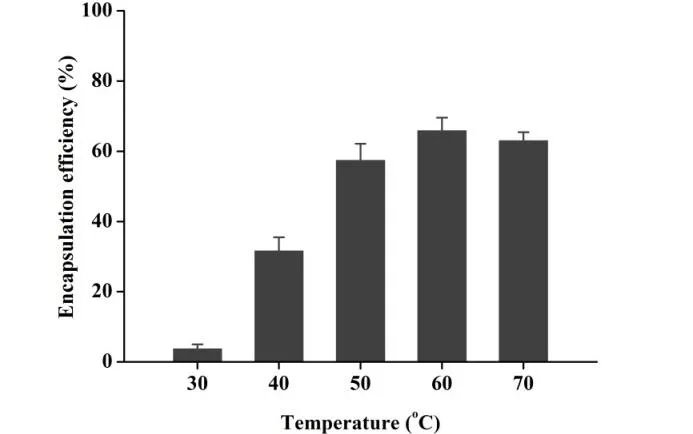
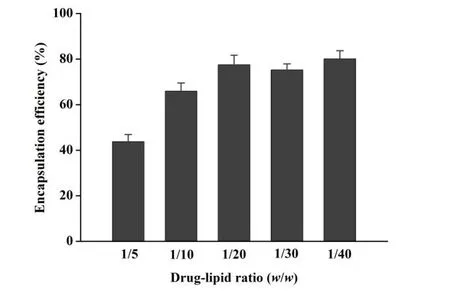
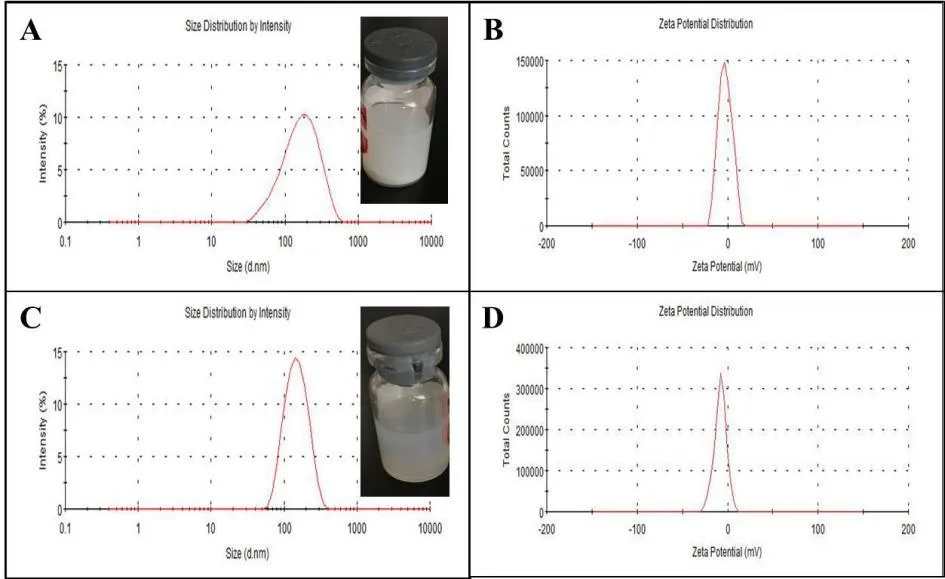
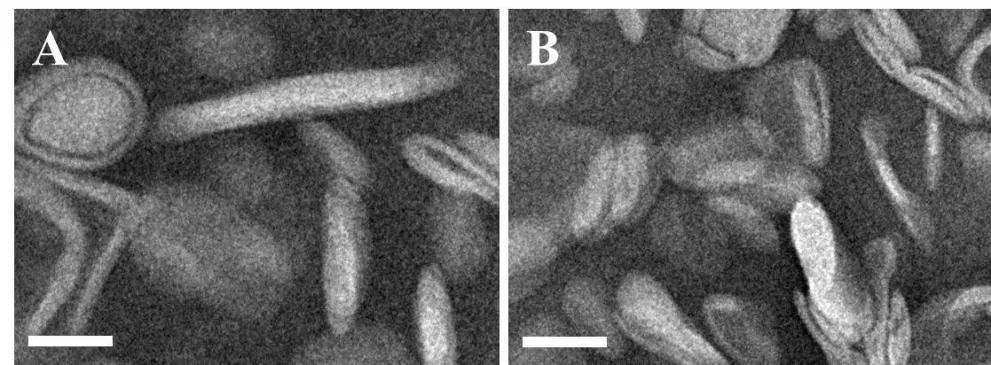
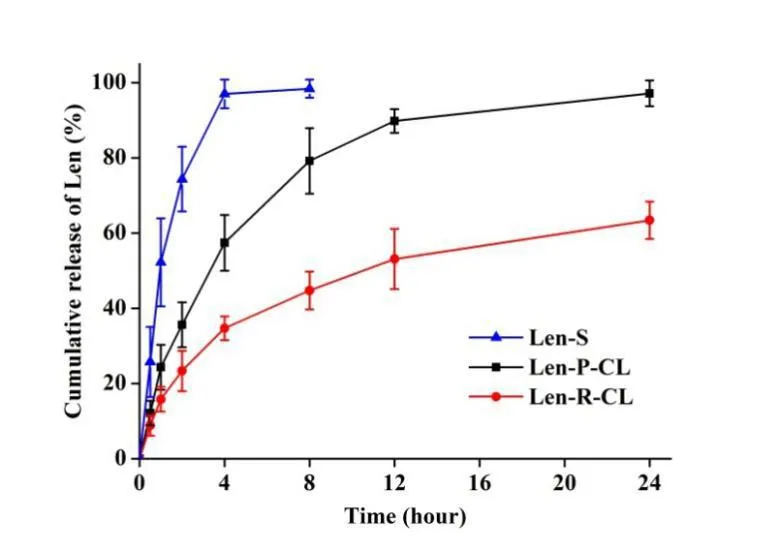
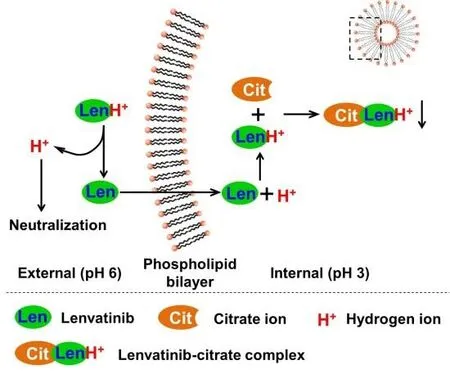
V0为释放介质体积,V为取样体积,Cn为第 n 次取样时浓度,M为药物总量,1 如图2A 所示,Len 异丙醇溶液与空白脂质体异丙醇溶液的 200~800 nm 紫外扫描结果表明,Len 在 211、245、290、300、329 nm 波长处均有吸收峰,但 223 nm 波长较短,存在末端吸收干扰;如图2B 所示,空白脂质体在 245 nm 波长下存在紫外吸收,存在药物辅料干扰。因此,在 Len 不受干扰的紫外吸收峰中,优选峰值较高的 300 nm 处为最适紫外检测波长。 Fig.2 UV-vis spectroscopy of (A) Len and (B) empty liposomes in the wavelength range from 200 nm to 800 nm图2 (A)Len和(B)空白脂质体200~800 nm紫外可见全波长扫描 如图3 所示,Len 药物溶液在 300 nm 处的标准曲线为:A = 0.0255C + 0.0029,相关系数R = 0.9997,Len 质量浓度在 5.0~40.0 μg·mL-1内线性关系良好。 Fig.3 Standard curve of Len图3 Len标准曲线 采用 3 种被动载药工艺制备 Len 脂质体并测定其包封率,结果如表1 所示。虽然有研究报道逆相蒸发法比较适宜制备水溶性药物,但是逆相蒸发法制备的 Len 脂质体包封率最低,仅为11.3 ± 3.5%。这是由于 Len 在 10% 的乙醇水溶液中具有较好的溶解效果,当乙醇与二氯甲烷、异丙醚等互溶之后,导致水相中的 Len 溶解度下降,并出现颗粒状析出。因此,在逆相蒸发法制备脂质体过程中,大量 Len 没有被有效包封入脂质体,导致包封率较低。薄膜分散法与改良乙醇注入法制备的 Len 脂质体包封率无显著性差异,分别为 23.5 ± 2.7% 和 27.6 ± 3.1%,但薄膜分散法制备过程时间较长,操作繁琐,且在转移脂质体过程中易出现制剂损失。因此,优选乙醇注入法作为 Len 脂质体被动载药工艺。为了保证实验的平行性,主动载药技术也选择乙醇注入法制备空白脂质体。 Table 1 Encapsulation efficiencies and contents of Len liposomes prepared by film dispersion method, reverse phase evaporation method, and modified ethanol injection method (n = 3)表1 薄膜分散法、逆相蒸发法和改良乙醇注入法制备Len脂质体的包封率和药物含量(n = 3) 2.3.1 水化介质浓度 采用 pH 梯度法制备 Len 脂质体,水化介质浓度对脂质体包封率有重要影响[20-21]。如图4所示,随着水化介质浓度从 50 mM 增大到 200 mM 过程中,Len 脂质体包封率先升高后下降的趋势,当水化介质浓度达到 200 mM 时,包封率最高。这可能是由于当柠檬酸-柠檬酸钠缓冲液浓度较低时,脂质体内水相 pH 缓冲能力较弱,随着 Len 不断装载入内水相,内水相 pH 迅速升高,跨膜 pH 梯度下降,pH 梯度法的动力源逐渐丧失,导致 Len 包封率随着水化介质浓度增大而升高;当柠檬酸-柠檬酸钠缓冲液浓度达到和超过 300 mM 时,脂质体外水相中的柠檬酸根离子易与 Len 药物溶液形成低溶解度复合物,不利于 Len 主动载药进入脂质体内水相,导致Len 脂质体包封率随着水化介质浓度继续增大而下降。我们进一步采用氯型阴离子交换树脂将梯度脂质体外水相的柠檬酸根离子置换成氯离子,考察不同外水相阴离子制备 Len 脂质体的包封率[22]。当梯度脂质体外水相阴离子置换成氯离子之后,相较于柠檬酸根离子存在时,各组 Len脂质体包封率提高了 5~60%。 因此,pH 梯度法优选 200 mM 的柠檬酸-柠檬酸钠缓冲液作为水化介质制备空白脂质体,并且载药之前需要将外水相柠檬酸根离子置换成氯离子。 Fig 4 Encapsulation efficiencies of Len liposomes prepared with aqueous medium of different concentrations(n = 3)图4 不同浓度水化介质制备 Len 脂质体的包封率(n = 3) 2.3.2 跨膜 pH 梯度 根据 Henderson-Hasselbalch 理论[23-24],脂质体每个跨膜 pH 单位的变化,会产生分子型与离子型药物浓度 10 倍变化,当达到 3 个单位的跨膜 pH 梯度时,理论上能够将 99.9% 的药物装载入脂质体。 如图5 所示,随着跨膜 pH 梯度的增大,Len 脂质体包封率先升高后下降的趋势,当跨膜pH 梯度达到 3 个单位时,包封率最高。这可能是由于当跨膜 pH 梯度小于 3 个单位时,即当外水相 pH 值小于 6,脂质体外水相呈弱酸性,Len 的溶解度较大,随着跨膜 pH 梯度逐渐增大(内水相 pH 不变,外水相 pH 逐渐增大),极性较小的分子型 Len 比例逐渐增加,Len脂质体载药效率显著提升,包封率增大;但当跨膜 pH 梯度大于 3 个单位时,即当外水相 pH值大于 6,脂质体外水相呈中性或偏碱性,Len 的溶解度急剧下降,随着跨膜 pH 梯度继续增大,Len 大量析出,导致 Len 脂质体包封率快速下降。因此,Len 脂质体的载药过程优选 3 个单位跨膜 pH 梯度。 Fig 5 Encapsulation efficiencies of Len liposomes prepared with different transmembrane pH gradients (n = 3)图5 不同跨膜pH梯度制备Len脂质体的包封率(n = 3) 2.3.3 载药温度 脂质体主动载药过程可以采用经典 Arrhenius 化学动力学方程[25]进行解释。可由dlnk /dT =Ea / RT2式中,k 为速率常数,R 为摩尔气体常数,T 为热力学温度,Ea 为表观活化能。对于同一脂质体主动载药过程,Ea(跨膜活化能)为定值,当T(孵育温度)升高时,k(载药速率)增大,Len 脂质体快速达到载药平衡,但不会增大 Len 脂质体最大包封率[26]。 Fig 6 Encapsulation efficiencies of Len liposomes prepared with different drug loading temperatures (n=3)图6 不同载药温度制备 Len 脂质体的包封率(n = 3) 如图6 所示,随着载药温度的增大,Len 脂质体包封率先升高后稳定的趋势。由于载药温度较低时,Len 分子热运动不足以克服 Ea(跨膜活化能),无法有效装载入脂质体,包封率较低;随着载药温度逐渐升高,一方面,Len 分子动能增大,Len 具备较强的跨膜能力,另一方面,HSPC的相变温度为 55 ℃ 左右[12],当载药温度超过相变温度,脂质体膜的流动性显著增强,更加有利于 Len 进入脂质体。然而,磷脂分子易在高温下氧化和降解,因此,优选 60 ℃ 作为Len 脂质体的载药温度。 2.3.4 药脂比 按“1.4”项下操作步骤,以 Len / HSPC 比例 1/5、1/10、1/20、1/30(w/w)进行主动载药,结果如图7 所示。随着药脂比的降低,Len 脂质体的包封率逐渐升高,但当药脂比达到 1/20 之后,包封率基本不变。因此,Len 脂质体优选以 1/20(w/w)药脂比进行主动载药。 Fig.7 Encapsulation efficiencies of Len liposomes was prepared with different drug-lipid ratio (n=3)图7 不同药脂比制备 Len 脂质体的包封率(n=3) 2.3.5 主动载药 Len 脂质体最优处方工艺 经过一系列单因素考察,确定主动载药 Len 脂质体的最优处方工艺为:脂质体处方组成为HSPC / CH / Len = 100 mg / 33 mg / 5 mg,采用 200 mM pH 3.0 柠檬酸-柠檬酸钠缓冲液作为水化介质,利用氯型阴离子交换树脂将空白脂质体外水相柠檬酸根离子置换成氯离子,使用 Na3PO4溶液将脂质体外水相调节至 pH 6.0,即得梯度脂质体;然后,按 Len / HSPC = 1/20 (w/w)混合梯度脂质体和 Len 药物溶液,在 60 ℃ 下孵育载药 20 min,采用冰水浴终止载药 3 min,即得 pH梯度法制备的最优 Len 脂质体,其包封率达到 91.8 ± 2.1%,药物含量为 0.92 ± 0.02 mg·mL-1。 采用马尔文激光粒度仪分别对被动载药工艺(改良乙醇注入法)和主动载药技术(pH 梯度法)制备的 Len 脂质体平均粒径、粒径分布与Zeta电位进行测定。如图8A 和 8C 所示,被动载药工艺与主动载药技术制备的 Len 脂质体平均粒径分别为 191.3 ± 15.2 nm 和 134.8 ± 7.5 nm,多分散系数 PDI 分别为 0.327 和 0.113。因此,主动载药法制备的 Len 脂质体粒径较小且均一。如图8B 和 8D 所示,被动载药工艺与主动载药技术制备的 Len 脂质体具有相似的Zeta电位,分别为 -7.7 ± 3.1 mV 和 -12.6 ± 2.3 mV。 Fig.8 The (A and C) sizes and (B and D) Zeta potentials of Len liposomes (A and B:Passive loading method;C and D:Remote loading method)图8 Len脂质体的(A和C)粒径和(B和D)Zeta电位(A和B:被动载药;C和D:主动载药) Len 脂质体透射电子显微镜成像结果如图9 所示。脂质体为球形或椭球形封闭囊泡,具有明显的磷脂双分子层结构,典型大单室脂质体,Len 脂质体的平均粒径与马尔文激光粒度仪测定的数据基本一致。 Fig 9 Transmission electron microscopy images of Len liposomes (A:Passive loading method;B:Remote loading method), the scale bars indicate 100 nm图9 Len 脂质体透射电子显微镜成像(A:被动载药;B:主动载药),标尺为100 nm 如图10 所示,Len 溶液与被动载药工艺制备的 Len 脂质体分别在 4 h 和 12 h 内完全释放药物,而主动载药技术制备的 Len 脂质体在 24 h 内仅释放 63% 的药物。结果表明,两种 Len脂质体较 Len 溶液均表现出明显的缓释特征,主动载药法制备的 Len 脂质体释放较缓慢,且稳定性较好,具备后续开发潜力。 Fig 10 In vitro release profiles of Len liposomes (Len-S: free Len solution,Len-P-CL: Len liposome prepared by passive loading method,Len-R-CL: Len liposome prepared by remote loading method)图10 Len脂质体的体外释放(Len-S:Len溶液,Len-P-CL:被动载药Len脂质体,Len-R-CL:主动载药Len脂质体) 被动载药工艺制备的 Len 脂质体,脂质体的内外水相中 Len 的浓度基本一致。因此,脂质体包封体积的大小直接决定了被动载药脂质体的包封率。有研究报道,脂质体内水相体积一般小于 20%[27],直接导致了被动载药脂质体包封率较低。主动载药技术是脂质体技术的重要突破,尤其是成功产业化的 pH 梯度法[28]。如图11 所示,首先,在近中性(pH 6.0)的脂质体外水相中,离子态的 LenH+逐渐失去 H+,形成分子态的 Len;由于 Len 的极性较小,分子热运动促使 Len可以自由通过疏水性的磷脂双分子层,当 Len 进入内水相时,酸性环境(pH 3.0)使其快速质子化形成离子态 LenH+;紧接着,离子态的 LenH+能够与柠檬酸根离子(Citrate ion, Cit)迅速形成低溶解度复合物 CitLenH+,导致 Len 被稳定的装载于脂质体内水相。根据化学平衡移动原理[29],游离的 Len 分子不断自发从高浓度的外水相涌入低浓度的内水相,通过 LenH+-Len-LenH+-CitLenH+途径装载入脂质体,从而形成高包封率的 Len 脂质体。虽然主动载药技术制备的 Len脂质体内水相表观 Len 浓度远大于外水相,但是能够“自由进出”脂质体的游离的 Len 分子浓度在脂质体膜两侧是相似的。 如图4 所示,外水相阴离子对主动载药过程影响较大,尤其是当高浓度水化介质状态下。由图11 可知,当药物加入脂质体外水相,离子态的 LenH+一方面去质子化形成分子态的 Len,其极易跨膜进入脂质体内水相;另一方面能够与 LenH+外水相的 Cit 结合,形成低溶解度复合物CitLenH+,导致药物无法跨膜进入脂质体。当外水相 Cit 置换成 Cl-之后,不影响 LenH+的溶解情况,从而成功制备高包封率的 Len 脂质体。 由于 Len 在纯水中的溶解度较小,我们通过向释放介质中加入 0.5% (w/v) Tween 80[30],从而达到 Len 的漏槽条件。实验用透析袋的截留分子量为 10 kDa,游离药物可以自由扩散通过。因此,Len 药物溶液可以快速完全释放。然而,脂质体膜会大大降低 Len 的扩散速率,表现为Len 脂质体的缓释效应。被动载药工艺制备的 Len 脂质体,Len 主要以离子型 LenH+形式分布于内水相和分子型 Len 形式分布于磷脂双分子层,药物通过浓度梯度扩散,释放过程相对较快;由图11 可知,主动载药技术制备的 Len 脂质体,药物以低溶解度复合物 CitLenH+稳定包封于脂质体内水相,LenH+和 Len 的浓度均较低,导致 Len 释放较慢。 Fig.11 Drug loading mechanism of Len liposomes prepared by pH gradient method图11 pH 梯度法制备 Len 脂质体的载药机制2 结果
2.1 Len紫外检测波长的确定和标准曲线的建立
2.2 被动载药 Len 脂质体制备工艺的确定

2.3 主动载药 Len 脂质体制备工艺的确定
2.4 Len 脂质体的粒径和 Zeta 电位
2.5 Len 脂质体微观形态
2.6 Len 脂质体体外释放性质
3 讨论
3.1 主动载药高包封率的原因
3.2 外水相阴离子对主动载药过程的影响
3.3 Len 药物溶液、被动载药 Len 脂质体与主动载药 Len 脂质体释放速率的差异
- 中国药剂学杂志(网络版)的其它文章
- 治疗2型糖尿病的黄连解毒汤制剂改良及药效学评价
- 不同产地黑枸杞中总酚含量的比较研究

