谷子光敏色素家族基因的生物信息学及表达模式分析
申慧敏,吴年隆,王亚敏,王兴春
(1.山西农业大学生命科学学院,山西 太谷 030801;2.山西农业大学基础部,山西 太谷 030801)
光在植物生长发育各个阶段起重要的调控作用,植物中诸如种子萌发、向光性生长、光呼吸和光合作用等生理生化现象都与其密切相关。植物通过光受体感知光信号,通过信号转导,调节基因表达,控制细胞分裂、分化与生长,最终调控器官发育和形态建成,其中,光受体在这个过程中起重要调节作用[1]。光敏色素是一类能吸收红光与远红光,且可相互转化的色素蛋白,可分为光不稳定型的类型Ⅰ光敏色素(typeⅠphytochrome,PⅠ)和光稳定型的类型Ⅱ光敏色素(typeⅡphytochrome,PⅡ),无论是单子叶植物还是双子叶植物,PⅠ由PHYA编码,PⅡ由非PHYA的光敏色素基因编码[2]。研究表明,光敏色素与植物的避阴反应和抽穗开花期相关,此外,光敏色素还参与了形态建成、诱导多种酶的合成、植物激素代谢等生理过程[3-5]。
光敏色素存在植物的各个组织中,生理作用广泛,调节植物从生长发育到衰老的形态建成。近年来,光敏色素的功能相继被解析出来。启动光敏色素信号的第1 步是通过PHYA 感知远红光或PHYB-PHYE 感知红光来改变Pr 和Pfr 的构象,光活化后,光敏色素从细胞质转移至细胞核[6-7]。激活后的光敏色素复合体与下游作用因子PIFs 和COP1-SPA相互作用[8]。PIFs是bHLH转录因子,在光敏色素介导的信号网络中起枢纽作用[9],光敏色素与核内的PIFs 相互作用,诱导PIFs 磷酸化,并通过泛素26S 蛋白酶降解蛋白,因此,光敏色素通过降解光形态发生的负调控因子PIFs 来介导光形态发育[10]。此外,KOZUKA等[11]研究发现,光敏色素通过协调油体脂质的降解及其代谢产物糖的产生,参与去黄化过程中子叶变绿过程,在植物去黄化过程中起到关键作用。LI 等[12]研究发现,玉米中的ZMPYC1和ZMPYC2基因可调控植株开花时间和株型结构,为耐密玉米品种的选育提供了新思路和理论基础。XIN 等[13]研究发现,光敏色素信号(SFPS)剪接因子能与光受体光敏色素B 直接相互作用响应光信号,通过调控光信号AAA 传导和昼夜节律基因mRNA 前体的剪接来调节光介导的植物发育过程。
谷子(Setaria italica)是世界上最古老的驯化作物之一,与其他作物相比,其具有许多优良性状,包括抗旱、耐贫瘠,C4高光效,在旱作可持续生态农业建设中具有重要作用[14-16]。然而,鲜见有关对SiPHY基因家族成员及功能的研究报道。
本研究利用生物信息学方法鉴定分析谷子中PHY基因家族成员及其在不同光周期条件下的表达模式,有助于研究光敏色素与谷子光敏感性间的关系。
1 材料和方法
1.1 试验材料
供试材料有野生型晋谷21、黄粟、大同红谷和早熟突变体xiaomi(晋谷21 的EMS 诱变突变体)、xiaomi3(黄粟的自然诱变突变体)、xiaomi4(大同红谷的自然诱变突变体)。
1.2 试验方法
1.2.1SiPHY基因家族序列鉴定及理化性质分析从拟南芥(Arabidopsis thaliana)数据库TAIR(https://www.arabidopsis.org/)中获得5个PHY家族成员(At-PHY)的蛋白序列,在Phytozome 数据库(https://phytozome.jgi.doe.gov/pz/portal.html)中下载水稻、高粱、玉米和狗尾草的基因组数据,在谷子多组学数据库(http://sky.sxau.edu.cn/MDSi.htm)下载谷子xiaomi的基因组数据。利用拟南芥AtPHY 蛋白序列通过Bio Edit 软件中的Local BLAST 程序筛选xiaomi、水稻、高粱、玉米和狗尾草的PHY 蛋白序列,筛选不稳定条件为E-value<10e-10,并利用Pfam(http://pfam.xfam.org/)进行结构域验证。最后利用在线网站ExPASy(https://web.expasy.org/protparam/)对谷子SiPHY 蛋白的氨基酸数目、分子质量、等电点(PI)、不稳定系数和脂肪系数等理化性质进行预测。
1.2.2SiPHY基因家族进化分析 将1.2.1 中筛选鉴定到的谷子、拟南芥、水稻、高粱、玉米和狗尾草的PHY基因,利用MEGA 7.0 软件中的Align By Muscle 程序对6 种不同物种的PHY 家族成员的蛋白序列进行多序列比对,并采用邻接法(NJ)构建系统进化树,Bootstrap参数设置为1 000。
1.2.3SiPHY基因家族的保守结构域和基因结构分析 使用在线网站MEME(http://meme-suite.org/tools/meme)预测谷子SiPHY基因的保守基序,Motif数目设置为10,然后利用TBtools 绘制xiaomiPHY家族基因的基因结构和保守基序图。
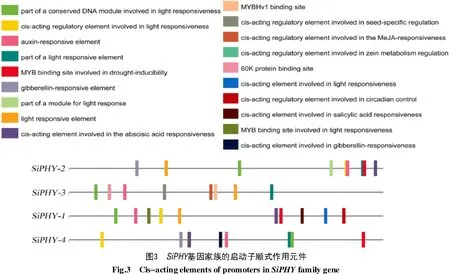
1.2.4SiPHY启动子顺式作用元件分析 在谷子多组学数据库下载谷子PHY 家族各成员的上游2 000 bp 的基因组序列,然后递交至在线网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行启动子顺式作用元件分析;最后利用TBtools 对整理后的功能元件进行可视化操作。
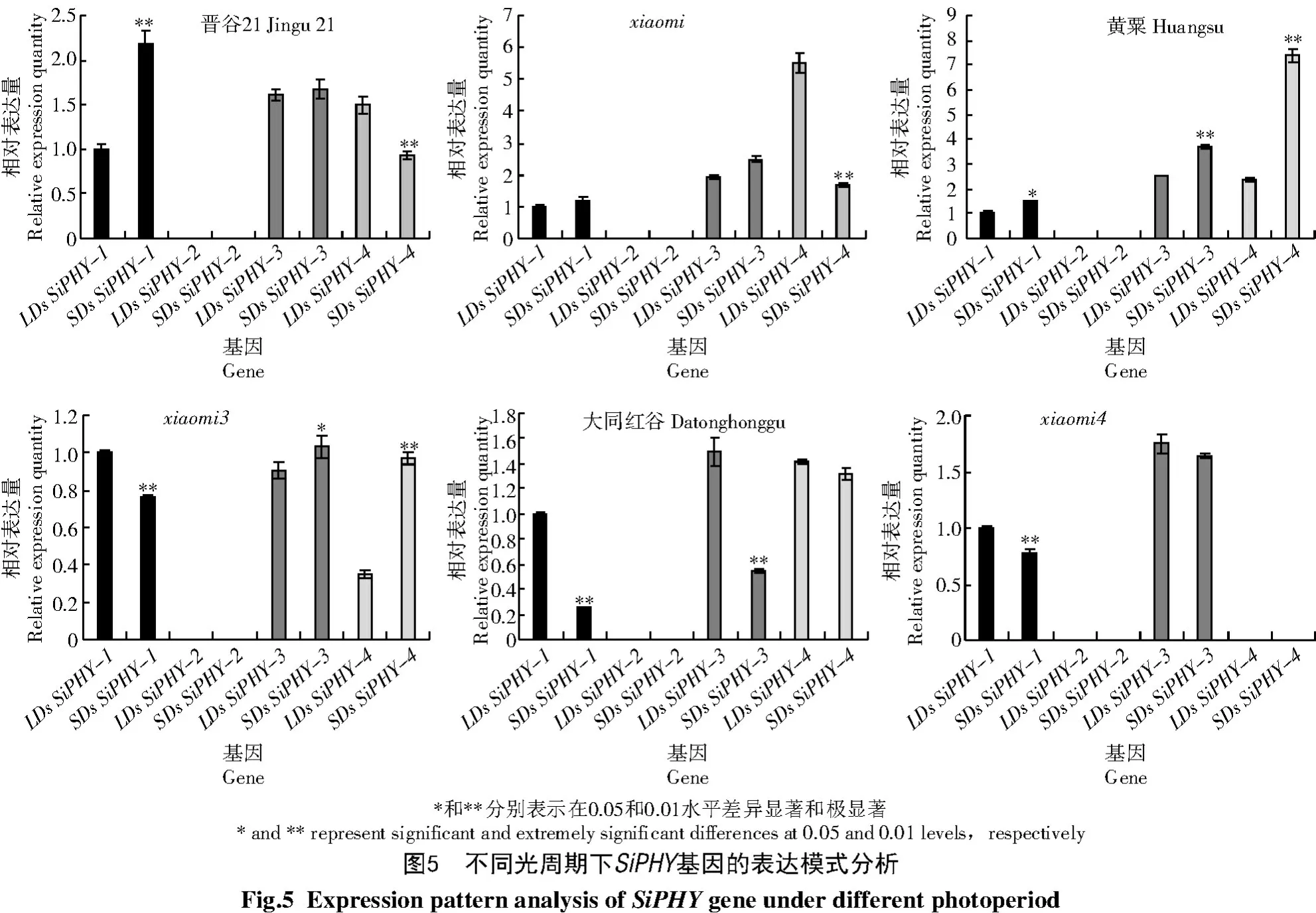
1.2.5 不同光周期下SiPHY基因的表达模式分析利用谷子多组学数据库中的Expression Visualization 工具获取SiPHY基因的表达量及热图,并对其表达谱进行分析。为进一步研究在不同光周期条件下SiPHY基因的表达情况,本研究选用在长日照条件(16 h 光照,28 ℃/8 h 黑暗,22 ℃)和短日照条件(10 h 光照,14 ℃/8 h 黑暗,22 ℃)生长30 d 的野生型晋谷21、黄粟、大同红谷和早熟突变体xiaomi、xiaomi3、xiaomi4的新生叶,用荧光定量PCR(qRTPCR)的方法检测SiPHY基因的表达量。材料种植于恒温培养箱中,光照强度设置为30 000 lx,湿度设置为50%,每7 d浇一次B5营养液。
采用Omega 植物RNA 提取试剂盒R6827-01提取6个品种新生叶片的RNA,采用宝日医生物技术(北京)有限公司的反转录试剂盒PrimeScriptTM RT reagent Kit(货号RR047A)合成cDNA 第一链,TB Green®Premix Ex TaqTM Ⅱ试剂盒(货号RR820A)进行实时定量PCR(real-time quantitative PCR,RT-qPCR),3次生物学重复。15 μL反应体系包括:7.5 μL 2×Taq PCR Master Mix(含荧光染料)、10 μmol/L 上下游引物各0.6 μL、3.3 μL ddH2O 和3 μL cDNA模板。反应条件为:95 ℃2 min;95 ℃5 s,60 ℃30 s,39 个循环。RT-qPCR 引物序列信息如表1 所示。以内参基因Si9g37480为对照,该基因在谷子的11个组织中表达量稳定。利用公式2-ΔΔCt计算基因的相对表达量。

表1 SiPHY实时荧光定量PCR分析引物Tab.1 SiPHY real-time fluorescence quantitative PCR analyze primers
1.3 数据分析
利用BioRad CFX Manager 软件将4个SiPHY基因的RT-qPCR 数据导入到Excel,将重复性差的数据删除,计算出各基因的平均Cq值和相对表达量,将数据整理后采用SPSS 软件进行分析,并在Excel中作图。
2 结果与分析
2.1 SiPHY基因家族的鉴定及其理化性质分析
通过同源序列比对,在谷子xiaomi的PHY家族基因包含4个基因,分别命名为:SiPHY-1、SiPHY-2、SiPHY-3和SiPHY-4,均包含PHY(PF00360)、PAS(PF00989)和GAF(PF01590)结构域,其中,PAS 和GAF形成光感受中心,能够调节发色团的装配和改变突变蛋白的光谱特性[17],PHY结构域在调节光敏色素Pfr 形态稳定性的微调和保证正确的光谱特性、核定位、激酶活性具有重要意义[18-19]。SiPHY-1、SiPHY-3和SiPHY-4分布在9号染色体上,SiPHY-2分布在8号染色体上;cDNA长度为2 373~3 519 bp,编码790~1 172个氨基酸;分子质量在87 118.83~128 453.27 u,等电点在5.81~6.27,除SiPHY-2 外,其余3 个成员亲水性(GRAVY)均为负数,表明它们均属于酸性亲水性蛋白(表2)。

表2 SiPHY基因家族成员基本信息Tab.2 Basic information of SiPHY gene family members
2.2 谷子、水稻、拟南芥、高粱、玉米和狗尾草PHY家族基因的进化分析
为研究谷子SiPHY的进化关系,将拟南芥(5个)和水稻(3个)、高粱(3个)、狗尾草(3个)、玉米(6个)以及谷子(4个)PHY 家族基因构建系统进化树,结果如图1 所示,4 个SiPHY 分别属于PHYA、PHYB、PHYC 等3个亚族,其中,SiPHY-1和SiPHY-2属于PHYA 亚族,SiPHY-3 属于PHYB 亚族,SiPHY-4 属于PHYC 亚族,且PHYA 亚族聚为一支,PHYB 和PHYC 聚在一起。结果表明,谷子SiPHY 与狗尾草SvPHY、高粱SbPHY、玉米ZmPHY、水稻OsPHY 的亲缘关系近于与拟南芥AtPHY 的亲缘关系。这可能是因为谷子、狗尾草、水稻、高粱、玉米是单子叶禾本科植物,而拟南芥属于双子叶十字花科植物,推测植物在进化过程中PHY基因发生了生物学功能分化。

2.3 SiPHY基因家族的保守域和基因结构分析
为进一步了解谷子SiPHY家族成员的功能,对谷子SiPHY家族基因成员进行保守结构域和基因结构分析,结果如图2所示,SiPHY家族成员被分为2 个亚族,4 个SiPHY基因均为断裂基因,且基因结构均存在一定的差异。SiPHY-1和SiPHY-3含有5′端非翻译区和3′端非翻译区。SiPHY-4中间存在一段较长的内含子区域,可能在谷子生长发育中起特殊作用。

对谷子SiPHY蛋白的保守基序进行分析发现,总共鉴定了10个具有24~50个氨基酸残基的保守基序。基序Motif 1~Motif 10 存在于SiPHY-1、SiPHY-2 和SiPHY-3 中,SiPHY-4 中没有Motif 10。4 个SiPHY 家族成员Motif 的排布顺序相同且位置相近,表明谷子SiPHY基因家族成员的保守性较高,这些保守的Motif 在谷子光形态建成中提供了重要保障。
2.4 SiPHY基因家族的启动子顺式作用元件分析
为深入了解谷子SiPHY基因家族基因成员的潜在功能,利用PlantCARE数据库对启动子的顺式作用元件进行分析,结果如图3 所示,共筛选鉴定出66种顺式作用元件,主要与光响应、激素和逆境胁迫有关。其中,光响应元件包括AE-box、L-box、ATC-motif、GT1-motif、G-box、MRE、circadian 和ACE等,激素响应元件包括生长素响应元件(TGAelement、AuxRR-core)、赤霉素响应元件(GAREmotif、P-box、TATC-box)、脱落酸响应元件(ABRE)和水杨酸响应元件(TCA-element)等,此外,还包括干旱胁迫响应元件(MBS)、厌氧诱导元件(ARE)及参与防御和应激响应元件(TC-rich repeats)等。其中,SiPHY-1基因中含有的响应元件最多,有38种,SiPHY-2基因中含有的响应元件最少,有28 种,推测谷子中的PHYA 亚族中SiPHYA-1起主要作用。进一步分析发现,光响应元件在4 个谷子SiPHY家族基因成员中所占的比例最多,分别占26.32%(SiPHY-1)、21.43%(SiPHY-2)、21.21%(SiPHY-3)和18.92%(SiPHY-4)。这些结果表明,谷子SiPHY基因的表达主要受光信号的调节,在光形态建成中有重要作用,其次在抗逆胁迫中也发挥着作用。
2.5 不同光周期下SiPHY基因的表达模式分析
为探究SiPHY基因在谷子不同组织的表达模式,利用谷子多组学数据库中xiaomi的11 个组织的转录组数据绘制SiPHY基因表达热图,结果如图4 所示。除了SiPHY-2外,其余3 个SiPHY在11 个组织中均有表达。其中,SiPHY-1在萌发3 d 的种子中表达量最高,在其他10 个组织中表达量趋于一致,推测其在谷子萌发过程中发挥重要作用;SiPHY-2在11个组织中表达量均很低,在有的组织中表达量甚至为0;SiPHY-3和SiPHY-4在灌浆期的茎中表达量最高,其次在灌浆期的穗和旗叶中表达量较高,推测其在谷子灌浆期发挥重要作用。这些结果表明,光敏色素基因参与调控了谷子生长发育中的各个时期,并在种子萌发、抽穗期和灌浆期中发挥重要作用。

利用在长日照条件(LDs)和短日照条件(SDs)生长30 d 的野生型晋谷21、黄粟、大同红谷和突变体xiaomi、xiaomi3、xiaomi4的新生叶,用qRT-PCR方法分析SiPHY基因在不同光周期下的表达量,结果如图5 所示。从图5可以看出,SiPHY基因在不同光周期下的6 个谷子品种中的表达模式均有差异,SiPHY-2在6 个谷子品种中均微量表达或不表达。晋谷21 中的SiPHY-1在不同光周期下的表达量有明显差异;xiaomi、黄粟、xiaomi3中的SiPHY-4在不同光周期下的表达量有明显差异;大同红谷中的SiPHY-3在不同光周期下的表达量有明显差异。这些结果表明,光周期影响谷子光敏色素的表达,不同品种的表达模式不同,光敏色素在谷子光形态建成中的作用还需进一步探究。
3 结论与讨论
植物对光信号的感受是通过4 类光受体来实现的:感受红光和远红光的光敏色素(Phytochrome,PHY)、感受蓝光和紫外光的隐花色素(Cryptochrome,CRY)、蓝光依赖的向光蛋白(Photochopin,PHOT)和UVB 受体。光敏色素是由多基因编码,属小基因家族,不同植物体内的家族成员和拷贝数不同。拟南芥种存在PHYA、PHYB、PHYC、PHYD、PHYE等5种光敏色素[20],而在禾本科植物水稻、玉米和小麦中只存在PHYA、PHYB 和PHYC 等3 种光敏色素,不同的是水稻中的光敏色素是单拷贝,玉米为双拷贝,小麦为三拷贝[21]。而谷子基因组中只有4个光敏色素基因:PHYA(SiPHY-1和SiPHY-2)、PHYB(SiPHY-3)和PHYC(SiPHY-4)。研究发现,在拟南芥中光敏色素介导的光信号与脱落酸代谢途径相互作用,光敏色素作用因子PIFs也参与了植物激素信号转导[22]。对谷子光敏色素家族基因启动子进行顺式作用元件分析,共鉴定出66 种顺式作用元件,其中,光响应元件和激素类响应元件最多,表明谷子光敏色素受光和激素的调节。
植物光敏色素广泛存在于包括根在内的所有组织中,几乎调节植物生命周期的每个过程。其中,PHYA负责感知远红光,PHYB-PHYE参与红光介导的光形态发育[23]。PHYA对种子萌发具有促进或抑制作用,参与去黄化作用,促进开花和重置生物钟,调控根的发育,调节特化的韧皮部细胞从暗向光形态发生过渡,参与芽休眠及花的形态发生等[24];PHYB 能与IAA14、ARF7 以及ARF9 互作,这些互作能够稳定IAA14 蛋白,抑制ARF7 和ARF19的转录活性,从而抑制黑暗诱导下胚轴不定根的形成[25]。YANG 等[26]研究发现,xiaomi早抽穗表型是由于PHYC基因第2 外显子上G→T 突变引起的。此外,PHYD与植物避阴性反应相关,PHYE与种子萌发和避阴性反应相关[27-28]。本研究发现,SiPHY-1在萌发3 d的种子中表达量最高,推测其可能与种子萌发有关;SiPHY-2在各个时期表达量均很低,推测谷子中的2个PHYA基因中SiPHY-1起主要作用;SiPHY-3在灌浆期的茎、旗叶和穗中表达量较高,推测SiPHY-3与谷子形态建成有关。SiPHY在不同光周期条件下的表达谱显示,SiPHY-1、SiPHY-3和SiPHY-4在长日照和短日照条件下都表达,不同材料的表达量有明显差异。SiPHY-1在晋谷21和大同红谷中差异显著,SiPHY-3在大同红谷中差异显著,SiPHY-4在晋谷21、xiaomi、黄粟和xiaomi4中差异显著。PHYA-2在不同材料和光周期条件下均微量表达或不表达,表明光周期参与调控光敏色素,不同材料对光敏色素的敏感性不同。光敏色素在谷子生长发育中的作用还需进一步研究。
本研究通过生物信息学的方法共鉴定出4 个SiPHYs,分布在8 号(1 个)和9 号(3 个)染色体上,均包含PHY(PF00360)、PAS(PF00989)和GAF(PF01590)结构域,与PHY 家族基因的结构域一致。不同谷子SiPHY蛋白的理化性质存在差异,但均为亲水性蛋白。谷子SiPHY 与狗尾草SvPHY 亲缘关系最近,与拟南芥AtPHY 亲缘关系最远。SiPHY启动区存在光响应元件、激素响应元件和干旱响应元件等。表达谱分析结果推测,SiPHY可能与谷子的种子萌发、形态建成和抽穗开花期有关。SiPHY表达量受光周期和基因型的影响,SiPHY-2在不同光周期和不同材料中表达量均很低或不表达,推测谷子中的2 个SiPHYA只有一个发挥作用。这些结果为之后谷子中光敏色素的研究奠定了基础,也为解析光敏色素是如何参与谷子光形态建成提出了理论依据。

