自然发酵泡菜中乳酸菌的分离鉴定及其在金刺梨汁发酵中的应用
施渺筱,洪 蕴,汤鑫鑫,肖 洋,姚蒋庞,陈云坤*
(1.安顺学院 贵州省高校乡村振兴研究中心,贵州 安顺 561000;2.西南民族大学,四川 成都 610000;3.贵州省产品质量检验检测院,贵州 贵阳 550003)
乳酸菌在许多泡菜、果汁、发酵乳等食品中的分布与功能已有大量文献报道[1-3],是公认的食品级益生菌,具有维持肠道菌群平衡、降低胆固醇等保健作用,已经被广泛应用于食品发酵工业中[4]。乳酸菌在发酵过程中产生的醋酸、丙酸等有机酸,不仅可以赋予金刺梨汁酸味,还可以与发酵过程中产生的醇、酮、醛等物质相互作用,形成多种新的呈味物质。
金刺梨(Rosa sterilis)又名无籽刺梨、搭钩刺梨,属于蔷薇科蔷薇属植物[5],主要分布于贵州安顺、兴仁等地[6]。金刺梨营养价值丰富,鲜食加工均宜。成熟的金刺梨果肉肥厚、味酸甜、富含超氧化歧化酶(superoxide dismutase,SOD)、维生素、黄酮等营养元素[7]。近年来,随着金刺梨产业的快速发展,由于大量金刺梨鲜果集中上市,导致价格急剧下降,加之鲜果采后易纤维化、失水等引起食用品质和商业价值下降,严重制约该产业发展[8]。普通刺梨已广泛应用于食品产业,但对于营养价值更丰富的金刺梨,开发尚处于起步阶段[9]。目前,虽然已经开发了果酒、饮料、果酱、酸奶含片等金刺梨产品[10-13],但还未有发酵型金刺梨汁的研制。与普通刺梨相比,金刺梨药理活性基本相同,但其单宁和粗纤维含量较低,含糖量、可溶性固形物、维生素C(vitamin C,VC)和超氧化物歧化酶含量均较高,且肉质细腻,酸甜适度,香气浓郁,是加工发酵型果汁饮料的良好原料[14-16]。
本研究通过透明圈法从传统自然发酵泡菜样品中分离产酸、降解亚硝酸盐和抑制病原菌能力强的优良乳酸菌,通过形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并将其应用于金刺梨汁的发酵中,分析对比自然发酵果汁和人工接种乳酸菌发酵果汁的VC含量和SOD活性,以期为发酵金刺梨果汁工艺提供参考,为筛选具有优良性状的食品发酵工业用菌奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
自然发酵泡菜:毕节市家乡美农业综合开发有限公司;金刺梨原汁:贵州天赐贵宝食品有限公司。
1.1.2 菌株
金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):贵州大学生命科学学院微生物实验室。
1.1.3 试剂
牛肉膏、蛋白胨、酵母膏、葡萄糖、蔗糖、乳糖、革兰氏染色液试剂盒、细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;磷酸氢二钾、柠檬酸二铵、无水乙酸钠、硫酸镁、硫酸锰、吐温-80、碳酸钙:天津市科密欧化学试剂有限公司;盐酸乙二铵:天津市永大化学试剂有限公司;对氨基苯磺酸、亚硝酸钠、丙三醇、四硼酸钠(硼砂)、亚铁氰化钾、乙酸锌:成都金山化学试剂有限公司。所用试剂均为分析纯或生化试剂。
1.1.4 培养基[2]
MRS液体培养基:蛋白胨10 g,牛肉膏10 g,酵母膏10 g,葡萄糖20 g,柠檬酸钠2 g,乙酸钠2 g,硫酸镁0.58 g,硫酸锰0.25 g,磷酸氢二钾2 g,吐温-80 1 mL,蒸馏水1 000 mL,pH 6.28±0.06,121 ℃灭菌30 min。固体培养基中加入琼脂粉20 g。
MRS-CaCO3培养基:MRS固体培养基中加入CaCO315 g。
MRS-NaNO2培养基:MRS固体培养基中加入NaNO215 g。
牛肉膏蛋白胨液体培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g,蒸馏水1 000 mL,121 ℃灭菌20 min。固体培养基中添加琼脂粉20 g。
明胶基础培养基:明胶120 g,蛋白胨5 g,酵母提取物3.0 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
硫化氢培养基:牛肉浸膏5 g,蛋白胨10 g,氯化钠5 g,硫代硫酸钠0.3 g,硫酸亚铁0.2 g,琼脂20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
V-P培养基:蛋白胨5 g,葡萄糖5 g,磷酸氢二钾2 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
淀粉水解培养基:可溶性淀粉10 g,蛋白胨10 g,氯化钠5 g,牛肉膏5 g,琼脂20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
柠檬酸盐培养基:柠檬酸钠3 g,葡萄糖2 g,酵母浸粉5 g,磷酸二氢钾1 g,氯化钠5 g,0.2%酚红溶液6 mL,琼脂20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
糖发酵实验培养基:蛋白胨5 g,牛肉膏5 g,酵母膏5 g,吐温-80 1 mL,1.6%溴甲酚紫溶液1.4 mL,1%糖类,蒸馏水1 000 mL,121 ℃灭菌20 min。
1.2 仪器与设备
SW-CJ-IFD型单人单面净化工作台:苏州净化科技有限公司;SHP-250型立式压力蒸汽灭菌锅:上海申安仪器有限公司;HPX-9082MBE电热恒温培养箱:江苏省科学器材有限公司;FA2204N型精密电子天平:上海菁海科技有限公司;PHS-3C精密酸度计:上海大普仪器有限公司;SKY-2112B恒温振荡培养箱:上海达平仪器有限公司;DK-98-II型电热恒温水浴锅:天津市泰斯特仪器有限公司。
1.3 实验方法
1.3.1 乳酸菌的分离
参照黄承敏等[17]的方法,称取自然发酵泡菜20 g,加至装有180 mL无菌生理盐水的锥形瓶中,充分振荡,吸取1 mL稀释液转接至盛有9 mL无菌生理盐水的试管中按10倍系列梯度稀释至10-7,取0.1 mL稀释液分别涂布于MRSCaCO3培养基,在37 ℃条件下厌氧培养24~48 h。若出现溶钙圈、圆形稍扁平或凸起、白色或黄色,可初步定为乳酸菌。再分别挑取菌落形态大小各不相同的单菌落进行平板划线、培养,反复纯化多次。将纯化的单菌落分别进行4 ℃斜面保藏和-80 ℃甘油管冻藏备用。
1.3.2 形态观察及生理生化鉴定
形态观察:根据《伯杰细菌鉴定手册》对乳酸菌进行观察。
生理生化试验:参考《乳酸细菌分类鉴定及实验方法》和《伯杰细菌鉴定手册》,对初筛的优良菌株进行明胶液化、淀粉水解、硫化氢(H2S)、糖发酵试验等生理生化特性试验[18-19]。
1.3.3 优良乳酸菌的筛选
(1)种子液的制备
在无菌条件下,挑取活化后的分离菌株转接至MRS液体培养基中,37 ℃条件下培养24 h,活化2代,当培养菌液的OD600nm值达到0.8作为种子液,备用。
(2)产酸能力的测定
按1%(V/V)的接种量将种子液接种至MRS液体培养基中,37 ℃培养24 h。将菌液混匀,在波长600 nm处测定菌液的吸光度值,使用pH计测定发酵液的pH值,比较各菌株的产酸能力。
(3)亚硝酸盐降解能力的测定
按1%(V/V)的接种量将种子液接种至MRS-NaNO2液体培养基中,37 ℃培养24 h。将菌液混匀,在波长600 nm处测定吸光度值。比较各菌株在含有150 mg/L NaNO2的MRS液体培养基中的生长能力,并测定发酵前后亚硝酸盐的含量,计算亚硝酸盐降解率,比较不同菌株降解亚硝酸盐的能力,亚硝酸盐降解率计算公式如下:

(4)抑菌能力的测定
菌悬液的制备:按1%(V/V)的接种量将种子液接种于MRS液体培养基中,37 ℃培养24 h;取发酵液在4 ℃、8 000 r/min条件下离心15 min,取上清液,过0.22 μm无菌滤膜后,备用。
指示菌的制备:取斜面保藏的大肠杆菌和金黄色葡萄球菌接种于牛肉膏蛋白胨液体培养基中,于30 ℃、150 r/min的条件下培养8~10 h。分别吸取菌液200 μL添加到牛肉膏蛋白胨琼脂平板上。
抑菌试验:用灭菌镊子将牛津杯垂直放置于培养皿中,将1.0%的指示菌菌悬液与牛肉膏蛋白胨琼脂培养基混匀后注入培养皿,待其完全凝固后,取出牛津杯。取100 μL菌株上清液注入孔中,37 ℃培养24~48 h,每组重复3次。使用游标卡尺,采用十字交叉法测量抑菌圈直径,根据抑菌圈直径大小判断分离菌株抑菌性能,抑菌圈直径>9.0 mm时具有抑菌性能[20]。
1.3.4 优良乳酸菌的分子生物学鉴定
采用细菌基因组DNA提取试剂盒提取优良乳酸菌的DNA,以其为模板,采用16S rDNA的通用引物27F(5'-AACTGAGTTTGATCCTGGCTC-3')、1492R(5'-TACGGTTACCTTGTTACGACTT-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[21]。将PCR扩增得到的产物送至生工生物工程(上海)股份有限公司进行测序。将测序后得到的16S rDNA基因序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源搜索比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.5 发酵金刺梨汁的制备
按1%(V/V)的接种量将优良乳杆菌种子液分别接种于MRS液体培养基中,37 ℃条件下培养14 h后,在4 ℃条件下8 000 r/min分别离心10 min,弃掉上清液,用生理盐水反复洗涤2~3次,调节菌悬液菌体浓度至106CFU/mL。按金刺梨汁质量的2%将菌悬液接种于经过巴氏灭菌(71 ℃,10 min)的金刺梨汁中[21],37 ℃条件下发酵5 d。以未接种的自然发酵金刺梨汁为对照,每隔24 h测定样品的pH值,以观察发酵效果。当pH稳定后经过瞬时高压灭菌,终止发酵[22]。
1.3.6 感官评价
由18人分别对自然发酵金刺梨果汁和人工接种乳酸菌发酵金刺梨果汁的色泽、香气、口感、组织状态进行评分,满分为9分,去除最高分和最低分后,取平均分为自然发酵与人工接种乳酸菌发酵金刺梨果汁最后的得分。具体评分标准见表1[23]。

表1 发酵金刺梨果汁的感官评分标准Table 1 Sensory evaluation criteria of fermented Rosa sterilis juice
1.3.7 分析检测
维生素C含量的测定:采用2,6-二氯氰靛酚法[24]。SOD活力测定:按照SOD试剂盒说明测定。
1.3.8 统计分析
所得试验数据均使用SPSS 26.0进行统计学分析,采用Origin 2021对所得数据进行绘图。
2 结果与分析
2.1 乳酸菌的形态学及生理生化鉴定
按照传统培养分离技术从自然发酵泡菜中共分离得到47株菌株,编号为BJ-1~BJ-47,通过接触酶试验、革兰氏染色试验及生理生化试验初步鉴定筛选得到17株乳酸菌。部分菌株的菌落及细胞形态见图1,17株乳酸菌的生理生化试验结果见表2。
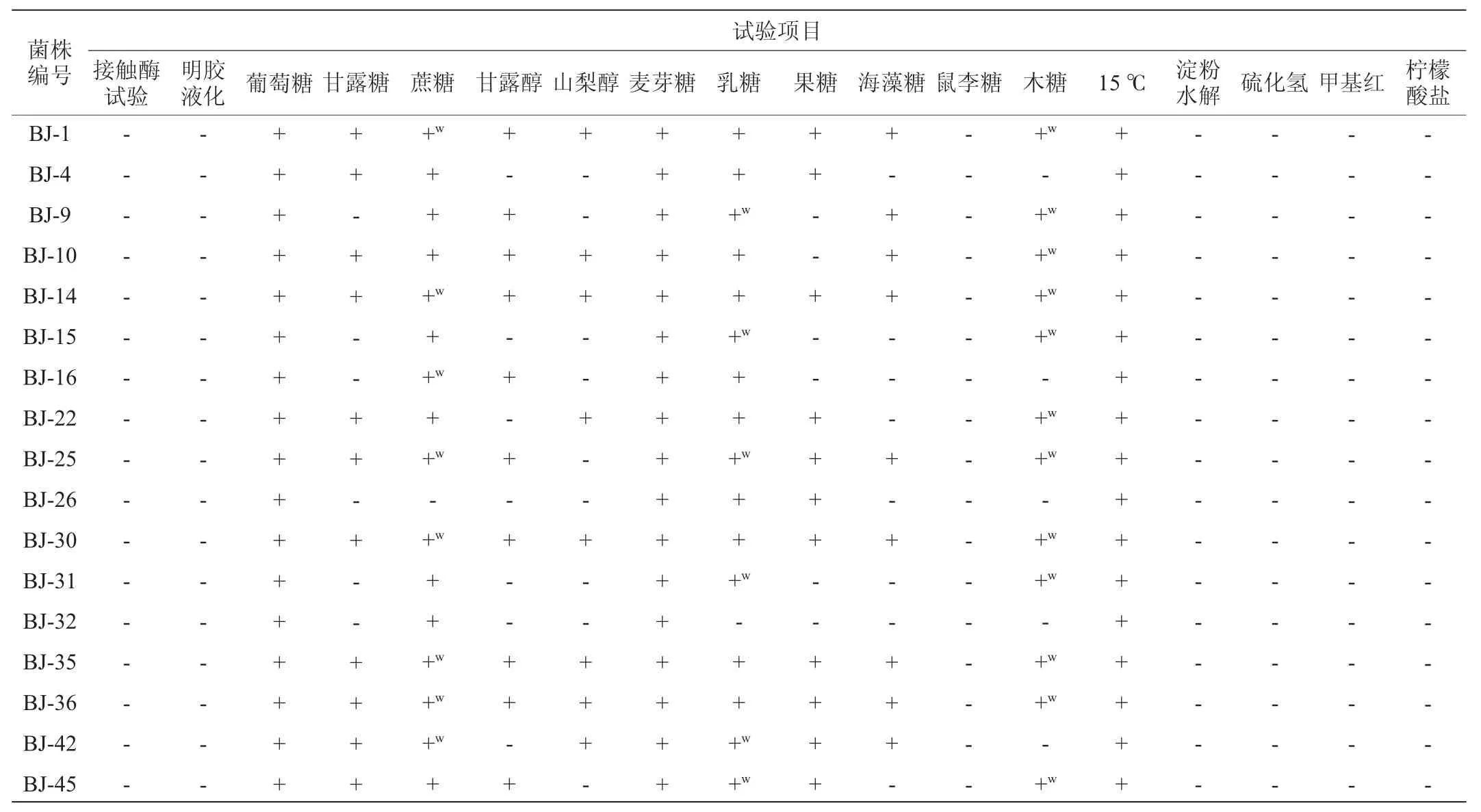
表2 17株分离菌株的生理生化试验结果Table 2 Physiological and biochemical tests results of 17 isolated strains
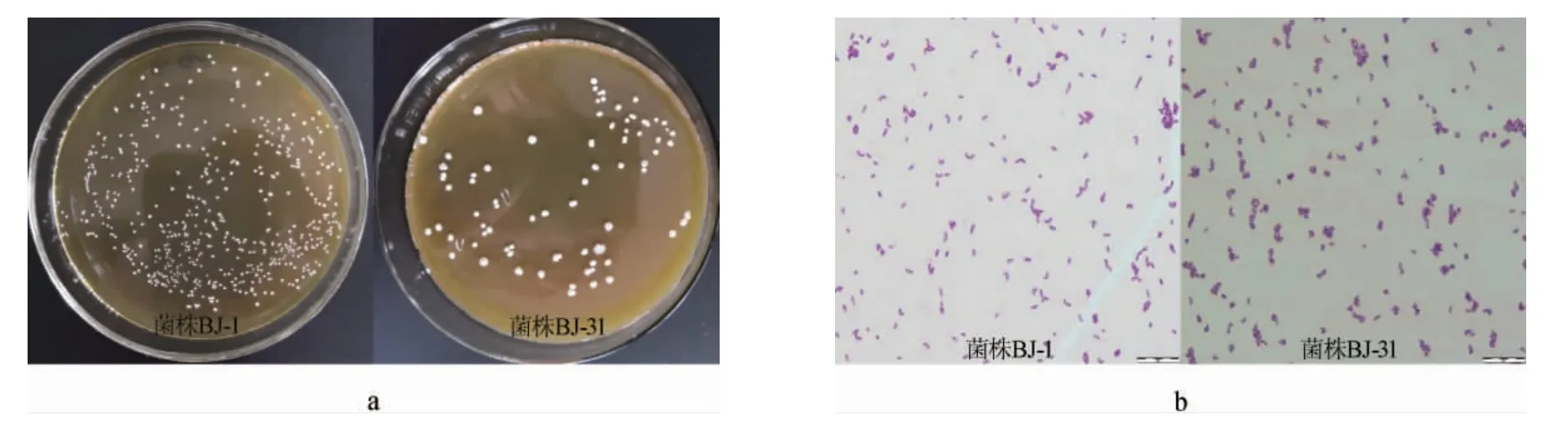
图1 部分分离菌株菌落(a)及细胞(b)形态Fig.1 Colony (a) and cell (b) morphology of some isolated strains
由图1及表2可初步鉴定分离菌株BJ-1、BJ-4、BJ-14、BJ-25、BJ-30、BJ-35和BJ-36与植物乳杆菌(Lactobacillus plantarum)的特征接近;菌株BJ-9、BJ-10、BJ-15、BJ-16、BJ-22和BJ-31与短乳杆菌(Lactobacillus brevis)的特征接近;菌株BJ-26、BJ-32、BJ-42和BJ-45暂时无法确定种名。
2.2 乳酸菌的性能测定
2.2.1 生长及产酸能力的测定
17株乳酸菌的生长能力及产酸能力见图2。
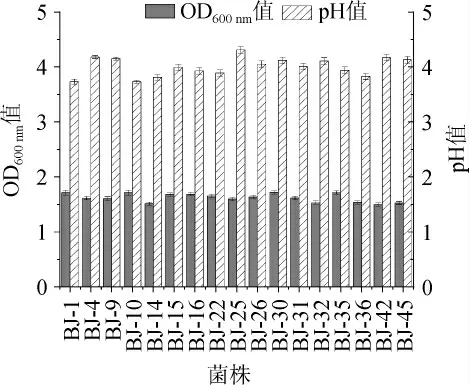
图2 不同菌株的OD600nm值和pH值Fig.2 OD600nm value and pH of different strains
由图2可知,通过24 h培养后,各菌株发酵液的OD600nm值为1.513~1.713,pH值为3.73~4.31。其中,菌株BJ-1、BJ-4、BJ-9、BJ-10、BJ-14、BJ-15、BJ-16、BJ-22、BJ-26、BJ-30、BJ-31、BJ-32和BJ-36生长旺盛(OD600nm值>1.50)、产酸能力强(最终pH值<4.2)。
2.2.2 亚硝酸盐降解能力的测定
17株乳酸菌菌株对亚硝酸盐的降解率见图3。

图3 不同菌株对亚硝酸盐的降解率Fig.3 Nitrite degradation rate with different strains
由图3可知,17株乳酸菌培养24 h后,对亚硝酸盐的降解率在76.33%~94.05%之间,其中菌株BJ-1、BJ-4、BJ-9、BJ-14、BJ-16、BJ-22、BJ-26、BJ-30、BJ-31、BJ-32、BJ-35、BJ-36和BJ-45对亚硝酸盐的降解效果较好,降解率均>80%。
2.2.3 抑菌能力的测定
17株乳酸菌菌株对金黄色葡萄球菌和大肠杆菌的抑制效果见表3。

表3 不同菌株对金黄色葡萄球菌和大肠杆菌的抑制效果Table 3 Inhibition effect of different strains on Staphylococcus aureus and Escherichia coli
由表3可知,菌株BJ-1、BJ-4、BJ-9、BJ-10、BJ-14、BJ-26、BJ-30、BJ-31、BJ-32、BJ-35和BJ-36对于2种指示菌的抑菌效果较好,抑菌圈直径均>13.0 mm。菌株BJ-1、BJ-4、BJ-30对大肠杆菌的抑制效果更好,菌株BJ-1、BJ-10、BJ-30、BJ-31、BJ-35对金黄色葡萄球菌的抑制效更好,分析原因可能是不同菌株在发酵过程中产生的抑菌物质的数量和种类都有所不同。此外,同一菌株对不同指示菌的抑制效果也不同。
综上,通过生长能力、产酸性能、降解亚硝酸盐性能、抑菌性能综合筛选得到4株产酸高、降解亚硝酸盐能力强、抑菌效果好的优良乳酸菌菌株,分别为菌株BJ-1、BJ-26、BJ-31和BJ-32。
2.3 优良乳酸菌菌株的分子生物学鉴定
基于16S rDNA基因序列,4株优良乳酸菌菌株的系统发育树见图4。由图4可知,菌株BJ-1、BJ-26与植物乳杆菌(Lactobacillus plantarum)聚于一支,亲缘关系最近,菌株BJ-31、BJ-32与短乳杆菌(Lactobacillus brevis)聚于一支,亲缘关系最近。结合形态特征及生理生化试验结果,将菌株BJ-1、BJ-26鉴定为植物乳杆菌(Lactobacillus plantarum),菌株BJ-31、BJ-32鉴定为短乳杆菌(Lactobacillus brevis)。
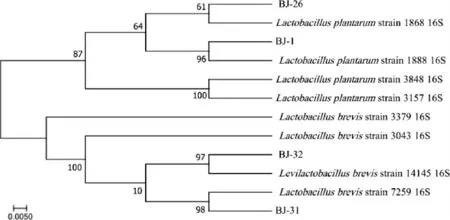
图4 基于16S rDNA基因序列4株菌的系统进化树Fig.4 Phylogenetic tree of 4 strains based on 16S rDNA gene sequence
2.4 乳酸菌发酵金刺梨果汁分析
乳酸菌发酵果汁过程中产生大量的酸能快速降低果汁pH值,抑制腐败菌生长,防止果汁腐败变质,延长果汁保质期,并能促进果汁色泽的形成,加快果汁发酵,缩短果汁发酵周期[25-26]。选择植物乳杆菌BJ-1(Lactobacillus plantarumBJ-1)和短乳杆菌(Lactobacillus brevisBJ-31)发酵金刺梨果汁,考察乳酸菌对发酵金刺梨果汁pH值、VC含量、SOD活力及感官评分的影响,结果分别见图5和表4。

表4 发酵金刺梨果汁感官评分的结果Table 4 Sensory score of fermented Rosa sterilis juice
由图5a可知,人工接种乳酸菌发酵金刺梨汁0~3 d,发酵体系的pH值下降较为明显,而自然发酵金刺梨汁7~42 d,发酵体系的pH值才下降明显,pH下降的速度为短乳杆菌BJ-31>植物乳杆菌BJ-1>自然发酵;人工接种乳酸菌发酵金刺梨汁3~4 d,发酵体系的pH值下降速度趋于平缓,金刺梨汁发酵成熟,发酵成熟时间短乳杆菌BJ-31最短,植物乳杆菌BJ-1次之,自然发酵需要两个月才能完成,说明人工接种乳酸菌明显缩短了发酵金刺梨汁的发酵时间,提高了发酵果汁的生产效率。

图5 菌株对发酵金刺梨果汁pH值(a)、VC含量(b)及超氧化歧化酶活力(c)的影响Fig.5 Effect of strains on pH (a),VC content (b) and superoxide dismutase activity (c) of fermented Rosa sterilis juice
由图5b和5c可知,随着发酵的进行,接种植物乳杆菌BJ-1发酵的金刺梨汁VC含量从(2 133.95±52.18)mg/100 g降低至(1 571.35±49.21)mg/100 g,保留率为(73.62±0.94)%;SOD活力从(6459.11±132.38)U/g降至(3 546.79±138.31)U/g,保留率为(54.91±0.64)%。接种短乳杆菌BJ-31发酵的金刺梨汁VC含量从(2 133.95±52.18)mg/100 g降低至(1 526.41±49.36)mg/100 g,保留率为(71.53±0.95)%;SOD活性从(6 459.37±110.45)U/g降至(3 402.42±141.71)U/g,保留率为(50.67±0.87)%。自然发酵金刺梨汁VC含量从(2 488.26±49.38)mg/100 g降低至(803.15±52.30)mg/100 g,保留率为(32.28±0.94)%;SOD活性从(6 798.26±110.39)U/g降至(2 323.98±139.65)U/g,保留率为(34.18±0.91)%。由此可见,人工接种发酵的金刺梨汁中VC和SOD活性的损耗要远小于自然发酵的损耗。
由表4可知,综合色泽、香气、口感、组织状态评分,得分高低依次是短乳杆菌BJ-31发酵的金刺梨果汁>植物乳杆菌BJ-1发酵的金刺梨果汁>自然发酵的金刺梨果汁>未发酵金刺梨果汁。证明了人工接种乳酸菌发酵金刺梨果汁可以提高金刺梨果汁的品质和风味,显著地降低了发酵过程中主要营养成分的损耗,有效的缩短金刺梨汁的发酵周期,说明植物乳杆菌BJ-1和短乳杆菌BJ-31具有作为金刺梨汁发酵剂的潜能。
3 结论
本研究从自然发酵泡菜中共分离得到47株菌株,经形态学观察和生理生化试验初步鉴定出17株乳酸菌,经过产酸、降解亚硝酸盐和抑菌能力的测定从中筛选得到4株优良乳酸菌株,经分子生物学鉴定2株为植物乳杆菌(Lactobacillus plantarum)、2株为短乳杆菌(Lactobacillus brevis)。挑选植物乳杆菌BJ-1和短乳杆菌BJ-31应用于金刺梨果汁发酵,接种乳酸菌BJ-1和BJ-31的金刺梨果汁发酵3 d就能达到所需的pH值,发酵结束后,金刺梨果汁中的VC含量分别为(1 571.35±49.21)mg/100 g和(1 526.41±49.36)mg/100 g,分别为自然发酵组的1.96倍和1.90倍,SOD活力分别为(3 546.79±138.31)U/g和(3 402.42±141.71)U/g,分别为自然发酵组的1.53倍和1.46倍,且感官评分分别为(7.20±0.75)分和(7.29±1.00)分,均高于自然发酵组[(6.37±1.59)分]。接种从自然发酵泡菜中分离的乳酸菌BJ-1和BJ-31发酵金刺梨果汁,不仅显著缩短了金刺梨果汁的发酵周期,且提高了金刺梨果汁的品质、延长了金刺梨果汁的保质期,为金刺梨果汁的发酵工艺提供了参考。

