胰岛素增敏剂治疗非酒精性脂肪性肝炎的Meta分析
王德鹤 王怡群 周盼 叶敏超 张玮 李莹
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的发病机制与炎症坏死、氧化应激、胰岛素抵抗(insulin resistance, IR)等多种病理变化密切相关,亦受遗传变异、生活方式等因素的影响[1]。据统计,NAFLD全球患病率约为25%,而NAFLD患者的总体非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)患病率约为59%[2,3]。NASH与IR及2型糖尿病密切相关,IR可诱导脂肪素分泌、促使游离脂肪酸的生成并堆积于肝脏,加速肝细胞中毒性脂源代谢物的积累,加重肝脏纤维化[4]。
胰岛素增敏剂是能够增强机体胰岛素敏感性从而促使其充分发挥作用的一种特殊物质,研究显示二甲双胍、噻唑烷二酮能够改善肝功能、葡萄糖代谢和脂质代谢[5,6]。本研究总结目前可用的胰岛素增敏剂治疗NASH的组织学与生化学疗效指标的证据,为NASH的临床防治提供理论依据。
资料与方法
一、文献检索
计算机检索中文数据库(包括CNKI、CBM、VIP和万方数据库)、英文数据库(包括Web of Science、PubMed、Cochrane图书馆和EMBASE)中关于胰岛素增敏剂治疗脂肪肝的临床随机对照实验,中文检索词为非酒精性脂肪性肝病、非酒精性脂肪性肝炎、脂肪肝、双胍类、二甲双胍、吡格列酮、罗格列酮、噻唑烷二酮、胰岛素增敏剂。英文检索词为NAFLD、Fatty Liver、Steatosis、Nonalcoholic steatohepatitis、NASH、Non-alcoholic fatty liver disease、Metformin、Thiazolidinedione、Pioglitazone、Rosiglitazone、Insulin sensitiz; 时间为2010年至2020年5月。补充手工检索其他相关杂志。如果同一项研究有一份以上的报告,则将所有报告都包括在内,以最大限度地提高可用于meta分析的信息以防遗漏。
二、纳入标准与排除标准
纳入标准:①脂肪肝诊断依据组织学检查或是中华肝脏病分会的标准;②研究类型为随机对照试验且总疗程≥6个月;③治疗组给予TDZ或GLP-1类或二肽酰肽酶-4抑制剂或双胍类胰岛素增敏剂;④对照组给予安慰剂。
排除标准:①病例数<30例;②存在继发性脂肪变,如肠外营养或者药物诱导而发生的脂肪变性,或存在肺、心、肾等临床基础疾病患者,合并其他原因致肝酶异常的患者;③重复发表、数据不符要求或缺失而致无法提取;④未成年患者。
三、资料提取
提取的信息包括作者、年份、国家、参与者人数、试验参与者的年龄、性别、方法设计标准及结局指标。其中,结局指标包括肝脏病理改善病例数;肝纤维化、肝细胞气球样变、肝脂肪变性、小叶炎症评分;血清学指标:ALT、AST、三酰甘油(TG)、总胆固醇(TC)、空腹血糖(FPG)、空腹胰岛素(FINS);体质指数(BMI)。
四、文献质量评价
采用Cochrane手册5.0.2.中针对RCT的偏倚风险评估标准[7]进行独立评价。分析各研究之间的临床特征,判断其是否存在异质性,根据是否具有异质性划分亚组,合并同质研究再进行分析。
五、统计学分析
Meta分析采用RevMan5.3软件进行,并依据PRISMA指南报告数据。采用卡方检验及I2统计量判断异质性,选用固定效应模型(fixed effects model,FEM)(P>0.1,I2<50%)或随机效应模型(random effects model,REM)(P<0.1,I2>50%)分析数据。对于病理活检的改善例数,以相对危险度(RR)和95%可信区间(95%CI)来评价其效果。对于血清生化指标及BMI指标,如果测量量表相同,则计算平均差值(MD)和95%CI;如果测量尺度不一致,则计算SMD和95%CI。P<0.05为差异有统计学意义。以上述方法比较各RCT的疗效并建立森林图。
结 果
一、检索结果
总共检索6117篇文献,剔重后获得3218篇。初筛后剩余297篇,阅读全文进行复筛,最终纳入8篇文献[8-15]。文献筛选流程见图1。

图1 文献筛选流程图
二、纳入研究的特征
8篇文献共计750例研究对象,实验组371例,对照组379例。2篇文献为脂肪肝合并糖尿病患者[10,13],1篇文献包含了糖尿病及糖耐量异常患者[12],2篇文献排除了糖尿病患者[8,11],其余文献未提及合并糖尿病情况;有3项研究报告了治疗前后的组织学改善人数[8,10,13],2篇报告了血清生化指标前后的改变值[12,13],5篇文献报告了血清生化的基线值与终点值[9-11,14,15]。见表1。
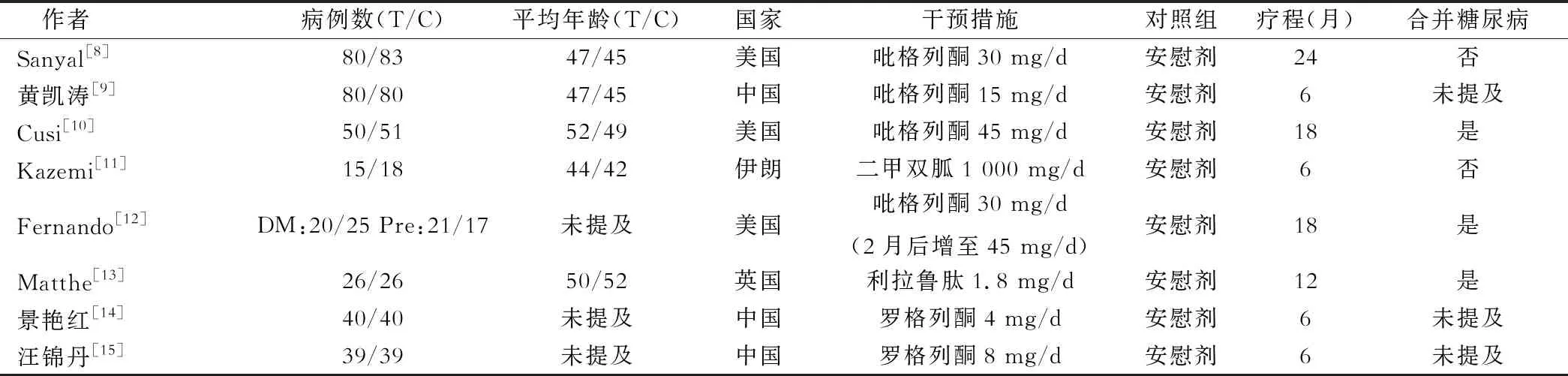
表1 纳入文献的基本特征
三、方法学质量评估和偏倚风险
3篇文献报道了具体的随机方法[10,11,13],均为计算机生成数字表所以评估为低风险,其余文献亦使用随机方法但具体不详遂为风险不明确。3篇文献报道了患者失访或脱落情况,其中文献[11]与文献[13]中患者失访人数较少,遂将结局指标数据完整性评估为低风险,而文献[12]中NALFD合并糖耐量异常的失访人数超过20%遂评估为高风险;其余3篇文献无失访患者[9,14,15]。3篇文献中显示实验药物由协作的药厂提供[8,10,13],其中文献[8]中显示提供药物的药厂并未参与数据统计与决策分析则评估为低风险,其余两篇则评估为高风险。偏倚风险评估具体见图2。

图2 RCT方法学质量及偏倚风险评估
四、结局指标
(一)组织学应答 共纳入3篇文献[8,10,13],2篇为吡格列酮治疗,1篇为利拉鲁肽治疗。其中,对于肝脏纤维化的改善,3项RCT无明显异质性(P=0.87,I2=0),FEM结果可见,胰岛素增敏剂对肝脏纤维化的改善病例数与安慰剂相比差异有统计学意义(RR=1.53,95%CI:1.09~2.14,P<0.05)。对于脂肪变性的改善例数,3项研究无明显异质性(P=0.51,I2=0%),FEM分析结果可见胰岛素增敏剂对肝细胞脂肪变改善病例数与安慰剂组相比,差异有统计学意义(RR=2.29,95%CI:1.76~2.98,P<0.05)。在肝细胞气球样变改善程度上,各研究间无明显异质性(P=0.64,I2=0%),FEM分析结果显示,胰岛素增敏剂对肝细胞气球样变改善例数与安慰剂组相比差异有统计学意义(RR=1.77,95%CI:1.30~2.42,P<0.05)。在小叶炎症改善程度上,3项研究异质性较高(P=0.05,I2=67%),REM分析结果显示,小叶炎症改善例数与对照组相比,差异无统计学意义(RR=1.53,95%CI:0.92~2.54,P>0.05)。
(二)血清ALT、AST ALT指标共纳入7篇文献[9-15],根据治疗前后改变值与终点值的不同作为划分依据,对其进行亚组分析。其中,ALT改变值选择FEM(P>0.1,I2=0%),ALT终点值则运用REM(P<0.1,I2=78%),结果提示,与安慰剂相比,胰岛素增敏剂治疗可改善患者ALT值(ALT改变值MD=-18.42,95%CI:-29.79~-7.05,ALT终点值SMD=-1.01,95%CI:-1.46~-0.56,均P<0.05)。
AST指标共纳入6篇文献[9-14],根据治疗前后的改变值与终点值的不同作为划分依据,对其进行亚组分析。其中,AST改变值选择FEM(P>0.1,I2=34%),AST终点值运用REM(P<0.1,I2=54%),结果提示,与对照组相比,胰岛素增敏剂治疗可改善患者AST值(AST改变值MD=-8.26,95%CI:-15.12~-1.39,AST终点值MD=-15.09,95%CI:-21.12~-9.07,均P<0.05)。对AST终点值进行敏感性分析,寻找其异质性来源,剔除文献[10]后结果提示I2=33%且P<0.05,结论较之前未改变,故敏感性低,结论稳健可信。
(三)血清TG、TC指标 TG指标共纳入5篇文献[9-11,14,15],均为治疗后的终点值。运用FEM对其数据进行分析(P>0.1,I2=42%),结果提示,与对照组相比,胰岛素增敏剂治疗可改善患者TG值(SMD=-0.46,95%CI:-0.65~-0.27,P<0.05)。
TC指标共纳入4篇文献[9-11,14],均为治疗后的终点值。运用REM对其分析(P=0.1,I2=72%),结果提示,胰岛素增敏剂对患者TC指标的改善与安慰剂组差异无统计学意义(SMD=-0.21,95%CI:-0.63~0.21,P>0.05)。
(四)血清FPG、FINS指标 FPG指标共纳入7篇文献[9-14],根据治疗前后的改变值与终点值的不同作为划分依据对其亚组分析。其中,FPG改变值运用FEM(P>0.1,I2=0%)、FPG终点值运用REM分析(P<0.1,I2=74%)。结果提示,与对照组相比,胰岛素增敏剂治疗可改善患者FPG指标(FPG改变值SMD=-0.62,95%CI:-0.98~-0.26,FPG终点值SMD=-0.50,95%CI:-0.93~-0.07,均为P<0.05)。对FPG终点值进行敏感性分析,寻找其异质性来源,剔除文献[9]后结果提示I2=0%且P<0.05,此时结论与之前相同,故敏感性低,结论可信。
FINS指标共纳入3篇文献[9,10,14],均为治疗后的终点值。选择REM对其进行分析(I2=54%),结果提示与对照组相比,胰岛素增敏剂治疗可改善患者FINS指标(SMD=-0.77,95%CI:-1.11~-0.44,P<0.05)。
(五)BMI指标 共纳入6篇文献[9-13,15],根据治疗前后的改变值与终点值的不同作为划分依据进行亚组分析。BMI改变值与终点值的异质性分别为P<0.1,I2=86%及P<0.1,I2=55%,遂均采用REM分析。结果提示,与安慰剂组相比,胰岛素增敏剂对患者BMI指标的改善差异无统计学意义(BMI改变值MD=0.06,95%CI:-1.53~1.64,BMI终点值MD=-0.33,95%CI:-1.44~0.78,均P>0.05)。其中,纳入的两篇文献[12,13]中的BMI改变值差异性较大(I2=86%),分析其异质性来源推测与胰岛素增敏剂对患者体质量的影响有关,Matthe等[13]提示皮下注射利拉鲁肽可有效降低NASH患者体重,而在Fernando等[12]研究中,与安慰剂对照组相比,口服吡格列酮对于减轻患者体质量有负向作用。
讨 论
本研究结果显示,胰岛素增敏剂可减轻肝组织学病理程度(如肝脂肪变、纤维化、肝细胞气球样变),改善ALT、AST、TG、FPG、FINS等血清学指标,但是对于小叶间炎症、血清TC、BMI并无明显改善。
噻唑烷二酮类化合物可结合过氧化物酶体增殖的γ受体从而增强胰岛素敏感性[16]。二甲双胍是一种可在肝脏、脂肪、肌肉等多种靶向组织间发挥保护作用的多效增敏剂,它可抑制肝糖输出以达到缓解胰岛素抵抗、降低葡萄糖浓度的目的[17]。利拉鲁肽是一种胰高血糖素样肽类似物,可通过下调雷帕霉素靶蛋白相关炎症信号通路从而调节内质网应激,提高肝脂肪胰岛素敏感程度,促进葡萄糖稳态性、抑制炎症因子并减少肝脏脂肪累积[18]。Cusi等[10]和Sanyal等[8]纳入的患者肝纤维化基线均为F0-F2,Matthe等[13]纳入的患者中干预组与对照组肝纤维化在F3-F4级的人数百分比分别为46%、58%,因基线评分等级异质性较大与纳入样本数量不足,遂无法判定利拉鲁肽对于肝纤维化的治疗及预后效果差于吡格列酮。
4篇文献记录了患者不良反应的发生情况[8,10,11,13],其余4篇未提及。不良事件涉及心脑血管、胃肠、呼吸、皮肤、血液等多系统,具体包括高血压、腹泻、恶心、低血糖、下肢水肿等。在吡格列酮干预的人群中出现了体质量显著增加的现象,与既往动物实验研究结果一致。所以,应结合空腹胰岛素、血糖、脂肪分布等代谢指标综合判定其对体质量的影响。
本研究中存在以下几点局限性。首先,本研究在用药疗程、治疗剂量、给药途径及人口种族方面均有不同,而这些因素会为实验结果带来一定的差异性。其次,在肝组织病理学方面,胰岛素增敏剂对于小叶间炎症指标的改善并不明显,吡格列酮可改善NASH患者的组织病理学,利拉鲁肽也无明显改善作用,可能与纳入患者的样本量不足有关,并且因合并高血压、高血脂症、甲状腺疾病等,导致研究样本异质性较大。此外,3篇文献[8,10,13]虽然均采用Kleiner评分系统来评估,但是依旧无法避免采样过程及组织学改善标准的差异性。ALT作为肝脏炎症的血清标志物,其反映坏死性炎症活动的急性变化[19],不一定与疾病的组织学活动和分期相一致。美国肝病研究协会颁布的《非酒精性脂肪肝诊疗实践指南》[20]指出,吡格列酮可改善NASH患者肝组织病理指标故推荐用于常规治疗。在中华医学会制定的《非酒精性脂肪性肝病防治指南(2018年更新版)》[21]中,建议将二甲双胍用于脂肪肝患者T2DM的防治,而吡格列酮仅用于合并T2DM的NASH患者。而利拉鲁肽常推荐用于合并肥胖与T2DM的NASH患者[13]。
本研究结果提示,胰岛素增敏剂在改善NASH患者的肝组织学和血清学指标方面具有一定的疗效。但只能作为临床防治NAFLD过程中的一个重要组成部分,无法解决目前面临的所有问题,如何使其疗效最优化并制定与其他保肝药物联合用药的诊疗方案,还需更多的临床实践提供新的证据。

