脂肪干细胞转染Bmp2后成骨能力变化的研究*
赖文涛 张晓璐 张春阳 赵志军
各种原因引起的骨缺损、骨不愈合是临床工作中的难题之一。这些情况可能会使得患者机体功能发生障碍,为患者带来诸多不便。目前,自体骨移植是比较优先的治疗选择。然而,自体骨移植物的获取可能造成更多的并发症,如血肿、感染、供体部位的功能障碍和疼痛,以及手术时间的增加等[1]。这使得自体骨可获取的部分十分有限,限制了其在大面积骨缺损中的应用。然而使用异体骨也有包括感染或免疫排斥等在内的缺点[2],并且在一些动物研究中也表明,异体骨在诱导新生骨方面的效果较差。为了克服这种局限性,研究人员已经开发了几种生物材料和方法来修复大面积的骨缺损[3]。迄今为止,骨髓源性间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)在骨组织工程中的应用较为广泛,但BMSCs的获取会给患者带来较大痛苦[4-6]。近些年,脂肪干细胞(adipose stem cells,ADSCs)作为间充质干细胞的替代来源受到了更多的关注,因为它更容易从不同的解剖部位获得,微创手术的并发症风险较低,供体部位发病率也较低[7-8]。骨形态发生蛋白(bone morphogenetic proteins,BMPs)是转化生长因子-超家族的成员之一,也是诱导新骨形成的最有效的因子。其中,Bmp2是成骨能力较强的蛋白,在骨再生过程的许多阶段发挥着重要作用[9]。在本研究中,笔者试图发掘ADSCs作为骨缺损修复细胞治疗剂的有效性,使用脂质体转染Bmp2基因至大鼠ADSCs中,从而在体外产生大量的Bmp2;再者即评估Bmp2转染脂肪干细胞后其成骨能力是否有增加;最后比较了Bmp2转染脂肪干细胞和空载质粒转染脂肪干细胞的成骨潜力。
1 材料与方法
1.1 实验细胞
选取大鼠脂肪干细胞,购自普诺赛(武汉)生物技术有限公司。
1.2 实验仪器及耗材
超声裂解仪(美国Fisher Scientific公司)、低温离心机(美国Eppendorf公司)、水浴锅(上海精宏实验设备有限公司)、蛋白电泳槽及转膜槽(美国Bio-rad公司)、脱色摇床(美国Thermo公司)、发光成像仪(上海天能科技有限公司)、便携式匀浆仪(美国Thermo公司)、PCR仪(美国Eppendorf公司)、Real-timePCR仪(美国ABI-7900公司)、激光共聚焦显微镜(日本Nikon公司)。茜素红试剂盒(北京Solarbio公司)、碱性磷酸酶染色剂(北京Solarbio公司)、质粒大提试剂盒(北京天根生化科技有限公司)、DMEM培养基(大连美仑生物技术有限公司)、胎牛血清(美国Gbico公司)、胰酶(北京利维宁生物科技有限公司)、PBS缓冲液(北京利维宁生物科技有限公司)、Bmp2一抗(北京博奥森生物技术有限公司)、Smad1/5一抗(北京博奥森生物技术有限公司)、P-Smad1/5一抗(北京博奥森生物技术有限公司)、OPN一抗(上海艾博抗贸易有限公司)、Dlx2一抗(北京博奥森生物技术有限公司)、驴抗兔二抗(北京金普来生物技术有限公司)、反转录试剂盒(美国Thermo公司)、q-PCR mix(北京百泰克生物技术有限公司)、OPN引物(生工生物工程(上海)有限公司)、Dlx2引物(生工生物工程(上海)有限公司)、-actin引物(生工生物工程(上海)有限公司)。
1.3 脂肪干细胞的培养
复苏脂肪干细胞,待细胞状态良好后,进行传代,吸去培养基,以无菌PBS缓冲液冲洗后,加入胰酶消化,在镜下观察到细胞皱缩后,加入完全培养基终止消化,进行传代,完全培养基采用90%DMEM培养基(右旋葡萄糖、左旋谷氨酰胺、丙酮酸钠、4-羟乙基哌嗪乙磺酸)加入10%胎牛血清配比而成。
1.4 过表达Bmp2质粒的转染
质粒干粉离心,加入无酶水溶解,抽取质粒加入到感受态细胞中,冰浴后热激,并迅速置于冰上,将感受态细胞加入到无抗性LB液体培养基中37℃,200 rpm进行摇菌,摇菌完成后使用涂布器将菌液均匀涂至卡那霉素抗性平板中培养过夜,次日挑取单克隆菌落至卡那霉素抗性液体培养基中37℃,200 rpm培养过夜,将完成培养的细菌进行质粒大提,提取完成的质粒测浓度。使用Thermo Lippo 3000试剂盒将过表达Bmp2质粒与脂肪干细胞共孵育进行转染,通过Western Blot验证转染效率后进行后续实验。
1.5 脂肪干细胞成骨基因相关蛋白的表达检测
转染72 h后,获取脂肪干细胞,加入RIPA裂解液及蛋白酶/磷酸酶抑制剂,超声破碎后,离心并收集上清液用于提取蛋白。再测定每组样品的蛋白浓度。用蛋白电转槽将蛋白转至PVDF膜上,再以5%脱脂牛奶室温封闭,TBST清洗后使用抗Bmp2一抗、抗Smad1/5一抗、抗P-Smad1/5一抗、抗OPN一抗、抗Dlx2一抗,抗-actin一抗在4℃条件下孵育过夜,用缀合辣根过氧化物酶的驴抗兔和山羊抗小鼠抗体孵育,TBST清洗后在化学发光成像仪中观察蛋白表达情况。所有实验生物学重复至少3次。
1.6 免疫荧光染色
荧光染色前将Vector组和过表达Bmp2组细胞于24孔板内进行细胞爬片后,4%多聚甲醛中室温固定,固定完成用PBS清洗,使用10%山羊血清室温封闭后直接使用OPN特异性一抗于4℃孵育过夜,孵育完成后使用PBST清洗,使用Alexa 488荧光二抗避光孵育,使用PBST避光清洗后进行DAPI核染,最后甘油封片,使用尼康A1共聚焦显微镜观察细胞荧光。
1.7 脂肪干细胞茜素红及碱性磷酸酶(ALP)染色
吸取茜素红染色剂,分别注入Vector组和过表达Bmp2组细胞培养瓶中,室温染色,超纯水清洗后,在荧光倒置显微镜下观察染色结果;吸取ALP染色剂,分别注入Vector组和过表达Bmp2组细胞培养瓶中,放置在37℃摇床中染色,超纯水清洗后在荧光倒置显微镜下观察染色结果。
1.8 统计学方法
数据使用GraphPad 8.0统计软件,蛋白条带及荧光强度均使用Image J进行分析,运用 检验比较两组间的差异,<0.05为差异有统计学意义。
2 结果
2.1 过表达Bmp2对脂肪干细胞茜素红(ARS)染色、碱性磷酸酶(ALP)染色的影响
通过对两组细胞进行茜素红染色,笔者发现过表达Bmp2组细胞表现出相对Vector组更加深染的茜素红染色,通过对茜素红进行定量,笔者发现过表达Bmp2组细胞相比Vector组,茜素红染色更深,表明细胞矿化增强。同样,过表达Bmp2组较Vector组显示出更明显的ALP染色,证明矿化程度增强(见图1)。

图1 A.茜素红染色分析脂肪干细胞过表达Bmp2后细胞表面钙盐沉积情况,碱性磷酸酶染色检测硫化钴沉淀,以判别碱性磷酸酶活性,标尺=50 m;B.ARS定量测定;C.ALP活性测定
2.2 过表达Bmp2对脂肪干细胞成骨基因蛋白表达的影响
与Vector组相比,过表达Bmp2组脂肪干细胞的Bmp2蛋白表达显著提高,差异具有统计学差异(<0.05)。p-Smad1/5的表达也在过表达组有显著提升(<0.05),而Bmp下游信号基因Smad1/5的表达则无统计学差异。笔者通过检测成骨基因Dlx2与OPN的表达,发现在过表达Bmp2组中Dlx2与OPN的表达相比Vector组有显著提升(<0.05),见图2。

图2 A.蛋白印迹分析过表达Bmp2后大鼠脂肪干细胞Smad1/5、p-Smad1/5、OPN、Dlx2的表达情况及验证转染效率;B.Bmp2蛋白表达的量化情况;C.Smad1/5蛋白表达的量化情况;D.Dlx2蛋白表达的量化情况;E.OPN蛋白表达的量化情况;F.p-Smad1/5蛋白表达的量化情况
2.3 过表达Bmp2对脂肪干细胞OPN荧光表达的影响
通过免疫荧光标记OPN对两组细胞进行荧光染色,笔者检测到过表达Bmp2组细胞的OPN荧光强度显著高于Vector组,差异具有统计学意义(<0.05),见图3。
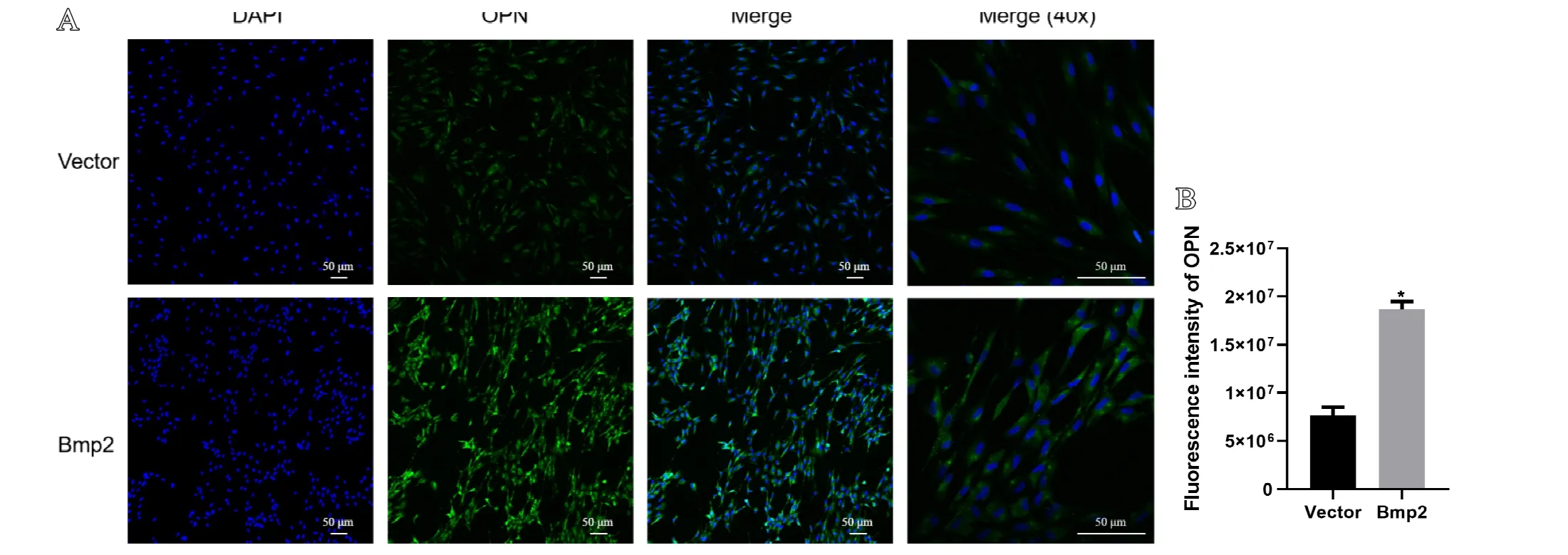
图3 A.免疫荧光分析过表达Bmp2对脂肪干细胞骨桥蛋白OPN表达的影响,最右侧图为40倍镜视野下OPN表达情况;B.OPN荧光强度的量化统计
3 讨论
本研究的重点是有效地利用ADSCs成骨潜力,来促进骨再生,达到临床广泛应用的目的。通过简单的手术,可以很容易地获得足够数量的ADSCs,与其他类型干细胞类似,具有干细胞的基本特征及多向分化潜力[10]。而Bmp2作为转化生长因子TGF-家族中的一员,在骨的生长和发育中起着重要作用。为验证Bmp2对激活脂肪干细胞成骨分化的潜能,笔者选取大鼠脂肪干细胞,通过转染Bmp2过表达质粒来检测脂肪干细胞的成骨分化能力。通过对脂肪干细胞进行成骨染色分析,笔者发现过表达Bmp2后细胞矿化明显增强,茜素红染色结果提示细胞周围钙盐沉积明显增强,而碱性磷酸酶染色结果则表现出更多的硫化钴沉淀,说明细胞的碱性磷酸酶活性明显增强。有研究指出,在实验室条件下1周内,ADSCs在分化过程中表现出明显的矿化作用,并在随后的每一代中均能保持其干细胞特征[11]。目前,ADSCs的成骨分化需要的时间相当长,而脂肪组织提取物的收集率较低。因此,为了加速骨再生,需要用各种细胞因子或生长因子预处理ADSCs。有研究表明,Bmp2在添加生长因子或是细胞因子后可以诱导ADSCs成骨分化。Risa等[12]分离人脂肪源性干细胞,观察重组人Bmp2(rhBmp2)和外源性添加Ca2+的作用,发现rhBmp2可促进hASCs内钙沉积,刺激参与hASCs成骨分化的6种蛋白:Runx 2、Osterix、碱性磷酸酶、骨连接蛋白、骨唾液蛋白和骨钙素的mRNA及蛋白表达。这与笔者的结果高度相似。如能对ADSCs进行特定的功能分析,并发现其定向分化的方法,以便已确定的干细胞可以立即进行临床应用,避免漫长的细胞培养过程。
虽然用Bmp2预处理ADSCs的结果是有效的,而且许多临床试验已经成功,但还有几个问题有待解决,如明确产生并发症的Bmp2剂量、Bmp2在体内的半衰期及成本问题。因此,局部Bmp基因治疗已被认为是从目标ADSCs中分泌Bmp的一种替代方式[13]。Bmp基因诱导的ADSCs不仅具有旁分泌和自分泌功能,可分泌靶向蛋白,分化为骨形成细胞,参与新骨形成[13],这种模式也在本研究中得到了证实。对过表达Bmp2的ADSCs进行基于成骨相关基因的蛋白检测,使我们得到了具有统计学意义和可重复性的结果,并通过qRT-PCR及免疫荧光进行了验证。笔者的实验结果表明脂肪干细胞在过表达Bmp2后Bmp下游通路中的Smad1/5表达无明显改变,p-Smad1/5的表达则明显升高,这提示Bmp可能使Smad1/5发生磷酸化而起到成骨分化作用。而进一步的实验也表明成骨相关蛋白Dlx2与OPN的表达上调同样较为显著。免疫荧光的结果同样提示过表达Bmp2促进成骨相关基因OPN的表达。除此之外,由于本次实验采用脂质体转染的方法,与使用慢病毒转染相比,其转染时效较为短暂,无法长期监测Bmp2及相关成骨基因在脂肪干细胞内的表达情况,不能确定随着时间推移,转染稳定性的变化情况,虽然质粒介导的基因治疗的表达周期较短,但这种特性不一定是缺陷,在某些不需要长期的基因表达的情况下可能是一个优势,如伤口愈合,额外的基因表达可能会导致其他严重的问题。Alden等[14]指出,短期Bmp基因表达不仅足以启动组织形成的级联效应,而且可能有利于防止组织过度生长,因长期过表达Bmp2可能引起骨质增生、骨刺形成等并发症。这促使人们对时间及空间控制骨再生的策略进行研究,如采用支架控释Bmp2,使其在一定时间内能持续定量输送Bmp2到指定位置,减少异位骨化、骨关节炎等并发症的产生。Krishnan等[15]使用海藻酸盐构建载体支架以控释Bmp2在大鼠股骨临界性节段缺损模型中的应用,虽然与胶原蛋白海绵载体相比,其控释速度较慢,且在第12周时的骨缺损面积较多,但胶原蛋白组的异位骨化率更高,这证实高剂量的Bmp2容易引起异位骨化,以及新骨形成的数量及空间模式取决于载体及递质。因此,质粒作为过表达Bmp2的载体,比病毒载体或许更适合骨缺损修复。通过使用脂质体转染骨形成基因可以上调成骨基因的表达,使得ADSCs在骨组织工程中的临床应用成为可能。
——一道江苏高考题的奥秘解读和拓展

