沉积相硒对夹杂带丝蚓的生物累积及效应研究
李 丹, 杨纪琛, 孙炜钧, 李 潇, 雷浩俊, 韦新蓉, 陈红星, 谢凌天
(1. 上海应用技术大学, 上海 201418; 2. 华南师范大学环境研究院/广东省化学品污染与环境安全重点实验室/华南师范大学环境理论化学教育部重点实验室, 广州 510006; 3. 华南师范大学环境学院, 广州 510006)
硒是人体生理必需的14种微量元素之一,在维持免疫、刺激生长和繁殖等各种功能上具有重要作用[1-2]。硒在地壳中含量很低且分布不均[3],但工农业活动(如废弃物排放、矿业开采、冶炼、加工运输、施肥及灌溉等)可能导致硒被大量排放到受纳水体中,主要以高可溶性无机硒(即亚硒酸盐(Se(Ⅳ))和硒酸盐(Se(Ⅵ)))和有机硒(硒代蛋氨酸 (Se-Met)、硒代半胱氨酸 (Se-Cys) 和其他有机硫化合物的硒取代类似物)形态存在[4-5]。硒被排放到水环境后,容易吸附在沉积矿物质和有机物的表面上[6],使沉积物成为硒的主要源和汇[7]。
天然沉积物中硒的质量分数在0.08~39 μg/g范围,其平均值约1.0 μg/g[8-11],而美国Belews湖和Kesterson水库沉积物中硒的质量分数分别高达100 μg/g和210 μg/g,主要以Se(Ⅳ)形态存在[8,12]。硒在沉积物中可以通过底栖生物的摄食行为进入食物链,在更高营养级的水生生物体内累积并造成毒性效应,包括致畸性[13]、神经毒性[14]、氧化应激[15]和异常行为[16]等。前期研究表明底栖无脊椎动物具有富集硒的能力,某些类群最高硒积累可达370 μg/g dw[8],从而使水体中其他摄食底栖生物的高营养级生物受到硒的危害。但目前对于沉积物中硒在底栖生物中的富集及对其产生毒性效应的机制研究较少。
本文主要研究:(1)沉积物中最常见的无机硒形态Se(Ⅳ)在环境相关浓度下对底栖模式生物夹杂带丝蚓(Lumbriculusvariegatus)的生物有效性;(2)沉积物中Se(Ⅳ)的暴露对夹杂带丝蚓体内硒形态分布的影响;(3)沉积物中Se(Ⅳ)的暴露对夹杂带丝蚓的Na+/K+-ATP酶、氧化应激反应以及消化系统的影响。本研究结果可为底栖环境中硒污染的预防和检测提供参考依据。
1 材料与方法
1.1 试验材料
亚硒酸钠(Se(Ⅳ),纯度>99%)购买自沈阳瑞丰精细化工有限公司,其他所有试剂均购自广州化学试剂厂。所有玻璃器皿均用50%硝酸清洗、去离子水漂洗3次,70 ℃下烘干后使用。
夹杂带丝蚓由华南师范大学水生毒理学实验室传代培养得到,每天饲喂1次约100 mg的孔雀鱼饲料(硒的背景值见表1)。在实验开始之前,随机选择大约300条大小相近(湿质量(4.0±0.5) mg,体长(22.0±2.0) mm)的夹杂带丝蚓成体,在光照14 h与黑暗10 h的光暗循环和(26±1) ℃的温度下,将夹杂带丝蚓 (Lumbriculusvariegatus,硒的背景值见表1) 培养在放有沉积物(深度约2 cm)和经过碳过滤的脱氯自来水(体积为12 L)的玻璃容器(容积为18 L)中,在没有食物和曝气的情况下驯化7 d。
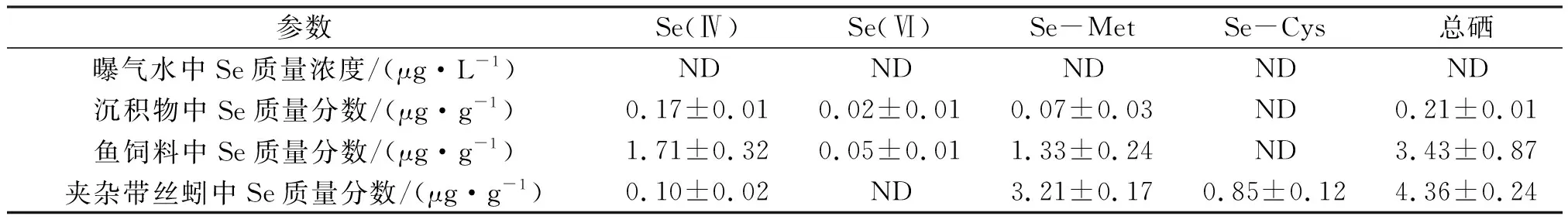
表1 曝气水、沉积物、鱼饲料和夹杂带丝蚓中不同形态硒的背景值Table 1 The background concentrations of different Se species in the exposure medium,sediments,fish food and L. variegatus
1.2 硒沉积物暴露
沉积物取自黑龙江省松花江上游(45.8oN,126.5oE),在-20 ℃下储存数周以上,以消除所有不可见的底栖生物。在加标前,去除上覆水,在室温(25 ℃)下解冻后对沉积物进行湿筛(500 μm)[17]。沉积物的有机物质量分数为(6.2±0.1)%,粉砂/粘土质量分数为(76.8±1.3)%,砂质量分数为(15.4±0.7)%,水分质量分数为(51.7±0.2)%(平均值±SE,n=3)。
实验前,通过电感耦合等离子体质谱法(ICP-MS)对松花江沉积物中总硒的背景值进行了定量(表1)。沉积物中不同Se形态的背景值通过高效液相色谱(HPLC)结合ICP-MS进行鉴定(表1)。
将100 g烘干过筛后的沉积物分配到酸洗过的玻璃烧杯中(容积为500 mL),根据硒在沉积物中的环境相关浓度(质量分数,全文同),分别设置低浓度组、中浓度组、高浓度组(即3个处理组),为了表述方便,称其为低、中、高浓度组。Se的质量分数分别为3、10、30 μg/g,在搅拌下将Se(Ⅳ)添加到每个容器中,加入约150 mL的曝气水作为上覆水,放置24 h达到平衡。每个质量分数设置3个重复实验,每个重复实验加入25条夹杂带丝蚓,在加入到沉积中物之前对25条带丝蚓统一称其质量并记录。实验期间监测温度、氧饱和度、pH以及总氨质量浓度。在加入硒的第1、2、3、4、5、6、7、14、21 d从4个容器中取出3份沉积物(每份沉积物40 mg)和上覆水(每份上覆水样品2 mL)样品,测定沉积物和上覆水中的硒在20 d内的形态和总量的变化。实验结束后,将实验生物从沉积物中筛选出,称其质量并记录数量,其他所有样品在-80 ℃冷冻保存,用于后续相关生化分析。
1.3 总硒及硒形态的检测
上覆水样品用微孔聚偏二氟乙烯(PVDF)膜(孔径0.22 μm,ANPEL,上海)过滤,并使用微波消解仪(型号 MARS6 240/50,CEM公司,美国北卡罗来纳州)在HNO3中165 ℃下消解30 min。将沉积物样品冻干约24 h至恒定质量,然后加入10 mL混合酸(5 mL HF、3 mL HNO3和2 mL HCl)中消解,在微波消解仪中190 ℃下消解40 min。解冻的夹杂带丝蚓样品(无干燥过程)加入8 mL HNO3后在微波消解仪中消化,190 ℃下消解40 min。消化物用超纯水进一步稀释至最终体积为50 mL,用微孔PVDF膜过滤后,使用ICP-MS测定总硒。ICP-MS 的操作参数:射频功率为1 200 W,等离子气体流量15 L/min,载气流量1 L/min,氦气流量5 mL/min,采样深度6 mm,八极杆偏置-18 V,能量鉴别5 V,单位质量积分时间0.3 s,监测的同位素包括78Se和82Se。标准参考物质(SRM)(GBW10024,GBW07309,国家有证参考物质研究中心,中国北京)用于测定总硒的回收率,SRM中硒的回收率分别为101%和99%。其他QA/QC包括加标样品和酸空白。以每5个样品中取1个的比率分析空白。
将每个重复实验中约20.0 mg的沉积物样品转移到装有20 mL EDTA(4 mmol/L,pH 7.5)的容积为50 mL的离心管中,并在40 ℃下以100 r/min 的转速在振荡器上振摇10 h,随后在3 000 r/min转速下离心10 min,上清液用微孔PVDF膜过滤[18],使用HPLC-ICP-MS分析样品中的硒形态。在每个重复实验中,取3条夹杂带丝蚓(约10 mg)样品在1 mL Tris-HCl缓冲液(30 mmol/L,pH 7.5,含1.4 mmol尿素和2 mg脂肪酶)中匀浆后,摇动1 h。加入4 μL 0.5 mol二硫苏糖醇和16.5 μL 0.5 mol碘乙酰胺后,将溶液在25 ℃下避光孵育。1 h后,加入22.5 μL二硫苏糖醇溶液,振荡1 h。加入2 mg型蛋白酶,将样品在转速为60 r/min的摇床上37 ℃避光孵育20 h。经过酶水解后,提取物以3 000 r/min的转速离心10 min[19]。上清液用微孔PVDF滤膜过滤,使用HPLC-ICP-MS分析样品中的硒形态。使用Agilent 1260 Infinity Ⅱ Ultra Performance LC系统(Agilent,USA)在Hamilton PRP-X100+色谱柱(4.1×250 mm,10 μm,Hamilton,USA)上分离样品中不同形态的硒。流动相为6 mmol/L柠檬酸盐缓冲液 (pH 5.0),流速为1.5 mL/min,温度25 ℃。ICP-MS的条件与测定总硒的条件相同。进样量为50 μL。本研究的检测限(LOD)和定量限(LOQ)分别为0.04和0.05 μg/L。水样的回收率为102%,沉积物样品的回收率为96%,生物样品的回收率为87%。
1.4 生化指标检测
每个重复取3条夹杂带丝蚓混合,用20 mmol Tris-HCl缓冲液(0.5 mol蔗糖,0.075 mol KCl,1 mmol MDTT,1 mmol EDTA,pH 7.6)匀浆。在4 ℃ 3 000g条件下,离心15 min,按照试剂盒用酶标仪测定过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)与胰蛋白酶、糜蛋白酶的活性以及总蛋白、丙二醛(MDA)和还原型谷胱甘肽(GSH)的含量。试剂盒均购自南京建成生物工程研究所。
1.5 数据分析
数据表示为平均值±标准差(SD),并通过 Kolmogorov-Smirnov检验检查正态性,通过Levene 检验检查方差的同质性。未检测到与正态性或同方差性的显著偏差。进行单向方差分析 (ANOVA),然后进行Tukey检验,以检测处理之间的差异。在P<0.05时接受统计显著性。使用 SPSS 22.0进行统计分析。
2 结果与讨论
在对照组、低浓度组、中浓度组和高浓度组中,沉积物初始总硒质量分数分别为0.25±0.00、3.25±0.00、10.25±0.00、30.25±0.00 μg/g干质量,上覆水中初始总硒质量分数为0.81±0.01、52.6±1.39、225.7±5.25、614.9±3.22 μg/L。在不同处理组中Se(Ⅳ)、Se(Ⅵ)、Se-Met和Se-Cys的质量分数见表2。在暴露21 d后,并无生物死亡。
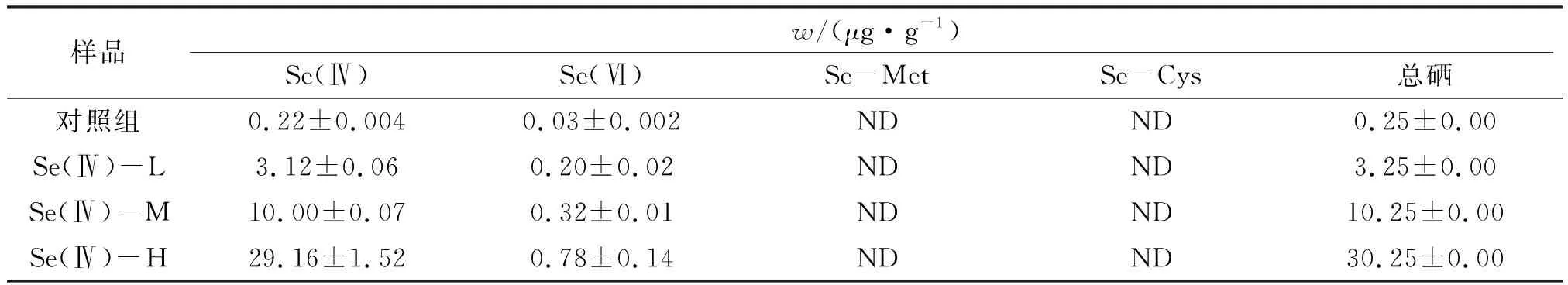
表2 不同处理组沉积物中不同形态硒的初始实测值Table 2 The initial concentrations of different Se species in all treatments
2.1 硒的形态分布
2.1.1 沉积物和上覆水中的硒 在Se(Ⅳ)处理的沉积物中,总硒质量分数在前7 d急速下降(范围-23.53%~-36.00%,负号表示下降,下同),后续下降缓慢并趋于稳定(图1A)。在Se(Ⅳ)处理的沉积物上覆水中,总硒质量分数的变化趋势与沉积物中的相似,在前7 d急剧下降,尤其是高浓度组(图1B)。Se(Ⅳ)处理的在沉积物和上覆水中主要以Se(Ⅳ)和Se(Ⅵ)为主,而且Se(Ⅳ)质量分数的变化趋势和总硒的相似(图2)。有趣的是,在中、高浓度组,Se(Ⅵ)质量分数在前3 d急速增加,然后快速下降至第7 d后平缓下降(图2C、D)。而上覆水中Se(Ⅵ)的质量分数相对于沉积物呈延迟效应,在前6 d上升,第7 d开始下降,至21 d干质量接近于0 μg/g(图2G、H)。
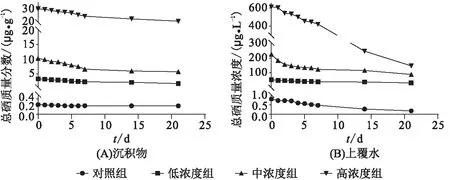
图1 沉积物及上覆水中总硒质量分数随时间的变化Figure 1 The variations of total Se concentrations in the sediments and overlying water with time注:分析中n=3,全文同。

图2 沉积物及上覆水中硒形态的变化Figure 2 The variations of Se species in the sediments and overlying
硒在天然水体中的沉积物或上覆水系统中约占98%,其中硒在沉积物中约占90%[7],因此,硒在沉积物或上覆水中的动态平衡不可忽视。Se(Ⅳ)对沉积物中的有机质、粘土矿物和铁氧化物具有较高的吸附性[20],是沉积物中主要的无机硒形态,且具有适中的氧化还原电位[21]。在中、高浓度组中,在前3 d Se(Ⅵ)的质量分数上升可能由于夹杂带丝蚓受高质量分数Se的胁迫作用而在沉积物中频繁搅动,进而提升上覆水中Se(Ⅵ)的质量分数,同时沉积物中的含氧量增加,导致Se(Ⅳ)被氧化成Se(Ⅵ)。第3 d以后,带丝蚓适应暴露环境后,Se(Ⅵ)质量分数随总硒质量分数的下降而减小。总硒质量分数的下降可能由于随着暴露时间的延长,沉积物中Se(Ⅳ)被还原成元素硒或者气态硒化物[1,22]。
2.1.2 夹杂带丝蚓中的硒 当暴露在Se(Ⅳ)环境21 d后,夹杂带丝蚓体内总硒质量分数随着暴露质量分数的升高而增大,在体内主要以Se-Met和Se-Cys这2种硒形态为主(图3)。结果表明:Se(Ⅳ)进入生物体内可以迅速发生生物转化生成Se-Met和Se-Cys,这可能是由于无机硒可以迅速与体内的蛋氨酸和半胱氨酸结合[23],但是具体转化机制需要进一步研究。

图3 夹杂带丝蚓中总硒和硒形态的变化Figure 3 The variations of total Se concentrations and Se species in the L. variegatus
带丝蚓对沉积物中硒的BAF数值在低、中、高浓度组中分别为8.00±1.11、7.89±0.90和4.59±0.41(图4)。有趣的是,低、中浓度组中夹杂带丝蚓对沉积物中硒的BAF数值是高浓度组中的2倍。
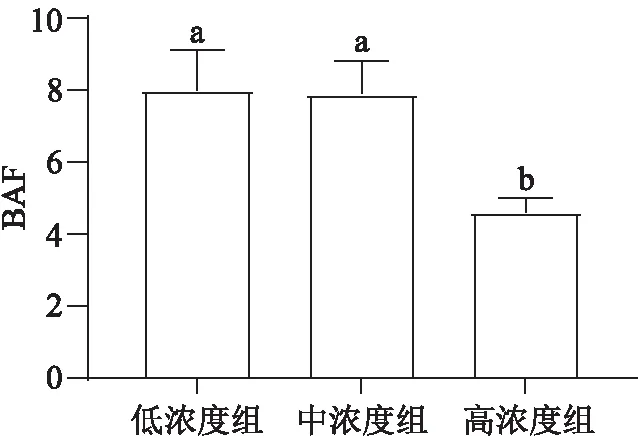
图4 夹杂带丝蚓体内硒的生物富集系数Figure 4 Bioaccumulation factors of Se in the L. variegatus
对比BAF数据发现,夹杂带丝蚓在沉积物中硒质量分数小于10 μg/g时富硒能力相似,但是当沉积物中硒质量分数过高时可能损伤夹杂带丝蚓体内的一些生化指标(如离子通道、氧化应激和消化系统等相关酶)。因此,沉积物中高质量分数的硒会降低底栖生物对硒的富集能力。例如,在沉积物中硒暴露正颤蚓(1.2 μg/g Se(Ⅳ))、夹杂带丝蚓(20 μg/g Se(Ⅳ))和霍甫水丝蚓(40 μg/g Se(Ⅳ))14 d后,其对沉积物中硒的BAF分别为5.92、0.55和0.70[1,17,24]。
2.2 硒暴露对夹杂带丝蚓体内Na+/K+-ATP酶的影响
当暴露在Se(Ⅳ)中21 d后,夹杂带丝蚓体内Na+/K+-ATP酶的活性随着Se(Ⅳ)暴露质量分数(0~30 μg/g (Se))逐渐降低(-14.62%、-24.55%、-54.24%)(图5)。与前期研究结果相似,夹杂带丝蚓在含Se质量分数为20 μg/g的Se(Ⅳ)中暴露14 d,Na+/K+-ATP酶的活性也显著下降[17]。也有研究表明,Se(Ⅳ)抑制小鳉鱼体内Na+/K+-ATP酶的活性[25]。此外,高浓度组中Na+/K+-ATP酶的活性与低、中浓度组具有显著差异性,与BAF的变化趋势相同。重金属通过主动运输进入到细胞内部需要消耗三磷酸腺苷(ATP)酶来提供逆浓度运输所需要的能量,而硒能够氧化ATP酶分子中的巯基,抑制ATP酶的活性[17,26]。因此,沉积物中高浓度Se(Ⅳ)可能损伤带丝蚓的Na+/K+-ATP酶,进而影响带丝蚓对硒的吸收能力。
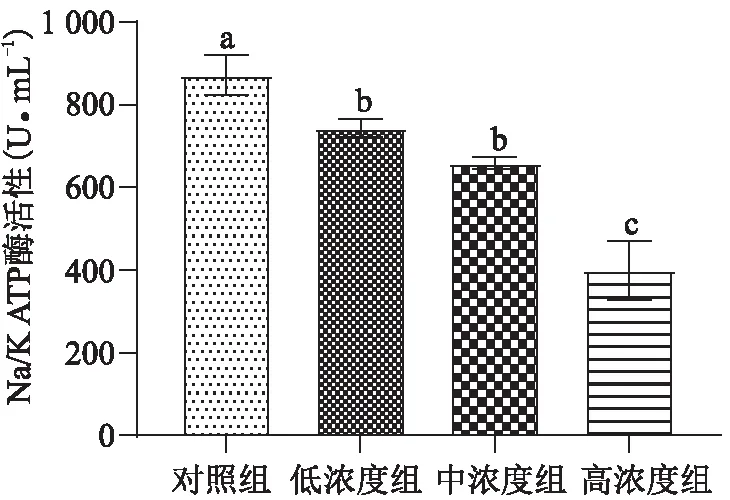
图5 硒暴露对夹杂带丝蚓Na+/K+-ATP酶的影响Figure 5 The effect of Se on the Na+/K+-ATP enzyme activities of L. variegatus
2.3 硒暴露对夹杂带丝蚓抗氧化系统的影响
当暴露在Se(Ⅳ)中21 d后,夹杂带丝蚓体内过氧化氢酶的活性不受影响(图6 A),而带丝蚓体内的谷胱甘肽和脂质过氧化水平(丙二醛的质量分数)随着Se(Ⅳ)暴露质量分数(0~30 μg/g Se)逐渐升高,如图6B(5.25%、36.58%、42.1%)和图6D(7.96%、135.10%、500.29%),谷胱甘肽过氧化物酶随着Se(Ⅳ)暴露质量分数增大而逐渐降低(44.17%、75.42%和91.80%,图6C)。研究表明:霍甫水丝蚓和夹杂带丝蚓暴露于20 μg/g Se(Ⅳ)中14 d后,体内脂质过氧化水平也均显著升高[17,27]。
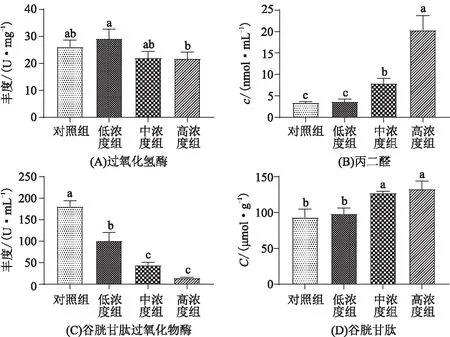
图6 硒暴露对夹杂带丝蚓抗氧化系统的影响Figure 6 The effect of Se on the oxidative stress of L. variegatus
2.4 硒暴露对夹杂带丝蚓消化系统的影响
Se(Ⅳ)暴露带丝蚓21 d后,相对于空白对照组,夹杂带丝蚓的肥满度在低、中浓度组中轻微升高,而在高浓度组中下降,但并没有显著差异性(图7A),与夹杂带丝蚓体内胰蛋白酶的活性和糜蛋白酶的活性呈现趋势相似(图7B~C)。在高浓度组中,硒显著降低了夹杂带丝蚓体内胰蛋白酶的活性(-12.47%)(图7B)。对于糜蛋白酶,高浓度的硒增加了夹杂带丝蚓体内糜蛋白酶的活性(+122.51%);而在中、高浓度组中,夹杂带丝蚓体内糜蛋白酶的活性显著降低了75.53%和91.03%,呈现“低促-高抑”现象(图7C)。

图7 硒暴露对夹杂带丝蚓肥满度及消化系统的影响Figure 7 The effect of Se on the condition factor and the digestive system of L. variegatus
胰蛋白酶和糜蛋白酶都是可以参与蛋白质氨基酸代谢的活化酶,通过把生物消化道内的蛋白质分解为氨基酸,使蛋白质被机体吸收和利用[28]。一些研究表明重金属可以降低水生生物体内的胰蛋白酶和糜蛋白酶活性。例如:镉(10 μg/L)暴露48 h后,大型溞体内胰蛋白酶活力明显降低[29];镉(1.45 mg/L)暴露河南华溪蟹21 d后,肠道内胰蛋白酶活力显著降低[30]。此外,硒可能导致体内产生过量的ROS,进而降低糜蛋白酶的活性[31]。夹杂带丝蚓体内消化酶活力的降低会直接影响大分子物质的分解,消化能力变弱会降低机体对营养物质的吸收,从而影响其生长发育,间接反映重金属对底栖生物的危害程度。因此,高浓度硒明显抑制夹杂带丝蚓体内的胰蛋白和糜蛋白酶活力,对机体消化系统造成损伤,降低其肥满度。
3 结论
硒在环境相关浓度下可以在夹杂带丝蚓体内有效累积,在体内主要以Se-Met和Se-Cys为主。随着沉积物中硒的浓度增加,增加带丝蚓体内氧化应激反应、降低Na+/K+-ATP酶以及消化系统相关酶活性,从而抑制带丝蚓的肥满度以及对沉积物中硒的生物富集能力。此外,本研究结果可以为硒在底栖生物中的累积及其形态的分布,以及毒性效应提供基础数据,为水生生态系统的保护、水产品的食品安全及水环境标准完善提供重要的理论依据。

