一种环境敏感型造礁石珊瑚Pocillopora sp.共生虫黄藻和细菌的生态特征
梁甲元 ,邓传奇,许勇前,覃良云,陈金妮,葛瑞琪,黄学勇,余克服*
(1.广西大学 海洋学院,广西 南宁 530004;2.广西南海珊瑚礁研究重点实验室,广西 南宁 530004)
1 引言
珊瑚礁生态系统拥有极高的生物多样性和初级生产力[1-2],这要归功于其体内庞大的共生微生物类群(虫黄藻、细菌、真菌、原生生物、病毒等)[3],它们在能量供给、物质循环、疾病防御等方面发挥着重要的作用[4-7]。然而,这些微生物的群落结构和多样性长期处于动态变化之中,跟珊瑚宿主的种类和外环境的扰动密切相关[8-9]。深入了解珊瑚共生微生物的生态特征有助于揭示珊瑚宿主的环境适应机制,对珊瑚礁未来的演化趋势提供理论认识。
余克服课题组曾对南海不同珊瑚礁区珊瑚共生虫黄藻的密度、种群多样性、群落结构、遗传进化等进行了较详细的研究。结果得出:随着纬度的升高(从南沙群岛至大亚湾),虫黄藻密度逐步增加,由此推测相对高纬度珊瑚健康状况更好,高纬度珊瑚区很可能会成为南海珊瑚的避难所[10-11];然而,中、低纬度珊瑚礁区(北礁、黄岩岛、三角礁和信义礁)比高纬度(大亚湾、防城港和涠洲岛)的珊瑚具有更高的共生虫黄藻种群多样性[12];具有耐热特性的虫黄藻(Durusdinium trenchii),其在珊瑚体内的相对丰度在低纬度的珊瑚宿主中相对较高,即与年均海表温度(Sea Surface Temperature,SST)呈正相关[13]。同时,该课题组也对南海不同珊瑚礁区珊瑚共生细菌的多样性做过研究。结果得出:南海不同珊瑚礁区(大亚湾、涠洲岛、鹿回头、黄岩岛、信义礁和三角礁)珊瑚共生固氮细菌的多样性非常丰富,并且群落组成与礁区环境存在显著相关性(p≤0.05)[14];对南海热带区域种疣状杯形珊瑚(Pocillopora verrucosa)与亚热带区域种盾型陀螺珊瑚(Turbinaria peltata)的细菌多样性、群落组成以及交互作用网络特征进行了分析,疣状杯形珊瑚核心细菌类群的相对丰度显著降低,推测这与人类活动相关。此外,细菌多样性的变化可能会改变珊瑚微生物交互作用网络的复杂度,进而影响微生物群落的稳定性、珊瑚共生功能体的功能以及珊瑚的环境适应潜力[15]。此外,Tong 等[16]也曾选取南海3 个具有纬度差异的礁区,研究了珊瑚与共生藻的关系,发现温度是影响3 个礁区珊瑚共生藻多样性的主要环境因素。Ziegler 等[17]的研究也发现,不同温度环境下的珊瑚共生细菌群落结构有显著差异。目前,对于南海珊瑚礁大跨度层面的研究大多侧重于珊瑚共生微生物多样性或者单一共生成员的生态特征(虫黄藻或者细菌)方面。这些庞大的微生物类群在细胞数量上的生态调节特征却知之甚少。因此,基于16S rRNA 基因扩增子测序技术与细菌生物量评估相联系[18],可以很好地探究不同生境下珊瑚共生微生物的群落结构与生物量的生态分布特征。
南海4°~21°N 的纬度范围内分布有大面积的珊瑚礁区[19]。这些珊瑚礁长期以来受到极端海洋事件(厄尔尼诺、强风暴、高频冬季降温等)、人类活动和地理气候的影响[19-23],是研究珊瑚环境适应机制和演化趋势的天然实验室。其中,杯形珊瑚(Pocillopora)在南海的分布较为广泛,是一种环境敏感型的枝状珊瑚。在实验室中已有对珊瑚Pocillopora damicornis共生微生物组的热响应和酸化响应特征做过研究[24-25]。鉴于此,本研究选取采自南海3 个不同纬度珊瑚礁区具有代表性的一种环境敏感型造礁石珊瑚—杯形珊瑚(Pocilloporasp.)为研究对象(图1),重点分析虫黄藻和细菌两种关键共生微生物的生态特征以及环境因子相关性,旨在为探讨珊瑚适应环境变化的微生态机制以及未来进化趋势提供更全面的认识。

图1 采样位点(a)与珊瑚(Pocillopora sp.)的形态(b)Fig.1 Sampling sites (a) and the morphology of coral Pocillopora sp.(b)
2 材料与方法
2.1 采样点与样品采集
珊瑚样品在2017 年5 月和2018 年5 月的两个航次中从南海3 个不同纬度的珊瑚礁区采集(图1):南沙群岛(NS:9°~11°N,115°~116°E)、西沙群岛(XS:15°~17°N,110°~113°E)和海南岛陵水(LS:18°30′N,110°07′E)。这3 个主要珊瑚礁区处于热带海域均受到南部和西南部季风气候的影响。其中,南沙群岛位于南海最南端,年均SST 为28.6℃,距离海南岛约1 000~1 600 km,受人类活动干扰较小,珊瑚群落多样性较高[26]。西沙群岛位于南海的中北部,是南海四大岛屿之一,气候与南沙群岛相似,年均SST 为27.48℃。海南陵水位于海南省东南沿海附近,该区域的珊瑚礁是一个典型的岸礁,受人类活动干扰较大,年均SST 为26.7℃。
携带凿子、铁锤和网兜,使用水肺潜水(SCUBA)的方式潜入水下6 m 上下采集目标珊瑚样本(图1),相同珊瑚礁区所采集的珊瑚个体间隔距离在5 m 左右。珊瑚样品出水后用无菌海水冲洗3 遍,立即装入无菌密封袋并置于液氮中速冻,随后置于冰箱(-20℃)带回实验室备用。共采集50 株Pocilloporasp.样品(直径约5 cm),其中在NS 采集20 株,XS 采集19 株,LS 采集11 株。珊瑚种类的鉴定主要依据其表型和碳酸钙骨骼的类型来进行,可以鉴定到属水平。
2.2 采样点相关环境数据
3 个珊瑚礁区年均SST 通过美国国家海洋和大气管理局(NOAA)卫星数据获得,其他环境数据,如可溶性活性磷(Soluble Reactive Phosphorus,SRP)、光合有效辐射(Photosynthetic Active Radiation,PAR)、溶解无机氮(Dissolved Inorganic Nitrogen,DIN)、颗粒有机碳(Particulate Organic Carbon,POC)、叶绿素a(Chlorophylla,Chla)浓度以及透明度,从本团队已发表的文献[27-29]中获得。
2.3 珊瑚总DNA 的提取
剪取约2 cm 长的短枝,用吸水纸除去附着在表面的水分,精确测量短枝的重量和表面积(珊瑚的表面积根据铝箔重量和表面积之间的相关性计算确定[30])。研钵中加入液氮将所剪取的珊瑚短枝研磨成浆,精确量取90 mg 的研磨样品(包括碳酸钙和珊瑚组织)使用天根海洋动物基因组DNA 提取试剂盒(中国北京天根生物技术有限公司)对每个珊瑚样品的总DNA 进行提取。提取的DNA 经过琼脂糖凝胶电泳和紫外A260/A280 吸收峰检测以确定质量合格。同时,根据多次计算珊瑚重量和表面积之间的对应关系,准确得出90 mg 珊瑚对应的表面积。
2.4 珊瑚共生虫黄藻系群组成与密度
以珊瑚总DNA 为模板,利用虫黄藻核糖体内部转录间隔区(ITS2)的特异性引物ITSintfor2(5′-GAATTGCAGAACTCCGTG-3′)和ITS2-reverse(5′-GGGATCCATGCTTAAGTCAGCGGT-3′)进 行PCR 扩增[31]。PCR 扩增体系和反应程序按照Chen 等[12]的方法进行。PCR 产物利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用Quanti-Fluor™-ST(Promega,USA)进行检测定量。根据Illumina MiSeq 平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建PE 2 x 300-pb 双端测序文库。利用Illumina 公司的Miseq PE300 平台进行测序(上海美吉生物医药科技有限公司)。Illumina MiSeq 平台输出数据的质量控制使用Trimmomatic 软件,按照Bolger 等[32]的方法进行。使用Zhang 等[33]开发的PEAR 方法获得ITS2 rDNA 片段。序列质量修剪和嵌合体检查用MOTHUR 软件进行(version 1.30.2,https://www.mothur.org/wiki/Download_mothur)。序列比对分析是基于Chen 等[12]建立的非重复ITS2数据库中的信息,通过本地比对搜索进行。利用Microsoft Excel 计算每个样品中共生虫黄藻系群对应序列的相对丰度。
珊瑚共生虫黄藻密度(单位:cells/cm2)的分析按照文献[34]的操作进行。使用无菌海水用洗牙器(WaterpikTM,3~5 kgf/cm2)将珊瑚组织冲洗下来,用量筒测量初始冲洗液的体积。取3 mL 冲洗液进行离心(6 500 r/min)去上清液收集虫黄藻细胞。底部的虫黄藻细胞用1 mL5%的甲醛溶液重悬,在低温条件下(4℃)放置2~4 h。用血球细胞计数法对虫黄藻细胞进行计数。
2.5 珊瑚共生细菌群落结构与16S rRNA 基因拷贝数绝对定量
以珊瑚总DNA 为模板,利用细菌的16S rRNA 基因特异性引物27F(5′-GAGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACCTTGTTACGACTT-3′)进行PCR扩增该基因的全长序列。PCR 产物进行纯化、定量和均一化形成测序文库(SMRT Bell),应用PacBio Sequel 单分子实时测序系统进行测序(北京百迈客生物科技有限公司)。对原始下机的subreads 进行校正得到CCS(Circular Consensus Sequencing)序列(SMRT Link,version8.0),使用lima(v1.7.0)软件通过barcode 序列识别不同样品的CCS 序列并去除嵌合体(UCHIME[35],version 8.1),得到高质量的CCS 序列。在相似性97%的水平上对序列进行聚类(USEARCH[36],version 10.0),以测序所有序列数的0.005%作为阈值过滤操作分类单元(Operational Taxonomic Unit,OTU)[37]。序列比对数据库选择细菌16S:Silva(Release132,http://www.arbsilva.de)。物种注释使用RDP Classifier 软件,置信度阈值设为0.8(version 2.2,http://sourceforge.net/projects/rdpclassifier/)。Alpha 多样性指数分析采用Mothur 软件(versionv.1.30,http://www.mothur.org/)。
利用Eub338(5′-ACTCCTACGGGAGGCAGCA G-3′)和Eub518(5′-ATTACCGCGGCTGCTGG-3′)引物对细菌16S rRNA 基因的一个172 bp 区域进行SYBR GreenⅠ定量PCR,以测定90 mg 珊瑚样品中细菌16S rRNA 基因拷贝数,进而计算出珊瑚单位表面积所含共生细菌16S rRNA 基因的拷贝数(单位:cm-2)。根据珊瑚Pocilloporasp.的质量与表面积的对应关系(Y=4.151X+0.319 7,R2=0.97,Y为表面积,单位:cm2,X为质量,单位:g),可以准确计算出90 mg 样品对应的表面积,进而计算出每平方厘米珊瑚表面积中的细菌16S rRNA 基因的拷贝数。在9 600 plus 荧光定量PCR仪上进行(Bioer,中国杭州)进行qPCR。20 μL 的反应体系包含10 μL ChamQ SYBR Color qPCR Master Mix(2X)、2 μL DNA 模板、引物各0.4 μL(10 μmol/L)、7.2 μL的ddH2O。反应程序为:95℃预变性3 min,然后95℃变性30 s,56℃退火30 s,72℃延伸40 s,共进行35 个循环,得出溶解曲线。将已知拷贝数(1.667 2×1010μL-1)的含有16S rRNA 基因PCR 扩增子片段的pMD18-T 质粒连续稀释至10-3~10-8,用于制备标准曲线。以缓冲液和水为阴性对照。基于循环阈值(Ct值)与每个模板初始拷贝数的对数呈线性关系,因此,只要得到定量珊瑚样品的Ct值,就可以从标准曲线中计算16S rRNA 基因的初始拷贝数。
2.6 统计分析
虫黄藻密度和细菌16S rRNA 基因拷贝数均进行无参Kruskal-Wallis 检验,以验证各组份的显著性。采用SNK 检验进行多重比较以进一步分析显著性。所有数据均以平均值±标准差(SD)表示。统计的显著性水平设为0.05,p<0.05 为差异显著。使用Canoco 4.5 软件进行冗余分析(Redundancy Analysis,RDA)或主坐标分析(Principal Co-ordinates Analysis,PCoA)以检验环境因素和珊瑚共生虫黄藻、细菌之间的相关性。
3 结果与分析
3.1 珊瑚共生虫黄藻密度及系群结构
造礁石珊瑚组织中共生虫黄藻细胞的密度是一个反映珊瑚礁生态状况的重要指标。南海大纬度跨度的环境敏感型珊瑚Pocilloporasp.共生虫黄藻密度表现出随纬度的增加而升高(p<0.05)(图2)。NS 珊瑚共生虫黄藻密的平均值为(3.39±0.49)×105cells/cm2,XS 的为(5.53±0.50)×105cells/cm2,而较高纬度LS 的则为(8.90±0.65)×105cells/cm2。3 个珊瑚礁区Pocilloporasp.共生虫黄藻密度存在显著的差异(Kruskal-Wallis检验,p=0.001<0.05)。
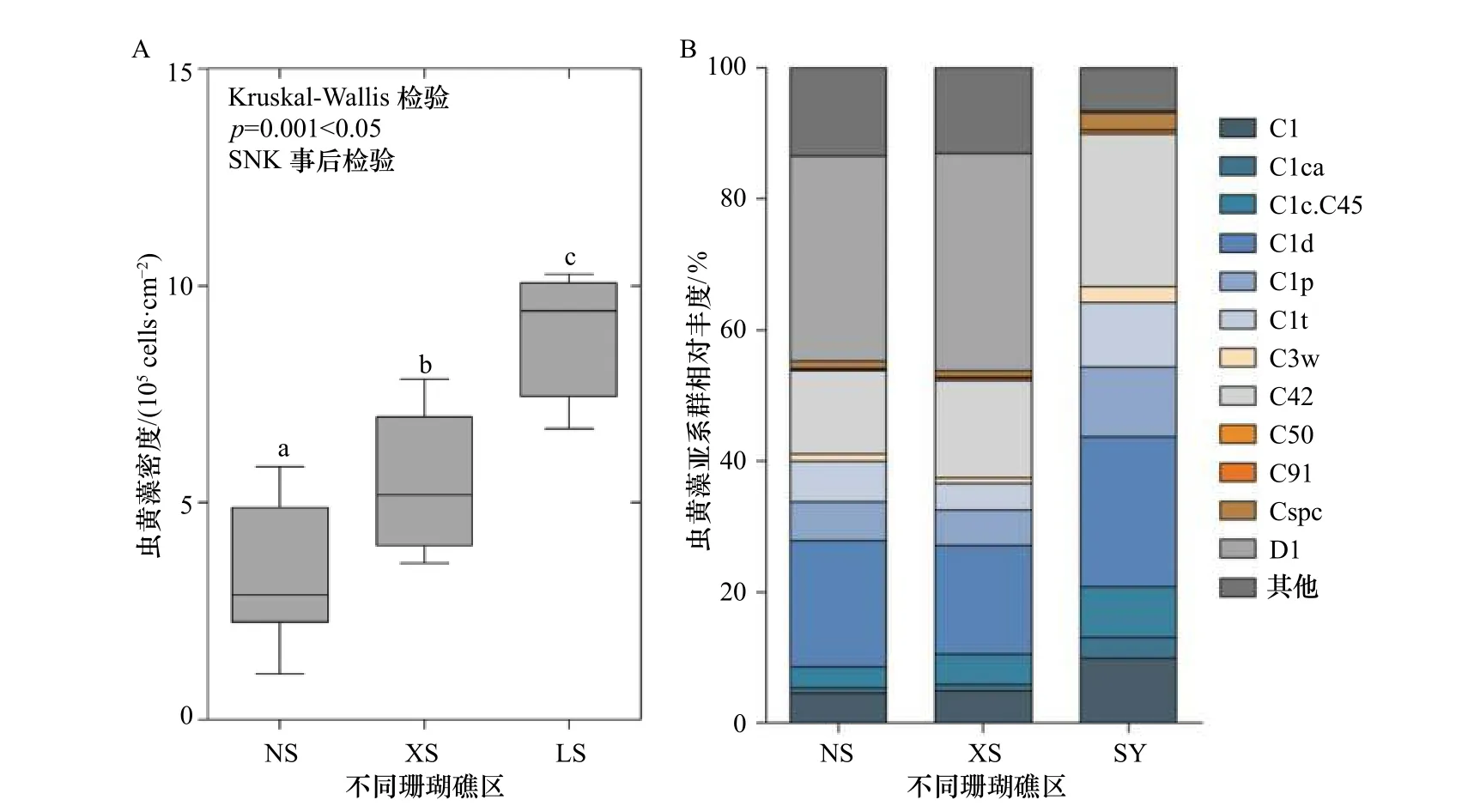
图2 不同珊瑚礁区Pocillopora sp.共生虫黄藻密度(A)和基于ITS2 序列分析的亚系群组成的变化(B)Fig.2 Change in Symbiodiniaceae density (A) and ITS2 sequence-based subclade composition (B) of Pocillopora sp.from different coral reef areas
基于ITS2 的分子标记共分析了50 个珊瑚样品,单个样品的测序量在30 332~73 752 之间,每条序列长度在281~300 bp 之间。随机抽取一定数量的序列,统计得出稀释曲线,并且曲线全部达到平缓趋势,判断所有样品测序数据量是否足够。经过序列相似性聚类与比对分析显示,NS 珊瑚共生虫黄藻的亚系群组成与XS 的较为相似,而较高纬度LS 的则与该两个礁区的差别较大(图2)。整体上,珊瑚Pocilloporasp.共生虫黄藻主导亚系群平均相对丰度NS 的为D1(31.3%)、C1d(19.1%)和C42(12.8%);XS 的为D1(33.2%)、C1d(16.5%)和C42(14.8%);而更高纬度LS 的则为C42(23.3%)、C1d(22.8%)、C1p(10.6%)、C1(9.9%)和C1t(9.9%)。较为特别的是,在NS 和XS 的珊瑚共生虫黄藻以C 系群和D 系群为主导,而一向被认为具有耐热特性的D 系群在相对高纬度的LS 珊瑚中相对丰度很低(只有0.27%)。综上所述,环境敏感型珊瑚Pocilloporasp.共生虫黄藻密度及系群组成在纬度空间上差异明显。
3.2 珊瑚共生细菌多样性及16S rRNA 基因拷贝数分析
基于16S 全长的分子标记共分析了50 个珊瑚样品,单个样品的测序量最低为4 234 条有效序列,序列长度均在1 200~1 650 bp 之间。OTU 聚类、序列比对、物种注释等分析显示,珊瑚Pocilloporasp.共生细菌包含23 门、41 纲、98 目、179 科、382 属、515 种(未包括未定种)和2 246 个不同的OTU。ACE 和Chao指数是衡量珊瑚共生细菌物种丰富度的指数,而Shannon 和Simpson 指数是衡量珊瑚共生细菌物种多样性的指数。在低纬度NS 和XS 的珊瑚中,ACE 和Chao 指数相对较低,而在相对高纬度的LS 该指数较高(表1)。3 个不同纬度珊瑚礁区珊瑚共生菌的Shannon和Simpson 指数无明显差异(Kruskal-Wallis 检验,p>0.05)。上述结果表明,随着纬度的增高,珊瑚Pocilloporasp.共生细菌物种丰富度升高。
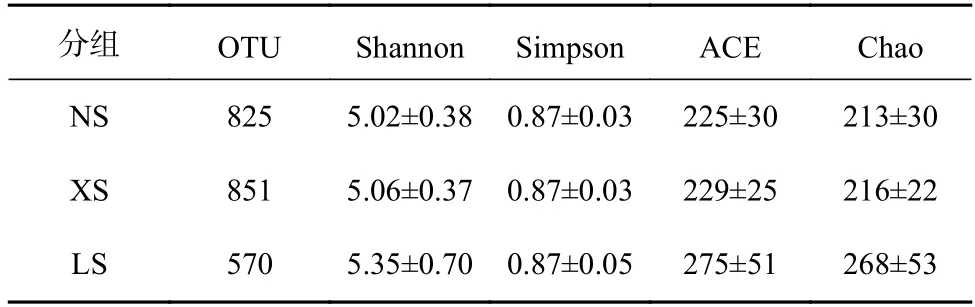
表1 珊瑚共生细菌OTUs 统计及Alpha 多样性Table 1 OTUs statistics and Alpha diversity of coral-associated bacteria
在OTU 水平上基于非加权Binary_jaccard 算法的PCoA 分析(PERMANOVA 检验)表明,不同纬度珊瑚礁区珊瑚Pocilloporasp.共生细菌群落结构组成上具有显著的差异(R2=0.092,p=0.008<0.05)(图3)。
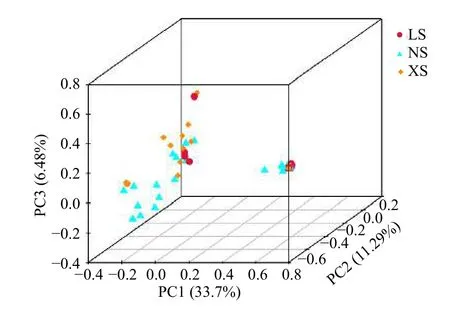
图3 基于共生细菌OTUs 的主成分分析(PCA 分析)Fig.3 Principal component analysis based on bacterial OTUs从LS 采集的样品数为11 个,NS 为20 个,XS 为19 个The number of samples collected from LS,NS,and XS were 11,20,and 19,respectively
为了量化珊瑚Pocilloporasp.体内的细菌生物量,我们通过荧光定量PCR 检测了样品中16S rRNA 基因的绝对拷贝数。结果显示,16S rRNA 基因拷贝数至少达到每平方厘米珊瑚表面积有(5.20±0.27)×107个(图4)。在低纬度NS 和XS 的珊瑚中共生细菌16S rRNA 基因拷贝数没有显著差异(平均值分别为(1.08±0.22)×108cm-2和(1.25±0.21)×108cm-2),但是在高纬度LS 的珊瑚中细菌16S rRNA 基因拷贝数则显著比NS 和XS 的高(Kruskal-Wallis 检验,p=0.001<0.05),达到(2.37±0.24)×108cm-2。总体而言,从低纬度热带海域NS 和XS 到高纬度亚热带海域LS,珊瑚共生细菌生物量呈现递增的趋势。这表明珊瑚共生细菌生物量在空间分布上具有差异性。
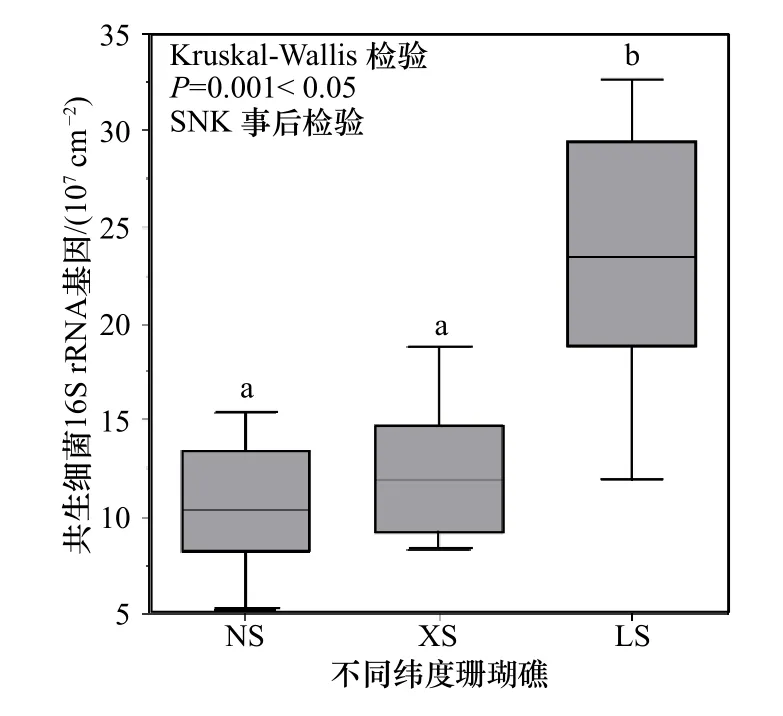
图4 不同纬度珊瑚共生细菌16S rRNA 基因绝对拷贝数Fig.4 The absolute number of 16S rRNA gene copies in coral endosymbiotic bacteria at different latitudes
不同珊瑚礁区珊瑚Pocilloporasp.共生细菌在门水平上的组成相似,均以变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)和厚壁菌(Firmicutes)为主导类群(图5a)。而具有光合作用功能的蓝细菌(Cyanobacteria)在低纬度NS 和XS 的珊瑚中相对丰度极低(约1.5%),在相对高纬度LS 的珊瑚中其相对丰度则较高(8.18%),即随着纬度的增高其相对丰度显著升高(Kruskal-Wallis 检验,p<0.05)。其次,细菌门Deinococcota 在低纬度NS 和XS 的珊瑚中相对丰度约为5%,而在相对高纬度LS 的珊瑚中却没有检测到;细菌门Fusobacteriota 在相对高纬度LS 的珊瑚中其相对丰度(3.51%)显著比低纬度NS 和XS 的高(Kruskal-Wallis 检验,p<0.05)。
不同珊瑚礁区珊瑚Pocilloporasp.共生细菌在属水平上的组成差异较大(图5b)。其中,细菌属Amoebophilus和Alteromonas在低纬度NS 和XS 的珊瑚中其相对丰度较高(约10%);XS 的珊瑚中还有相对丰度为11%的细菌属Endozoicomonas,这一点明显与NS 的不同。此外,在低纬度NS 和XS 的珊瑚中还分别检测到相对丰度约为5%的细菌属Thermus,而这类栖热菌属在高纬度LS 的珊瑚中却没有发现。
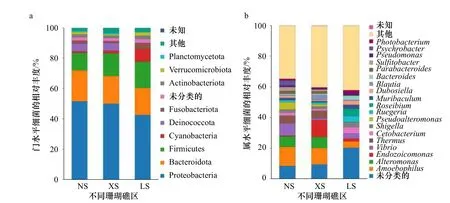
图5 细菌群落组成Fig.5 Bacterial community composition
3.3 珊瑚共生微生物生态特征与环境因子的关联性
对3 个不同纬度珊瑚礁区珊瑚Pocilloporasp.共生微生物生态特征和相关环境因素之间进行关联性分析。RDA 分析显示,许多环境因子都影响着珊瑚共生微生物的组份(图6)。珊瑚共生虫黄藻密度、细菌数量以及蓝细菌相对丰度与营养盐(SRP、DIN和POC)和光合有效辐射(PAR)呈显著正相关,与SST 和透明度呈显著负相关。在虫黄藻亚系群组成方面,低纬度NS 和XS 珊瑚共生主导系群D1 与SST和透明度呈正相关,与营养盐呈显著负相关;高纬度LS珊瑚中占主导的虫黄藻C42 亚系群则与SST 呈显著负相关、与营养盐呈显著正相关。通常,虫黄藻D 系群被认为是耐热型,而C 系群则是热敏感型。随着纬度增高,年均SST 随之降低,而珊瑚共生的虫黄藻主导系群也由D 型演化为C 型,这是环境适应的体现。
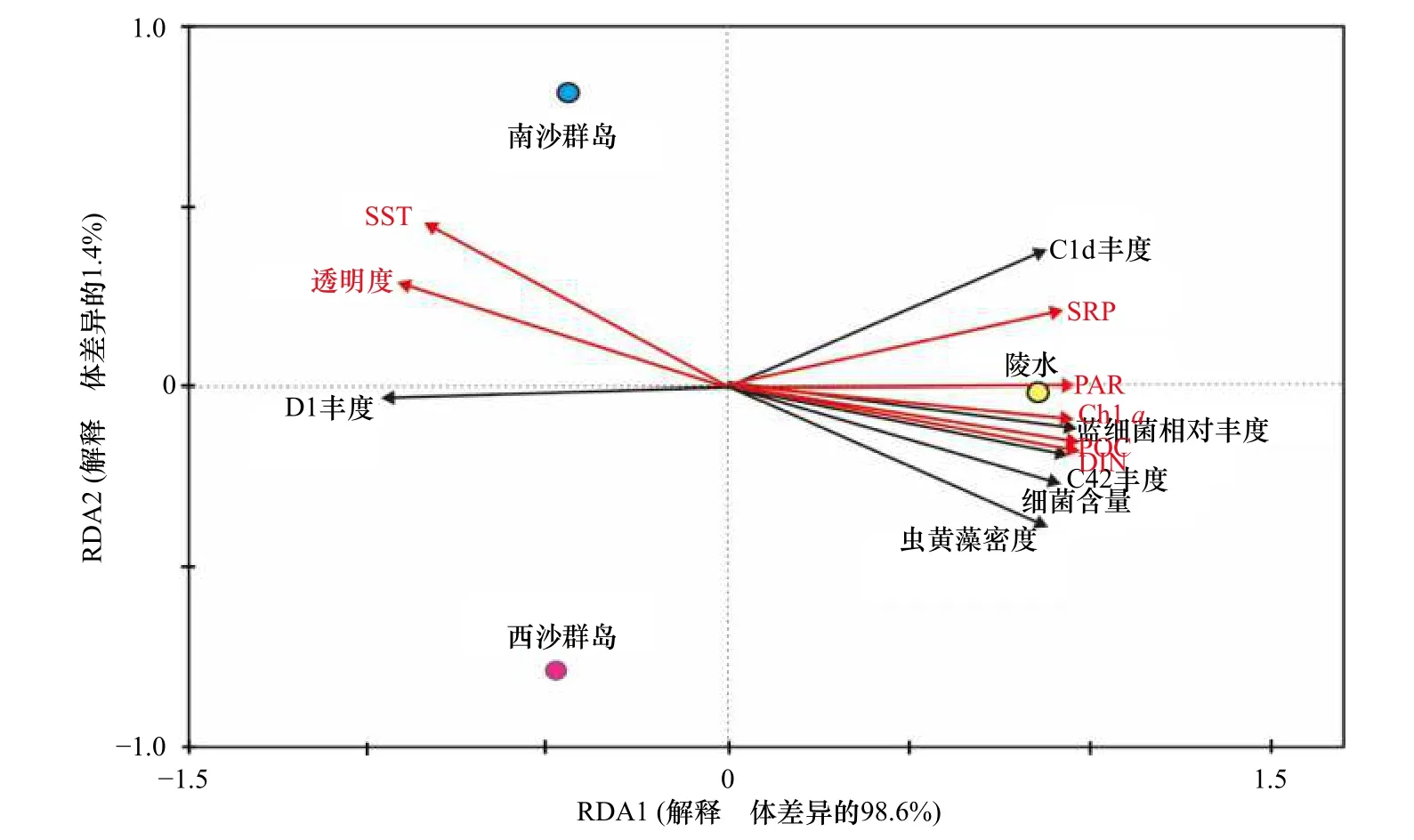
图6 环境参数、珊瑚共生微生物生态参数和采样礁区之间的相关性Fig.6 Correlations among environmental parameters,ecological parameters of microorganisms,and sampling sites
4 讨论
环境因素能改变珊瑚及其共生微生物之间的共生关系以及菌落组成[13,17,38-39]。南海珊瑚礁经过长期的自然进化和人类活动干预,已形成环境特征迥异的不同礁区,是研究珊瑚环境适应机制和演化趋势的天然实验室。营底栖固着生活的造礁珊瑚其能量需求的95%以上是由共生虫黄藻通过光合作用提供[40-41];而珊瑚共生细菌则是珊瑚共生体中数量极高的微生物有机体[8-9,42],是最为基础和活跃的组分[4-7]。因此,探究南海具有代表性的珊瑚物种关键共生微生物的生物量及其环境相关性可以更深入地了解珊瑚适应环境的微生态机制以及未来进化的趋势。
本研究从南海3 个环境变量差异显著的珊瑚礁区—南沙群岛(NS)、西沙群岛(XS)以及海南陵水(LS),采集一种环境敏感型造礁珊瑚Pocilloporasp.分析这两种关键的共生微生物类群(虫黄藻和细菌)的群落结构特征和生物量以及环境相关性。随着纬度的升高(从低纬度NS 到相对高纬度LS)珊瑚共生虫黄藻的密度显著升高,这与营养盐(SRP、DIN 和POC)和光照强度(PAR)呈显著正相关,与SST 和透明度呈显著负相关。关于珊瑚共生虫黄藻密度与纬度的变化关系基本与Ladrière 等[43]的研究结果一致。相对低纬度的海区时常处于高温环境胁迫之下,珊瑚共生虫黄藻在进行光合作用时会产生更多的活性氧物质和自由基分子,这会导致虫黄藻的损伤,并诱导珊瑚宿主排出受损的虫黄藻[44],这可能是导致低纬度珊瑚礁区珊瑚共生虫黄藻密度较低的重要原因之一。此外,不同珊瑚物种、人类活动以及珊瑚宿主的营养方式等均对珊瑚共生虫黄藻的密度有着显著的影响[30,45-46]。这表明珊瑚可以通过与特定数量虫黄藻共生以应对特殊的环境变化。另外,在相对低纬度的NS 和XS有高丰度的D 系群虫黄藻与珊瑚Pocilloporasp.共生,这对珊瑚本身适应相对高温的生存环境具有重要的意义。D 系群虫黄藻被认为具有耐热的性质[47],通常在中/低纬度的珊瑚礁区珊瑚中具有较高的相对丰度[12]。高温模拟实验也证实共生有D 系群虫黄藻的丛生盔型珊瑚(Galaxea fascularis)相比共生有C 系群虫黄藻的鹿角珊瑚(Acropora millepore)表现出更高的高温耐受性[48]。此外,本研究发现,Pocilloporasp.共生虫黄藻系群结构比较保守,在大空间尺度下的变化较小。
此外,本研究首次探究了珊瑚共生细菌16S rRNA 基因拷贝数量的生态特征,有助于准确量化珊瑚体内的细菌生物量。结果表明,珊瑚Pocilloporasp.体内有着数量非常庞大的共生细菌类群,平均每平方厘米珊瑚表面积共生细菌中16S rRNA 基因的拷贝数达到108级别。这一变化与共生虫黄藻密度的变化相一致,与SST 呈现显著负相关,与营养盐显著正相关性。这可能与高浓度营养盐会促进共生藻和细菌的生长有关[49],也进一步说明了珊瑚共生虫黄藻和细菌有着相似的环境适应机制。此外,由于细菌具有种类繁多、变异速度快、适应能力强等特性,往往被当作环境变化的标志生物。在珊瑚礁生态系统中,通过检测环境改变前后的细菌群落结构变化来了解珊瑚共生体对特定环境的适应机制[50]。珊瑚Pocilloporasp.共生细菌的第一主导类群是变形菌门,但随着纬度升高,该细菌门相对丰度显著降低。比较特别的是,具有光合作用功能的蓝细菌门相对丰度随纬度的升高而升高,从低纬度NS 和XS 珊瑚中的约1.5%升到相对高纬度LS 珊瑚的8.18%。蓝细菌富含光合色素(叶绿素、蓝藻素),是海洋生态系统的重要组成部分和初级生产力的重要贡献者,也是珊瑚礁生态系统中物质循环的关键成员[51-53]。蓝细菌可以分别通过固氮作用和光合作用为珊瑚宿主提供必须的氮和碳[54]。在本研究中,珊瑚Pocilloporasp.共生蓝细菌相对丰度随纬度的升高而升高,与珊瑚礁区水体的透明度存在显著的负相关性,这可能是珊瑚共生体光合补偿与稳定的策略。
5 结论
基于共生虫黄藻和细菌的群落组成、细胞密度以及环境因子关联性,珊瑚Pocilloporasp.对低纬度环境的适应主要是通过提高耐热型虫黄藻系群(D1)的占比;而对相对高纬度环境的适应则是通过显著提高共生微生物生物量和某些特异类群的丰度(如蓝细菌)的方式来实现。研究可以较全面地对珊瑚适应环境的微生态机制以及未来进化趋势提供新的认识。

