断根与打顶对番茄嫁接愈合的抑制作用
崔青青,孟宪敏,段韫丹,庄团结,董春娟,高丽红,尚庆茂✉
1中国农业科学院蔬菜花卉研究所/农业部园艺作物生物学与种质创制重点实验室,北京 100081;2中国农业大学园艺学院/设施蔬菜生长发育调控北京市重点实验室,北京 100193
0 引言
【研究意义】嫁接能够增强植株对生物和非生物胁迫抗性、提高产量、改善品质,普遍应用于番茄生产实践[1-2]。近年来,番茄双断根嫁接和双头嫁接因具有便于机械化操作、嫁接苗产量高、长势整齐等优势而日益广泛应用于设施番茄栽培中[3-4],虽然嫁接相关研究日渐深入[5-6],但关于断根与打顶对番茄嫁接愈合的作用机制却知之甚少。嫁接成功的重要标志是接穗和砧木维管束连通[7-8]。木质部从根部向地上组织运输和储存水分、营养物质和激素,韧皮部将光合作用的产物以及蛋白质、mRNA和生长素、细胞分裂素等激素从源组织(进行光合作用的叶片和幼芽)分配到库组织[9]。嫁接切削则阻隔了木质部和韧皮部在地上部和地下部间的物质运输,造成嫁接接合部物质积累[10]。【前人研究进展】拟南芥茎切割后1—3 d,伴随生长素的积累,基因ANAC071(Arabidopsis NAC domain containing protein 71)在切口上方表达上调;在切口下方,较低的生长素促使RAP2.6L(RELATED TO AP2.6 L)表达上调,并且RAP2.6L或ANAC071功能缺失都会干扰组织愈合[11]。进一步研究表明,生长素由ARF6和ARF8介导促进ANAC071表达而抑制 RAP2.6L表达[12]。接穗中形成的生长素可经质外体运输穿过嫁接接合部,接合部下方通过生长素受体(TIR/AFBs)和AXR1(auxin-resistant 1)对生长素做出响应,同时激活 Aux/IAA-ARF,并可能与IAA18和生长素响应蛋白ALF4(Aberrant lateral root formation 4)一起参与韧皮部的重连[13]。细胞分裂素促进形成层的分裂和增殖,并对其发育具有重要的调控作用[14]。通过细胞分裂素响应启动子 ARR5(Arabidopsis response regulator 5)和 TCS(two component signaling sensor)验证其在嫁接中的作用,发现嫁接会激活维管形成层和中柱鞘处细胞分裂素的响应,然后由嫁接接合部下方起始并随之传递至接穗[13]。有研究结果显示生长素和细胞分裂素通过相互作用来调节维管发育模式[15-17],并同时调控嫁接接合部维管束的再生,是嫁接接合部愈合的限制因素[18]。前期研究也表明生长素和细胞分裂素分别在嫁接接合部上方和下方响应,并促进番茄嫁接苗木质部和韧皮部的形成[19-20]。LU 等[18]利用试管苗离体茎段自体嫁接系统,通过向培养基中施加IAA和ZT研究其对维管组织分化的影响,结果发现外源IAA和ZT是砧穗维管束桥分化的必要条件。将葡萄砧木和接穗的切削面浸蘸于NAA(1-naphthaleneacetic acid)、IBA(Indole-3-butryic acid)、BA(Benzyladenine)、Ki(Kinetin)溶液后进行嫁接,发现Ki和BA刺激接穗和砧木之间愈伤组织的快速增殖,而NAA和IBA则促进嫁接插条基部的根形成[21]。在仙人掌微嫁接过程中外源施用IBA以观察生长素能否促进嫁接愈合,结果发现当IBA浓度为100 mg·L-1时有利于维管组织分化和嫁接愈合[22]。在拟南芥砧木根系中施用IAA促进砧穗维管束重新连接,而NPA(N-1-naphthylphthalamic acid)则起到抑制作用,并且发现PIN(PINFORMED 1)家族基因的表达会调控生长素的流动进而影响嫁接接合部的发育[23]。将山核桃接穗和砧木浸蘸 IAA和NPA溶液,发现接穗和砧木外源施用生长素提高了山核桃的嫁接成功率,而生长素抑制剂NPA则会抑制嫁接愈合[24]。【本研究切入点】幼嫩的芽、叶及发育中的种子是生长素合成的主要部位。细胞分裂素合成的主要部位是根尖,普遍存在于旺盛生长的、正在进行分裂的组织或器官。双断根嫁接中断根以及双头嫁接中打顶可能会影响嫁接接合部积累的生长素和细胞分裂素含量进而影响嫁接愈合进程。【拟解决的关键问题】本试验以番茄为材料,研究接穗断根和打顶对嫁接愈合进程的影响,进而探索生长素和细胞分裂素对番茄嫁接愈合的调控,以期为番茄嫁接生产提供理论依据。
1 材料与方法
试验于 2020—2021年在中国农业科学院蔬菜花卉研究所玻璃温室内进行。
1.1 试验材料
番茄接穗品种‘硬粉8号’,砧木品种‘砧爱1号’。挑选适量、饱满度均一的番茄种子,室温下浸种6 h,5% NaClO水溶液种子表面消毒15 min,冲淋4—5遍,28/23℃催芽3 d。选取出芽整齐一致的种子,播于填装有混合基质(草炭∶蛭石∶珍珠岩=3∶1∶1(v/v))的72孔穴盘,播种深度1.5 cm,覆盖蛭石,每盘灌水约 0.7 L,放置在玻璃温室自然温光环境培养。幼苗子叶平展时,灌溉1/2 Hoagland营养液,第一片真叶展开后灌溉Hoagland全营养液,灌溉方式为底部灌溉。
1.2 试验设计
4种嫁接处理:(1)接穗与砧木正常嫁接(对照);(2)嫁接时接穗打顶,砧木正常;(3)嫁接时接穗正常,砧木断根;(4)嫁接时接穗打顶且砧木断根。
待幼苗长至上胚轴直径2.0 mm左右时,采用套管嫁接方式进行嫁接,嫁接前剔除幼苗中带病幼苗及弱苗,将生长健壮、株高一致的幼苗集中在一起,并在嫁接前1 d浇足水(每穴盘1 L)。嫁接时在番茄幼苗上胚轴部位以45°角切割,然后将接穗与砧木在切口处相互贴合,并用套管固定,对于断根和打顶处理在用套管固定后马上进行砧木断根或接穗打顶操作。
为了证实生长素和细胞分裂素对嫁接愈合的影响,在打顶和断根的基础上外源施加一定浓度的IAA和6-BA。打顶后在嫁接切口上下表面分别涂抹1 μL的10和100 mmol·L-1IAA,以及在叶面喷施10 mmol·L-1IAA;断根后嫁接切口上下表面分别涂抹1 μL 1和10 mmol·L-16-BA,以及将下胚轴于 0.1 mmol·L-16-BA 中浸蘸30 min。
嫁接后立即将幼苗移入人工气候箱,昼温26℃(10 h),夜温20℃(14 h)。嫁接后光照强度为80 μmol·m-2·s-1,空气相对湿度第 1—3 天保持 90%,第 4、5、6和7天空气相对湿度分别为80%、75%、70%、65%。
1.3 测定指标及方法
1.3.1 愈合进程的组织切片观察 嫁接后 144 h取样,取嫁接苗接合处5 mm长茎段,进行FAA固定液(福尔马林、70%乙醇、冰醋酸混合液)固定,梯度乙醇脱水,乙醇和二甲苯混合液透明,石蜡包埋,切片厚度10 μm,5%明胶粘片,脱蜡、复水、番红-固绿染色、阿拉伯树胶封片,显微镜(奥林巴斯 BX53)观测并拍照。每处理3次生物学重复。
1.3.2 成活率及萎蔫率测定 嫁接14 d后统计成活率,成活率=(嫁接成活的株数/嫁接总株数)×100%。嫁接后6、7和8 d统计嫁接苗置于60%湿度下12 h的萎蔫情况,萎蔫率=(萎蔫的株数/嫁接总株数)×100%。
1.3.3 品红法测定木质部连通性 嫁接后72 h取样,在嫁接接合部下方3 cm处茎基部横切断后插入1%品红溶液,吸收40 min后(光照100%,湿度60%,温度28℃),在嫁接接合部对茎进行纵切,并在嫁接接合部上方 2 cm对茎进行横切,于体式镜(奥林巴斯BX53)下观察染色情况。
参照赵渊渊等[25]的方法并做相应修改。嫁接后120 h,取同一处理幼苗,用刀片横切茎基部,垂直放置于盛有10 mL 1%酸性品红水溶液的50 mL烧杯内,4 h后剪取嫁接接合部上方幼苗并称重,放入研钵加入5 mL蒸馏水研磨成匀浆,12 000 r/min离心6 min,取上清液再次离心 3 min,使用分光光度计测定二次离心后的上清液吸光度值A545,并在标准曲线上读取品红含量。
品红含量(mg·g-1)=C×V/W
式中,C:标准曲线上读取的品红含量(mg),V:研磨所用蒸馏水体积(mL),W:所取样品质量(g)。
1.3.4 激素含量测定 嫁接后12和72 h取切口处1 cm(切口上、下各5 mm)茎段用于生长素和细胞分裂素含量测定。测定方法为液相色谱串联质谱(LC-MS/MS)。标准品(BioBioPha/Sigma-Aldrich)用乙腈(Merck)或甲醇(Merck)作为溶剂溶解后,-20℃保存,质谱分析前用乙腈稀释成不同梯度浓度。所用试剂都为色谱纯。
激素定量是利用三重四极杆质谱的多反应监测模式(multiple reaction monitoring,MRM)分析完成。利用软件Analyst 1.6.1处理质谱数据。每个色谱峰的峰面积(peak area)代表对应激素的相对含量。将检测到的所有样本激素的积分峰面积比值带入标准曲线线性方程进行计算,进一步代入计算公式计算后,最 终得到实际样本中激素的绝对含量数据。
样本中激素的含量(ng·g-1)=B×C/1000/D
式中,B:样本中激素积分峰面积比值代入标准曲线得到的浓度值(ng·mL-1),C:复溶时所用溶液的体积(μL),D:称取的样本质量(g)。
1.3.5 RNA提取与Real-time PCR分析 对于处理植株,在嫁接后1、3、12、24、48和72 h,采集嫁接接合部即切口处上方(接穗)和下方(砧木)5 mm 茎段。采用 RNAprep pure Plant Kit(天根,北京)提取茎段总 RNA。使用 TransScript All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(全式金,中国)合成第一链 cDNA。Real-time PCR使用试剂盒TransStart Top Green qPCR SuperMix(全式金),仪器为LightCycler® 96实时荧光定量PCR仪(Roche,瑞典)。
1.4 数据分析
试验结果采用 3次生物学重复的平均值±标准误表示。利用软件 SAS 9.1.3(SAS Inc.,Cary,NC)的ANOVA程序进行方差分析,运用最小显著差异法进行差异显著性比较分析(P<0.05)。

表1 Real-time PCR所用引物Table 1 Primer sequences for the Real-time PCR
2 结果
2.1 嫁接愈合进程
如图1所示,在嫁接后14 d,去除顶梢(P和PC)后,第一叶和第二叶腋芽处均产生新的生长点,但断根使PC处理腋芽长势相对较慢。同时,嫁接后14 d,断根的两处理(C和PC)在下胚轴基部均已形成较多不定根。对嫁接后幼苗干、鲜重测定发现,打顶和断根使地上部干、鲜重在嫁接后7和14 d显著降低,在嫁接后14 d断根处理的根系干、鲜重与对照已无显著差异,但打顶断根处理的根系干、鲜重仍显著低于对照(图2)。如表2所示,各嫁接处理间成活率无显著差异,但从幼苗萎蔫情况来看断根后嫁接苗愈合较慢,基本在嫁接后8 d愈合;而打顶和对照在嫁接后6 d萎蔫率就较低,即在嫁接后6—7 d愈合。通过石蜡切片观察嫁接 144 h接合部的愈合情况,发现对照(CK)砧穗间粘连紧密,而打顶和断根处理的砧穗之间存在一定的间隙,并且接合部的木质部导管没有完全连通(图3)。图4也表明,嫁接后72和120 h打顶和断根抑制了品红由砧木到接穗运输,即抑制了木质部的连通性,但处理C与PC之间差异不显著。上述结果表明,番茄嫁接时打顶和断根均不利于番茄嫁接愈合。

表2 断根和打顶对番茄嫁接苗成活率和萎蔫率的影响Table 2 Effects of root-cutting and top-pinching on survival rate and wilting rate of tomato grafting seedlings

图1 断根和打顶后嫁接苗形态观察Fig.1 Morphological observation of grafting seedlings after root-cutting and top-pinching
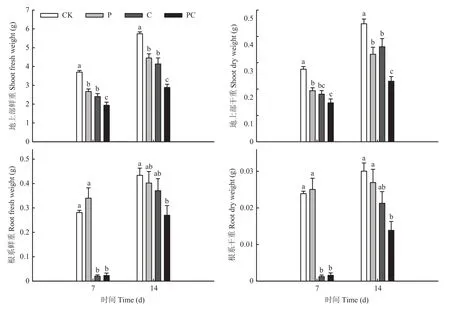
图2 断根和打顶对番茄嫁接苗干、鲜重的影响Fig.2 Effects of root-cutting and top-pinching on dry and fresh weight of tomato grafting seedlings
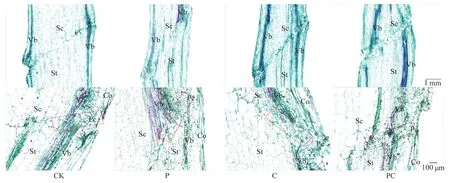
图3 断根和打顶后番茄嫁接愈合进程Fig.3 Healing process of tomato grafting after root-cutting and top-pinching
在打顶和断根的基础上外源施加一定浓度的IAA和6-BA,均能在一定程度上促进嫁接愈合。如图4-B所示,打顶后在嫁接接合部涂抹 10 mmol·L-1IAA 显著提高了嫁接苗木质部输导能力,断根后在嫁接接合部涂抹 10 mmol·L-16-BA 同样显著提高了嫁接苗木质部输导能力。这些结果进一步证实了生长素和细胞分裂素在嫁接愈合中的作用。
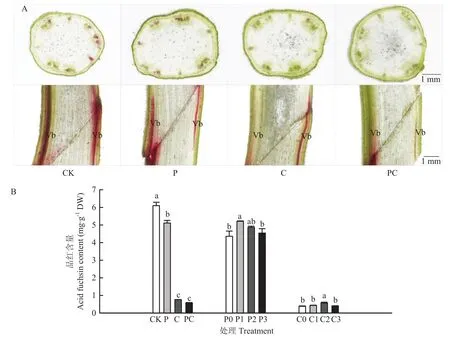
图4 外源施用IAA、6-BA对番茄断根和打顶嫁接后木质部重构的改善作用Fig.4 Improved effects of exogenous application of IAA and 6-BA on xylem remodeling in tomato grafting after root-cutting and top-pinching
2.2 嫁接接合部生长素和细胞分裂素含量
断根和打顶均会影响嫁接接合部生长素和细胞分裂素含量变化。由图5所示,在嫁接后12 h,断根显著降低了嫁接接合部吲哚-3-乙酸(IAA)、吲哚-3-乙酸甲酯(ME-IAA)和吲哚-3-甲醛(ICAld)含量;打顶使嫁接接合部IAA和ME-IAA含量显著低于对照和断根处理;断根打顶同样使嫁接接合部 IAA和ME-IAA含量显著低于断根处理,但与打顶处理差异不显著。这说明断根和打顶均会减少嫁接接合部生长素的积累,但相比于断根,打顶的影响效果更显著。随着嫁接愈合,在嫁接后 72 h,PC处理的 ME-IAA含量显著低于对照,各处理IAA和ICAld含量则与对照差异不显著。不同的是,在嫁接后12 h,打顶或断根并没有引起L-色氨酸(TRP)含量显著变化,但C和PC处理显著提高了TRP在嫁接后72 h的含量,说明断根使嫁接后72 h接合部的生长素合成增多。

图5 断根和打顶后嫁接接合部生长素含量的变化Fig.5 Changes of auxin content in graft union after root-cutting and top-pinching
断根和打顶对嫁接接合部细胞分裂素的影响不同于生长素。由图6所示,嫁接后12 h,打顶没有引起嫁接接合部细胞分裂素含量显著变化,但断根以及同时断根和打顶都显著降低了玉米素核苷(tZR)、反 式玉米素(tZ)和异戊烯腺嘌呤核苷(IPR)的含量。各处理反式-玉米素-9-Β-葡萄糖苷(tZOG)含量与对照相比在嫁接后12 h无显著差异。嫁接后72 h,打顶提高了tZR、tZ、双氢玉米素-7-糖苷(DHZ7G)、IPR、tZOG的含量;但断根以及同时断根和打顶都使tZR、tZ、DHZ7G和tZOG含量显著降低。以上结果表明,断根会降低嫁接接合部细胞分裂素含量,而打顶不会引起嫁接接合部细胞分裂素含量降低。
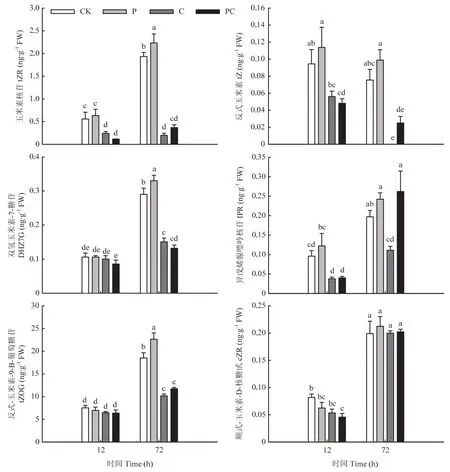
图6 断根和打顶后嫁接接合部细胞分裂素含量的变化Fig.6 Changes of cytokinin content in graft union after root-cutting and top-pinching
随着嫁接愈合,生长素响应基因SlIAA1表达量呈降低趋势,生长素运输基因SlPIN1表达量随嫁接愈合先升高后降低,两者在嫁接接合部上方表达量均高于下方(图7)。从嫁接后3 h开始,打顶使嫁接接合部上方SlIAA1和SlPIN1表达量显著降低,嫁接接合部下方变化与上方基本一致。C和PC处理嫁接接合部上方SlIAA1和SlPIN1表达量从嫁接后1 h开始显著低于对照,但C处理的两基因表达量在嫁接后12 h显著高于对照。随着嫁接愈合,在接合部上方各处理细胞分裂素响应基因SlHP1表达量逐渐升高,但断根使其表达量升高较慢;在嫁接后12、24和48 h,断根与打顶断根处理显著降低了接合部上方细胞分裂素响应基因SlHP1的表达量;断根或打顶嫁接后3 h显著下调了接合部下方SlHP1的表达量。无论在嫁接接合部上方还是下方,断根显著下调了细胞分裂素响应基因SlRR8的表达,而打顶却使嫁接后12—72 h SlRR8表达量显著上调。上述结果进一步证实打顶和断根会影响嫁接接合部生长素和细胞分裂素的积累,进而影响相关基因的表达。
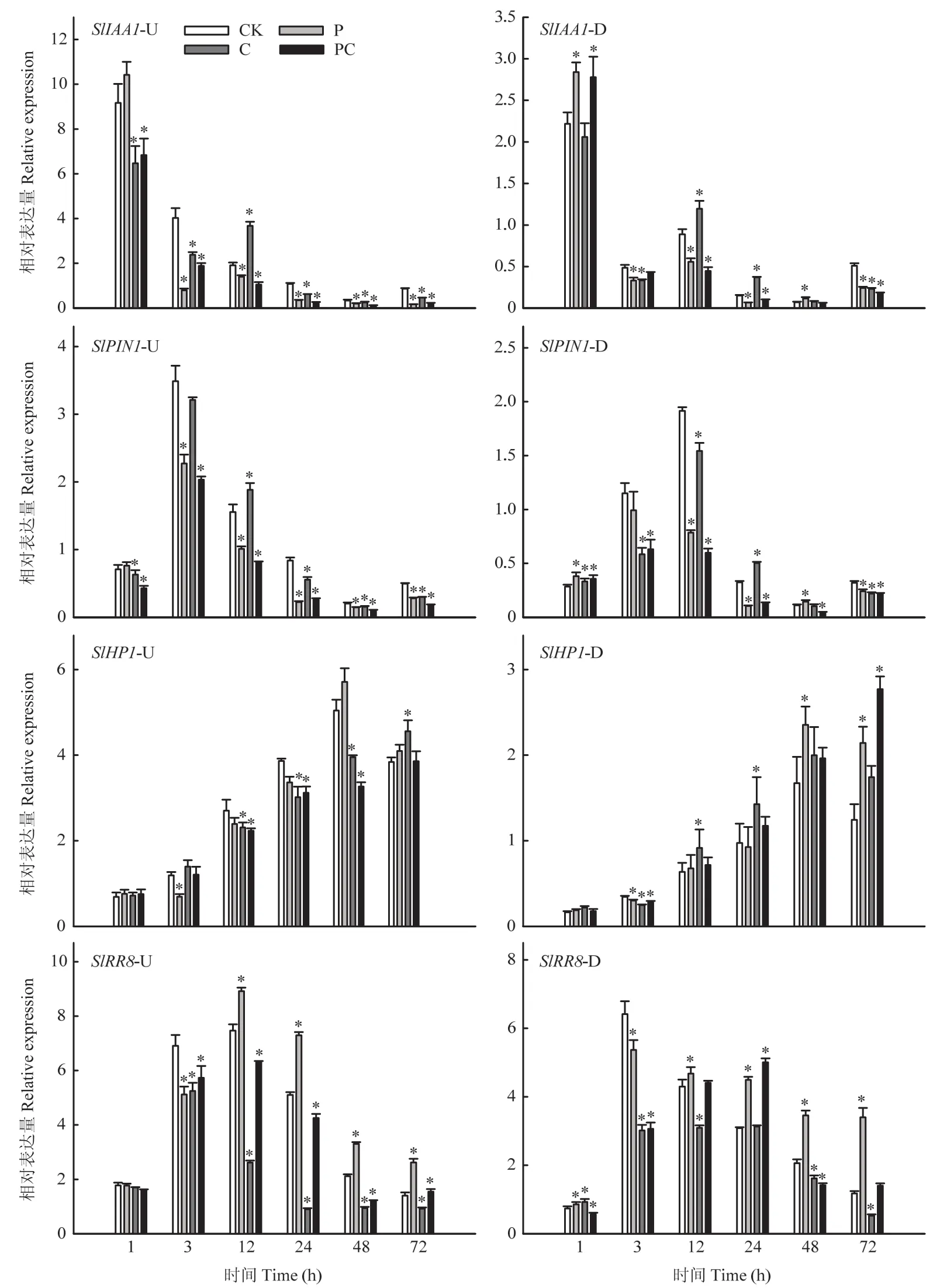
图7 断根和打顶后嫁接接合部生长素和细胞分裂素应答基因的表达Fig.7 Expression of auxin and cytokinin response genes in graft union after root-cutting and top-pinching
2.3 愈合相关基因表达
Histone H4和SlcycB1-4为细胞分裂相关基因,如图8所示,嫁接后3—48 h,打顶或断根均使嫁接接 合部上方两者的相对表达量降低。在嫁接接合部下方,断根显著降低了嫁接后1和3 h两基因的表达水平,打顶也降低了嫁接后3和12 h的两基因表达量,而从嫁接后12 h断根处理的两基因表达量均高于对照。在嫁接接合部上方,嫁接后3 h,打顶或断根使形成层细胞增殖基因PXY的表达水平显著提高,但嫁接后12、24和72 h断根显著降低了PXY的表达水平,去除接穗生长点,则显著降低了PXY在嫁接后24和48 h的表达水平,断根打顶处理PXY表达水平在嫁接后24、48和72 h显著下调。在嫁接接合部下方,打顶显著降低了PXY在嫁接后3、12和24 h的相对表达量,同时断根和打顶则使嫁接后12、24和48 h的PXY相对表达量显著降低,断根处理则与对照基本无显著差异。木质部分化相关基因VND7在嫁接接合部上方和下方趋势一致,表达水平均随嫁接愈合先升高后降低。从嫁接后 1 h开始,打顶显著降低了嫁接接合部上方VND7的相对表达量,断根及同时断根和打顶则使其表达水平在嫁接后12和24 h显著降低,而在嫁接后48 h显著升高。在嫁接接合部下方,打顶或断根使嫁接后3和12 h的表达水平显著低于对照。对于韧皮部分化相关基因NEN4,无论在嫁接接合部上方或下方,嫁接后3和12 h打顶均降低了其表达水平,而到嫁接后48和72 h断根则使其表达水平显著升高。以上结果表明打顶和断根会不同程度的使嫁接初期愈合相关基因表达下调,进而影响嫁接接合部形成层的形成和细胞分裂,以及木质部、韧皮部分化。
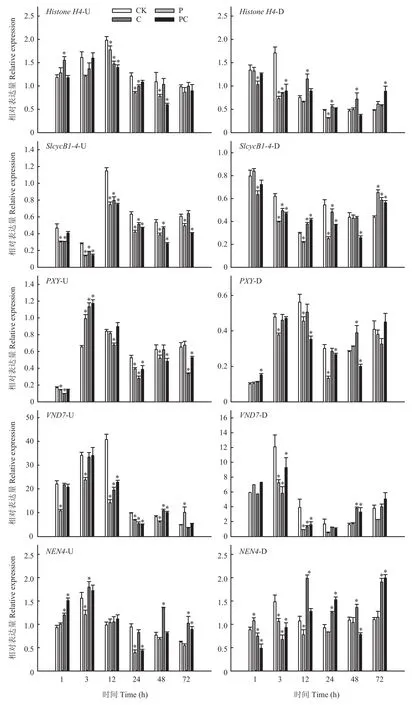
图8 断根和打顶后嫁接愈合相关基因的表达Fig.8 Expression of genes related to grafting healing after root-cutting and top-pinching
3 讨论
本研究发现,接穗顶梢和砧木根系在番茄嫁接愈合中起着重要作用,断根和打顶均不利于番茄嫁接愈合。但由于打顶双干或多干嫁接苗接穗会长成两条或多条主干,同时番茄双断根嫁接可促进根系发育、提高壮苗指数和再生根根系活力[26],显著提高产量[27],因此,断根嫁接苗和打顶双干嫁接苗日益广泛地用于番茄栽培。
3.1 断根和打顶对嫁接接合部生长素的影响
IAA是多数植物中生长素存在的主要形式。嫁接后12 h,打顶使嫁接接合部IAA和ME-IAA含量显著低于对照和断根处理,但TRP含量在各处理间差异不显著。通常IAA由TRP经过两步反应生成[28]。打顶以及同时断根和打顶都使嫁接接合部IAA和ME-IAA含量显著低于对照和断根处理,这说明打顶使运输到嫁接接合部的生长素减少,从而使嫁接接合部积累的生长素含量显著降低,而不是由于嫁接接合部生长素合成减少引起。嫁接后72 h,断根以及同时打顶和断根处理显著提高了TRP含量,这可能是因为断根与打顶断根处理愈合较慢,嫁接后期需要合成较多生长素。与对生长素含量的影响相一致,从嫁接后3 h,打顶使嫁接接合部上方SlIAA1和SlPIN1表达量显著降低,且打顶造成的降低程度明显高于断根,说明打顶对嫁接接合部生长素响应及运输的影响大于断根。同时打顶后生长素含量显著低于断根,这也说明嫁接接合部生长素含量降低受打顶影响更大。由于嫁接切削阻断了生长素运输,嫁接接合部下方生长素逐渐消耗而减少,因此,嫁接接合部上方SlIAA1和SlPIN1表达量均高于下方。拟南芥嫁接后,生长素响应基因 IAA1在嫁接接合部上方表达水平高于下方,嫁接后24 h,接合部上方和下方的表达水平相近;随嫁接愈合,PIN1在嫁接接合部上方的表达水平也高于下方[29],这与本研究结果一致。
3.2 断根和打顶对嫁接接合部细胞分裂素的影响
嫁接后12 h,嫁接接合部tZ、tZR和IPR的含量在断根以及同时打顶和断根后显著降低,但打顶没有引起嫁接接合部细胞分裂素含量显著变化。嫁接后72 h,断根以及同时打顶和断根都使 tZR、tZ、DHZ7G和tZOG含量显著降低。细胞分裂素合成的主要部位是根尖,因此相对于打顶,断根对嫁接接合部细胞分裂素含量影响较大。iP(异戊烯基腺嘌呤)、tZ、cZ和DZ(二氢玉米素)4种类异戊二烯细胞分裂素中的iP和tZ相对活跃,其衍生物种类在植物中最丰富,而且对细胞分裂素氧化酶/脱氢酶敏感[30]。各处理tZOG、DHZ7G和cZR含量与对照相比在嫁接后12 h无显著差异,可能与这几种细胞分裂素活性较弱有关。与细胞分裂素的变化一致,断根下调了细胞分裂素响应基因 SlHP1和 SlRR8的表达水平。但打顶却使嫁接后12—72 h的SlRR8表达量显著上调,这与打顶上调了嫁接后12和72 h接合部tZR、tZ和IPR的含量一致,推测是由于高浓度生长素促进细胞分裂素信号转导抑制因子AHP6的转录[15],而打顶使嫁接接合部生长素含量降低,因此打顶后反而促进细胞分裂素的响应。生长素在嫁接后72 h基本无差异,但细胞分裂素还有差异,这可能是因为打顶后,还保留两片真叶,并且腋芽开始萌发成为新的生长点并开始产生生长素。
3.3 断根和打顶对嫁接愈合的影响
研究发现,木质部形成标志基因VND7和BFN1在拟南芥嫁接早期接合部上方被激活[29],本研究也发现VND7表达水平随着嫁接愈合先升高后降低,且嫁接接合部上方表达量高于下方。本研究中,打顶和断根显著降低了VND7、Histone H4和SlcycB1的表达水平,也在一定程度上降低了NEN4和PXY的表达量。说明打顶和断根引起嫁接愈合基因表达下调进而影响嫁接愈合。前人研究表明生长素可以通过RAP2.6L和ANAC071调控组织愈合[11]。嫁接会激活维管形成层和中柱鞘处细胞分裂素的响应[13],细胞分裂素促进形成层的分裂和增殖,并对其发育具有重要的调控作用[14]。这进一步表明打顶和断根对嫁接愈合的影响与嫁接接合部生长素及细胞分裂素的积累量减少密不可分。
本研究中断根和打顶抑制了木质部重构,延缓了番茄嫁接愈合进程;但断根和打顶后分别在嫁接接合部施用 10 mmol·L-16-BA 和 10 mmol·L-1IAA均显著提高了嫁接苗木质部输导能力。以往的研究也发现砧木和接穗的切削面浸蘸Ki和BA可以刺激接穗和砧木之间愈伤组织的快速增殖,而NAA和IBA则促进嫁接插条基部的根形成[21]。拟南芥[23]和山核桃[24]嫁接时外源施用 IAA促进了砧穗维管束的重新连接,提高嫁接成功率。笔者课题组之前外源施加一定浓度的IAA和6-BA促进了番茄嫁接愈合过程中木质部和韧皮部重连[19]。因此,生产番茄断根嫁接苗和打顶双干或多干嫁接苗时施用外源激素可在一定程度上促进嫁接愈合。
4 结论
断根和打顶抑制番茄嫁接愈合。断根降低了嫁接接合部细胞分裂素和生长素的含量,打顶则主要降低了嫁接接合部生长素含量;二者下调了细胞分裂相关基因、维管束分化相关基因的表达,抑制了愈伤组织形成和木质部重构。外源施用生长素或细胞分裂素可促进断根和打顶后嫁接接合部木质部重构。

