某院139例药品不良反应发生的相关性因素分析
朱永红 张延华




摘要:目的:分析某院近几年药品不良反应(ADR)发生的相关因素,为临床安全用药提供警戒。方法: 以2012-2021年上报军队ADR监测中心的139例药品不良反应(ADR)报告为研究对象,采用回顾性分析方法,对ADR发生的相关因素进行分析。结果:139例ADR报告中,一般ADR居多(105例,75.54%);男性患者(83例,59.72%)略高于女性患者(56例,40.28%);0-18岁患者ADR发生率最高(43例,30.94%);发生ADR最多的药品为注射剂型(127,91.36%);静脉滴注是发生ADR的主要给药途径(115例,82.73%);药物类别中,抗菌药物不良反应发生率最高(89例,64.02%),ADR主要累及系统器官为皮肤及其附件(94例,59.87%)。结论: ADR的发生与多种因素相关,医务人员应重视ADR上报,医院质控人员及临床药师应加强ADR数据分析及预警,采取有效措施降低ADR发生风险。
关键词:药品不良反应;相关性分析;警戒
【中图分类号】R97 【文献标识码】A 【文章编号】1673-9026(2022)02-02
药品不良反应(adverse drug reaction,ADR)是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1]。据相关资料[2]显示,我国约有250万人因药物不良反应住院,死亡约19万人,ADR发生率约占住院病人的10%-30%,药源性疾病发生率呈逐渐增高的趋势。随着新药开发、药品种类增多,ADR报告监测分析得到临床药学领域的广泛重视[3]。为促进广大医务工作人员合理用药,降低ADR发生风险,现对医院近10年来上报军队ADR监测中心的ADR报告进行统计分析,探讨其发生的相关性因素,为临床安全用药提供警戒。
1资料与方法
1.1 一般资料 收集2012-2021年医院上报至军队药品不良反应监测中心的139例ADR报告,运用SPSS19.0软件对患者性别、年龄、ADR分布及类型、药物类别、给药途径、ADR累及系统/器官、ADR治疗转归等进行统计分析。
1.2 药品不良反应分类标准 根据军队《药品不良反应报告和监测管理办法》,将药品不良反应分为一般ADR、严重ADR、新的ADR等。本文据此对收集到的药品ADR进行分类。
2.結果
2.1 患者性别和年龄分布情况 139例ADR报告中,男性83例(59.71%),女性56例(40.28%)。男性ADR发生率高于女性(男∶女=1.48:1)。0-18岁患者ADR发生率最高(30.94%),其次>60岁患者30(21.58%),见表1。
2.2ADR分布及类型 139例ADR报告中,一般ADR占比75.53%,严重ADR占比 6.47%,新的ADR占比18.69%,见表2。
2.3发生ADR的药品类别及品种分布 139例ADR中生物制剂(7.19%)、中药注射剂21例(15.11%)、抗感染药物89例(64.02%),居于首位,结果见表3;涉及7类14种药物,头孢菌素类、氟喹诺酮类、β-内酰胺类抗生素ADR发生率在前三位,结果见表4。药品类别参考《新编药物学》(18版)药物分类以及药物成份来源进行分类。
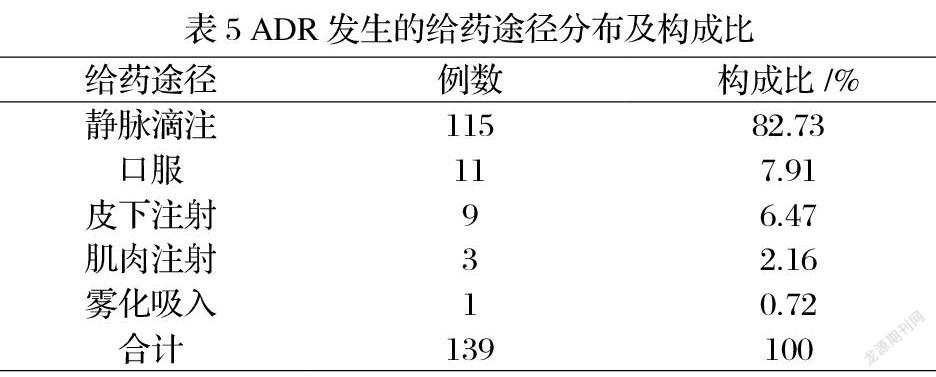
2.4 ADR发生的给药途径 139例ADR报告中,主要涉及5种给药途径,以注射给药为主(115例,82.73%),其中静脉滴注最多,其他给药方式中,口服给药较多11例(7.91%),见表5。
2.5ADR累及系统/器官分布及主要临床表现139份ADR报告中,因部分ADR累及多个系统/器官,故统计总例次>139例,为157例,ADR主要累及皮肤及其附件损害94例次(59.87%),其次为心血管系统18例次(11.46%),见表6。
2.7 转归情况 发生ADR后经过关联性分析,临床医师通过停用疑似药、对症治疗等系列措施,在139例ADR中,最终痊愈119例(85.61%),好转16例(11.51%),未好转2例(1.43%),不详2例(1.43%)。
3 讨论
3.1 ADR发生与年龄、性别的相关性
本研究样本中,男性高于女性,考虑与医院患者来源多为男性相关。ADR年龄分布结果显示0-18岁患者群体ADR发生率最高为30.94%,其次>60岁患者为21.58%,分析原因为儿童由于各器官正处于发育期,生理功能未完全发育成熟,易造成ADR[4];<18岁青少年可能因生活节奏快,学习压力大,长期处于紧张状态,缺乏锻炼,导致身体亚健康,抵抗力低下有关[4]。而>60岁患者更是用药监测的特殊人群,该人群随着年龄增加,机体生理功能减退,进而导致药物在体内的吸收、分布、代谢、排泄等过程发生变化;此外,这些患者常伴有多种基础疾病,联合用药种类多,容易发生药物间相互作用,从而增加ADR发生概率。因此,应特别关注这类特殊人群,根据患者年龄和体质差异,调整用药剂量和途径,儿童应严格说明书用药,高龄患者在治疗用药过程中应充分考虑患者病理生理改变、基础疾病及合并症、药物相互作用等,制定个体化给药方案,并加强用药监护,减少及避免ADR发生。
3.2 ADR发生与给药途径的相关性 本研究样本中115例患者是静脉给药发生ADR,这与多数不良反应报告分析结果一致[3-5],与口服给药相比,静脉给药由于药物直接进入血液循环,注射剂药物的特性(如pH、不溶性微粒及渗透压等)可导致ADR发生的增加[6]。因此在临床治疗中,同种疗效下应按口服、肌注、静注次序选择给药途径[7],减少静脉给药次数。《抗菌药物临床应用指导原则》2015版指出:因病情需要必须选择静脉给药,应注意药物的配置浓度、保存条件、滴注浓度,如氟喹诺酮类的左氧氟沙星(0.5g/100ml)根据用量不低于60min或90min的时间缓慢滴注,莫西沙星(0.4g)推荐输液时间是90分钟,最大限度降低因输液导致的ADR发生风险。
3.2 ADR发生与药品类别的相关性 本研究样本显示头孢菌素类、β-内酰胺酶抑制剂、喹诺酮类抗菌药物是导致不良反应的主要品种,可能与此三类抗生素品种多样、应用范围广有很大关系,此結果与2016年国家药品不良反应监测年度报告显示的结果一致[8]:抗感染药不良反应/事件的报告数量占比最高;按药品类别,头孢菌素类排名第一;按品种排名,左氧氟沙星位居首位,头孢曲松排名第三,严重不良反应/事件报告中,头孢菌素类仍排名第一,品种排名中头孢曲松居第二。24例头孢曲松ADR报告显示:用药后30 min内发生ADR患者最多,其次是用药1 d后、用药后1 h-1 d 内。提示医护人员应密切观察用药后 30 min内患者临床反应;国家药品不良反应监测中心曾特别提示大量的ADR严重病例是由于头孢曲松钠和其他药物混合应用导致,说明书明确提示,其配伍禁忌药物较多,使用时应单独给药,同时两组液体需间隔应用,还需注意更换输液器或冲管,避免出现配伍禁忌情况[9];15例左氧氟沙星ADR报告显示:存在临床实际使用中未注明滴速,剂量0.5g-0.75g的较大用药,说明书要求每瓶滴注不少于60min,也有使用0.75g以及1g导致肝功能受损的报道[10],提示控制滴速和剂量是减少不良反应发生的重要措施[11]。国家药监局发布修订全身用氟喹诺酮类药品说明书公告(2021年第44号),要求在选择使用此类药物时应进行充分的获益/风险分析,特别提示应避免给有主动脉瘤或有主动脉瘤风险的患者使用氟喹诺酮类药物;17例哌拉西林钠舒巴坦钠ADR报告中,过敏性反应居多,与患者过敏体质、用药疗程、联合用药相关,由于该品种在生产过程中易产生高分子聚合物,进入机体后与蛋白质结合转换为抗原,导致速发型变态反应,严重者可引起过敏性休克[12],疗程≥7d可能是其发生药物热的重要影响因素,考虑为药物蓄积导致体内药物与体内载体物质形成的“抗原—抗体”复合物浓度增加,激发机体免疫系统,导致发热[13]。重症患者多存在联合用药情况,从而导致ADR风险增高。因此,用药前仔细询问过敏史;对于老年和肾功能不全患者,使用时须调整用量,尽量避免联合用药,避免长疗程使用;中成药注射剂ADR报告涉及多个品种,此类药物成分复杂,制备过程中易受药材质量、生产工艺及质检标准等影响,制剂中夹杂的大分子物质进人体后相当于抗原或半抗原,引起过敏反应。因此,用药前仔细询问过敏史;按药品说明书推荐剂量、调配要求、给药速度和疗程使用药品,不超剂量、过快滴注和长期连续用药;严禁混合配伍,谨慎联合用药;加强用药监护,尤其对特殊人群和初次使用患者应加强监测。
3.4 ADR发生累及系统/器官的相关性 本研究样本中,因皮肤及其附件损害易观察、判断,并做出关联性评价,因此比例最高,占比59.87%;对于那些无症状、症状不明显、或需通过实验室检查发现的ADR,如血液系统损害、肝肾功能损害等,因不易察觉而易被忽略,139例ADR报告中多例使用头孢曲松、左氧氟沙星导致肝功能异常,因此,应密切监测患者用药后反应,并加强关注实验室检查结果[14],除了掌握常用药物ADR发生特点外,还应在发现疑似ADR后立即采取相应救治措施,停用可疑药品,并对症治疗,以期患者转归良好。
总之,ADR的发生与诸多因素有关,需医、药、护团队共同协作,一方面医院应加强药品ADR相关培训,提高医务工作者的药品不良反应上报意识,可疑必报,及时上报,分析总结可能引起ADR的具体原因和风险因素,另一方面医护人员应做到用药前有预防,用药时有监护,用药后有观察、追踪,尽可能在第一时间发现ADR并做出干预,以促进临床安全合理用药,降低ADR发生的风险,确保患者用药安全。
参考文献:
[1] 国家食品药品监督管理局,中华人民共和国卫生部.药品不良反应报告和监测管理办法[S].2011.
[2] 中华人民共和国国家食品药品监督管理总局.国家药品不良反应监测年度报告(2016 年)[EB/OL].http://www.sda.gov.cn/WS01/ CL0844/172167.html.2017-04-28
[3] 荀国方.我院2014-2016年的药物不良反应报告分析 [J].临床合理用药,2018,11(2A):120-121.
[4] 黄晓丹.我院314例药物不良反应分析[J].中国药物滥用防治杂志,2018,24(6):343-345
[5] 黄婷.我市2015-2017年601例儿童不良反应报告分析[J]中国药物应用于监测,2018,15(6):348-351.
[6] 梁花.探讨临床药师在药品不良反应监测中发挥的作用[J].世界最新医学信息文摘,2019,19(1):183,194.
[7] 郭薇,史石崇智.我院药物不良反应199例报告分析[J].实用医技杂志,2018,25(12):1423-1425.
[8] 国家食品药品监督管理总局国家药品不良反应监测年度报告(2016年)[J].中国药物评价,2017,34(3):234-240
[9] 刘丽凤. 头孢曲松钠不良反应的临床分析[J].中国现代药物应用,2018,12(22):124-126.
[10] 管玫,金朝辉,杨娟 .282 例左氧氟沙星不良反应报告分析[J].中国药物警戒,2007,4(3):158-161
[11] 尹航,谢程.111例氟喹诺酮类药品不良反应/事件临床分析[J].中国药物应用与监测,2017,14(3):163-182
[12] 郗玉玲,平贯芳,卢乙众.注射用哌拉西林钠/舒巴坦钠不良反应影响因素Logistic回归分析[J].河南科技大学学报(医学版) 2019,6(37):143-145
[13] 黄倩倩,李明.注射用阿洛西林钠皮试阴性患者发生过敏性 休克 1 例[J].药学与临研究,2017,25(1):77-78.
[14] 傅瑞春,黄炳川,洪佳妮,等.878例药品不良反应报告[J].医院用药评价与分析,2019,19(1):102-105.

