PTEN/mTOR通路在高糖诱导的人绒毛膜滋养层细胞HTR-8/SVneo凋亡中的作用机制探讨
彭青,温彦静,李茜,李曼,常美英
糖尿病是一种以高血糖为特征的代谢综合征,作为妊娠期常见并发症,其临床发病率较高,占妊娠妇女的2%~8%,且在我国呈逐年上升趋势,如果未得到及时诊断及治疗则发生流产、胎儿畸形、并发子痫前期等不良妊娠结局的风险明显增加[1]。体外实验证实,人绒毛膜滋养层细胞侵袭力受损及螺旋动脉血管重构异常是子痫前期发展的基本特征[2]。研究显示,高糖可诱导人绒毛膜滋养层细胞自噬并促进细胞凋亡[3]。第10号染色体缺失的磷酸酶及张力蛋白同源物基因(phosphatase and tensin homology deleted on chromosome ten,PTEN)是一种抑癌基因,能够诱导肿瘤细胞、人绒毛膜滋养层细胞等凋亡,抑制细胞侵袭[4]。贾真等[5]研究显示,PTEN在子痫前期胎盘中过表达,其过表达可抑制滋养层细胞的侵袭和血管生成能力。邱瑞莹等[6]研究发现,妊娠期糖代谢异常是子痫前期发病的危险因素,显著增加子痫前期发生率。目前有关PTEN在高糖诱导的人绒毛膜滋养层细胞凋亡中作用机制的研究鲜有报道。本研究旨在探讨PTEN在高糖诱导的人绒毛膜滋养层细胞HTR-8/SVneo凋亡中的作用机制,以期为深入研究人绒毛膜滋养层细胞功能异常相关的病理性妊娠提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞 人绒毛膜滋养层细胞HTR-8/SVneo(批号MCM-0599)购自宁波明舟生物科技有限公司。
1.1.2 主要试剂和仪器 RPMI-1640培养基(批号NBG1236)购自美国Hyclone公司;胎牛血清(批号36G5782)购自美国Gibco公司;青霉素(批号FH673J)、二甲基亚砜(批号N6582J)、Lipofectamine 3000转染试剂(批号SI70019)、四甲基偶氮唑蓝(MTT,批号1120-02-1)、哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂(GDC-0349,批号T6510)均购自美国Sigma公司;PTEN-siRNA的阴性对照(批号SJ6009R)、PTEN-siRNA(批号SJ5002R)购自上海恒斐生物科技有限公司;胰蛋白酶(批号BD735N)、蛋白提取试剂盒(批号ME861R)、AnnexinV-FITC/PI细胞凋亡双染试剂盒(批号HUDY03)均购自上海碧云天生物技术有限公司;活化的半胱氨酸天冬氨酸蛋白水解酶3(cleaved caspase-3)抗体(批号XIN-56)、B淋巴细胞瘤-2(Bcl-2)抗体(批号XMN-68)、Bcl-2相关X蛋白(Bax)抗体、PTEN抗体(批号BYCM-10005059)、磷脂酰肌醇-3激酶(PI3K)抗体(批号PL0402037)、磷酸化PI3K(p-PI3K)抗体(批号JCSW2521)、蛋白激酶B(AKT)抗体(批号FNab00273)、磷酸化AKT(p-AKT)抗体(批号F48643)、mTOR抗体(批号ATA33361)、磷酸化mTOR(p-mTOR)抗体(批号IC194464)、GAPDH抗体(批号AL00167)、山羊抗兔二抗(批号674GN6)均购自美国Proteintech公司。CO2培养箱(型号NHD DYE1738)购自日本sanyo公司;Elx800酶标仪(型号HSG9832)购自美国Thermo公司;流式细胞仪(型号BeamCyte)购自常州必达科生物科技有限公司;凝胶成像系统(型号BioDoc-It220)购自美国UVP公司。
1.2 方法
1.2.1 细胞株培养 人绒毛膜滋养层细胞HTR-8/SVneo培养于含10%灭活胎牛血清、100 U/mL青霉素的RPMI-1640培养基中,放置于37℃饱和湿度、5%CO2及20%O2培养箱中,稳定传代后收集对数生长期细胞进行后续实验。
1.2.2 细胞分组 取1.2.1对数生长期的人绒毛膜滋养层细胞HTR-8/SVneo,重悬后接种于6孔板(1×106个/孔),待细胞融合度至80%时进行实验。用含10%灭活胎牛血清的培养基培养24 h后分组。(1)空白对照组:仅加无血清培养基。(2)高糖组:加入浓度为50 mmol/L葡萄糖溶液[7]处理48 h。(3)NC组(阴性对照组):加入浓度为50 mmol/L葡萄糖溶液处理48 h后,加入5μL Lipofectamine 3000和PTEN-siRNA的阴性对照。(4)PTEN-siRNA组(抑制PTEN表达组):加入浓度为50 mmol/L葡萄糖溶液处理48 h后,转染PTEN-siRNA序列。(5)GDC-0349组(mTOR通路抑制剂组):加入浓度为50 mmol/L葡萄糖溶液处理48 h,转染PTEN-siRNA序列后,加入50μmol/L GDC-0349溶液[8]。严格按照转染试剂盒说明书进行操作,转染后用无血清新鲜RPMI-1640培养基继续培养24 h,收集各组细胞用于后续实验。
1.2.3 MTT法检测HTR-8/SVneo细胞增殖能力 取1.2.2各组培养48 h的人绒毛膜滋养层细胞HTR-8/SVneo,经胰酶消化后接种至96孔板(5×104个/孔)继续培养24 h,向各孔加入MTT(5 g/L)20μL,继续培养4 h,弃去培养液,再分别加入150μL二甲基亚砜振荡15 min,使蓝紫色结晶充分溶解。在酶标仪中490 nm处测定各孔细胞光密度(OD),每组设置6个复孔,取平均值。计算细胞增殖抑制率(%)=(空白对照组OD-实验组OD)/空白对照组OD×100%。
1.2.4 流式细胞仪检测细胞凋亡 取1.2.2各组培养48 h的人绒毛膜滋养层细胞HTR-8/SVneo,PBS溶液洗涤2次,弃上清,并调节浓度至1×106个/mL的细胞悬液,取100μL细胞悬液加入5μL的AnnexinV/PITC及10μL质量浓度为20 mg/L的PI混匀,室温避光孵育30 min,流式细胞仪检测凋亡率。细胞凋亡率=(凋亡细胞数/总细胞数)×100%。每组重复6次。
1.2.5 蛋白免疫印迹法检测凋亡相关蛋白及PTEN/mTOR通路相关蛋白表达变化 取1.2.2各组培养48 h的人绒毛膜滋养层细胞HTR-8/SVneo,每组重复6次,PBS洗涤2次,冰上加裂解液,裂解30 min,离心取上清,Lowry法进行蛋白定量。取50μg蛋白样品进行电泳分离,电泳结束后,将凝胶上的蛋白转移至PVDF膜上(95 mA电流)3 h。脱脂牛奶(5%)封闭3 h,加入cleaved caspase-3、Bcl-2、Bax、PTEN、p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR、GAPDH抗体作为一抗(1∶1 000),4℃孵育过夜,TBST洗膜3次,次日加入山羊抗兔二抗(1∶5 000)及TBST,室温孵育2 h,TBST洗膜,ECL化学发光法显色,采用Quantity One凝胶成像系统抓拍图像并检测各条带灰度值,以目的蛋白灰度值与内参蛋白GAPDH灰度值比值作为蛋白相对表达量。
1.3 统计学方法 采用SPSS 24.0软件对数据进行分析。计量资料以±s表示,多组间比较采用单因素方差分析,多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组HTR-8/SVneo细胞增殖及凋亡情况比较 与空白对照组比较,高糖组HTR-8/SVneo细胞增殖抑制率及凋亡率显著升高(P<0.05);与高糖组、NC组比较,PTEN-siRNA组HTR-8/SVneo细胞增殖抑制率及凋亡率均显著降低(P<0.05);与PTENsiRNA组比较,GDC-0349组HTR-8/SVneo细胞增殖抑制率及凋亡率显著升高(P<0.05),见图1、表1。
2.2 各组HTR-8/SVneo细胞凋亡相关蛋白表达水平比较 与空白对照组比较,高糖组HTR-8/SVneo细胞Bcl-2蛋白表达水平显著降低,Bax、cleaved caspase-3蛋白表达水平显著升高(P<0.05);与高糖组、NC组比较,PTEN-siRNA组HTR-8/SVneo细胞Bcl-2蛋白表达水平显著升高,Bax、cleaved caspase-3蛋白表达水平显著降低(P<0.05);与PTEN-siRNA组比较,GDC-0349组HTR-8/SVneo细胞Bcl-2蛋白表达水平显著降低,Bax、cleaved caspase-3蛋白表达水平显著升高(P<0.05),见图2、表2。

Fig.1 Flow cytometry of HTR-8/SVneo cell apoptosis in each group图1 各组HTR-8/SVneo细胞凋亡流式图
Tab.1 Comparison of the proliferation inhibition rate and apoptosis rate of HTR-8/SVneo cells between the five groups表1 各组HTR-8/SVneo细胞增殖抑制率及凋亡率的比较(n=6,%,±s)

Tab.1 Comparison of the proliferation inhibition rate and apoptosis rate of HTR-8/SVneo cells between the five groups表1 各组HTR-8/SVneo细胞增殖抑制率及凋亡率的比较(n=6,%,±s)
**P<0.01;a与空白对照组比较,b与高糖组比较,c与NC组比较,d与PTEN-siRNA组比较,P<0.05;表2、3同。
组别空白对照组高糖组NC组PTEN-siRNA组GDC-0349组F细胞增殖抑制率0 29.32±5.82a 29.36±5.85a 12.56±2.92abc 21.53±3.58abcd 17.120**凋亡率8.51±1.59 30.87±4.93a 30.00±4.95a 15.33±3.05abc 22.82±4.37abcd 34.671**
2.3 各组HTR-8/SVneo细胞PTEN/mTOR通路蛋白表达水平比较 与空白对照组比较,高糖组HTR-8/SVneo细胞PTEN蛋白表达水平显著升高,p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR显著降低(P<0.05);与高糖组、NC组比较,PTEN-siRNA组HTR-8/SVneo细胞PTEN蛋白表达水平显著降低,p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR显著升高(P<0.05);与PTEN-siRNA组比较,GDC-0349组HTR-8/SVneo细胞PTEN蛋白表达水平差异无统计学意义(P>0.05),p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR显著降低(P<0.05),见图3、表3。

Fig.2 Western blot detection of HTR-8/SVneo cell apoptosis-related proteins in each group图2 各组HTR-8/SVneo细胞凋亡相关蛋白印迹图
Tab.2 Comparison of the expression levels of apoptosis-related proteins in HTR-8/SVneo cells between the five groups表2 各组HTR-8/SVneo细胞凋亡相关蛋白表达水平比较(n=6,±s)

Tab.2 Comparison of the expression levels of apoptosis-related proteins in HTR-8/SVneo cells between the five groups表2 各组HTR-8/SVneo细胞凋亡相关蛋白表达水平比较(n=6,±s)
组别空白对照组高糖组NC组PTEN-siRNA组GDC-0349组F Bcl-2 1.17±0.18 0.36±0.05a 0.35±0.04a 0.87±0.09abc 0.55±0.06abcd 78.174**Bax 0.19±0.04 1.25±0.18a 1.26±0.19a 0.63±0.13abc 0.97±0.15abcd 56.575**cleaved caspase-3 0.23±0.04 1.18±0.18a 1.19±0.19a 0.61±0.11abc 0.87±0.13abcd 50.034**
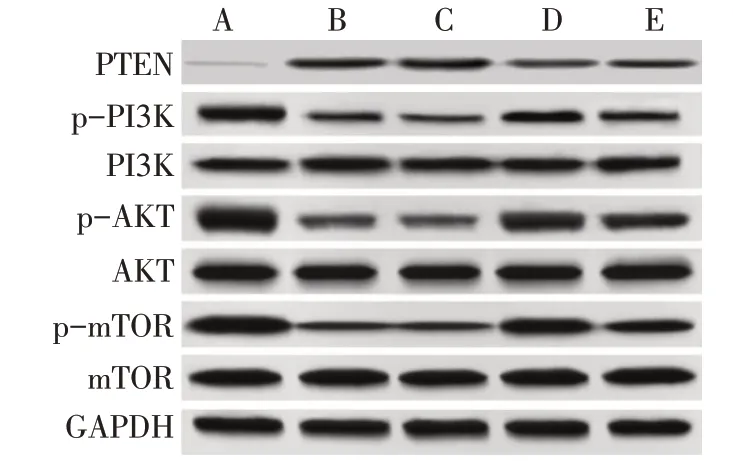
Fig.3 Western blot detection of PTEN/mTOR pathway-related proteins in HTR-8/SVneo cells图3 各组HTR-8/SVneo细胞PTEN/mTOR通路蛋白印迹图
Tab.3 Comparison of PTEN/mTOR pathway protein expression levels between five groups of HTR-8/SVneo cells表3各组HTR-8/SVneo细胞PTEN/mTOR通路蛋白表达水平比较 (n=6,±s)
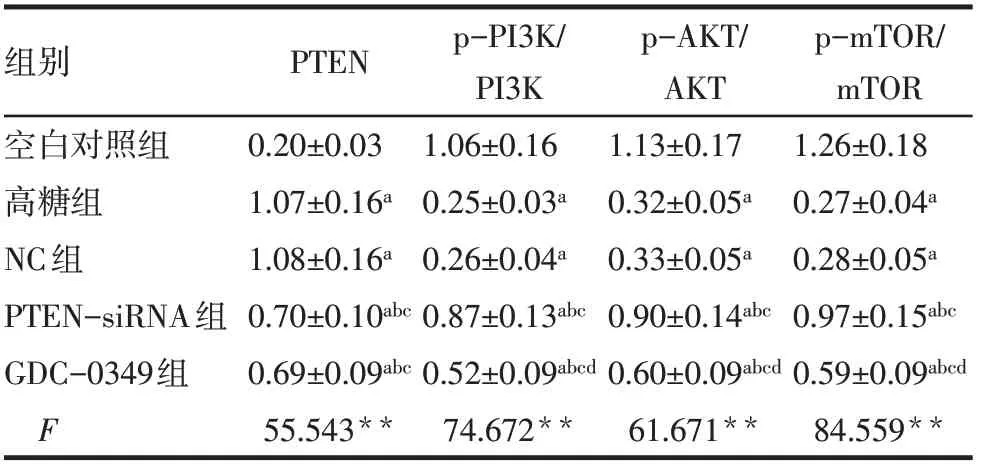
Tab.3 Comparison of PTEN/mTOR pathway protein expression levels between five groups of HTR-8/SVneo cells表3各组HTR-8/SVneo细胞PTEN/mTOR通路蛋白表达水平比较 (n=6,±s)
组别空白对照组高糖组NC组PTEN-siRNA组GDC-0349组F PTEN 0.20±0.03 1.07±0.16a 1.08±0.16a 0.70±0.10abc 0.69±0.09abc 55.543**p-PI3K/PI3K 1.06±0.16 0.25±0.03a 0.26±0.04a 0.87±0.13abc 0.52±0.09abcd 74.672**p-AKT/AKT 1.13±0.17 0.32±0.05a 0.33±0.05a 0.90±0.14abc 0.60±0.09abcd 61.671**p-mTOR/mTORimages/BZ_16_377_2680_379_2682.png1.26±0.18 0.27±0.04a 0.28±0.05a 0.97±0.15abc 0.59±0.09abcd 84.559**
3 讨论
3.1 高糖抑制人绒毛膜滋养层细胞HTR-8/SVneo增殖 研究显示,妊娠合并糖尿病患者胎儿生长受限、胎儿畸形及先兆子痫等发生率高达6%~10%[9]。人绒毛膜滋养层细胞来源于胚胎外胚层,具有类似肿瘤细胞的增殖、浸润等生物学特性,能够侵入母体蜕膜组织,为胚胎的发育提供充足的氧气与营养[10]。目前有关高糖诱导的人绒毛膜滋养层细胞增殖抑制的机制尚未明晰。本研究通过采用含50 mmol/L葡萄糖RPMI-1640培养基模拟高糖环境,观察高糖对HTR-8/SVneo细胞增殖的影响,结果显示,高糖可抑制人绒毛膜滋养层细胞HTR-8/SVneo增殖。
3.2 高糖促进人绒毛膜滋养层细胞HTR-8/SVneo凋亡 人绒毛膜滋养层细胞过度凋亡、细胞浸润能力减弱是子痫前期、胎儿畸形等发生的原因之一[11]。韩云等[12]研究发现,妊娠糖尿病合并胎儿宫内生长受限可能与人绒毛膜滋养层细胞过度凋亡关系密切。Bcl-2是一种原癌基因,能抑制细胞凋亡[13]。Bax是人体最主要的促凋亡基因之一,当受到诱导凋亡刺激时,两者结合在线粒体膜上形成异二聚体,使线粒体膜通透性增加[14]。caspase-3是凋亡途径的关键因素[15]。本研究结果显示,与空白对照组相比,高糖组HTR-8/SVneo细胞凋亡率升高,Bax、cleaved caspase-3蛋白表达水平均显著升高,且Bcl-2蛋白表达水平显著降低,与韩云等[12]研究结果一致,提示高糖可诱导人绒毛膜滋养层细胞HTR-8/SVneo凋亡。
3.3 高糖通过PTEN/mTOR通路影响人绒毛膜滋养层细胞的增殖和凋亡 PTEN是一种双重脂质磷酸酶,是一种抑癌因子。方晓珊等[16]研究显示,子痫前期胎盘中PTEN高表达能够加重母体内皮损伤以及胎盘滋养细胞损伤。且有研究证实,PTEN负向调控PI3K/AKT/mTOR信号通路[17]。PI3K是PI3K/AKT/mTOR信号通路的起始因子,其活化产生第二信使膜磷脂酰肌醇-3,4,5-三磷酸(PIP3),PIP3进一步磷酸化AKT蛋白的Thr308位点,促使AKT活化,而活化的AKT磷酸化并激活其下游靶蛋白mTOR,进而促进细胞生长,抑制细胞凋亡[18]。本研究结果显示,下调PTEN表达后HTR-8/SVneo细胞增殖抑制率、凋亡率,Bax、cleaved caspase-3蛋白表达水平均显著降低,且Bcl-2、p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR蛋白表达水平显著升高,提示抑制PTEN表达可以促进人绒毛膜滋养层细胞HTR-8/SVneo增殖,抑制其凋亡,可能与促进PI3K/AKT/mTOR信号通路活化有关。进一步研究发现,加入mTOR通路抑制剂可在一定程度上逆转抑制PTEN表达对HTR-8/SVneo细胞增殖、凋亡的影响,进一步提示下调PTEN表达可能通过激活PI3K/AKT/mTOR通路发挥促HTR-8/SVneo细胞增殖的作用。
综上所述,高糖可诱导人绒毛膜滋养层细胞HTR-8/SVneo凋亡,可能与上调PTEN表达、抑制PI3K/AKT/mTOR信号通路活化有关,可为人绒毛膜滋养层细胞功能异常相关的病理妊娠提供一定参考。本研究尚存在一定不足:首先,本研究未通过上、下游阻断和过表达实验验证PTEN调控PI3K/AKT/mTOR信号通路对表型变化的影响;其次,仅测定了mTOR总蛋白的表达变化,未单独检测mTOR1和mTOR2的蛋白水平;另外,未能明确PTEN/PI3K/AKT/mTOR通路在高糖诱导的HTR-8/SVneo细胞凋亡中的具体作用机制。后期仍需进一步研究。

