LncRNA AL133467.1作为miR-661的ceRNA抑制乳腺癌细胞增殖和侵袭
王 馨, 黄嘉星, 周丽欢, 陈伙娣, 冯正富, 邱惠思
(广州医科大学附属第六医院肿瘤科,清远市人民医院,广东, 清远 511518)
据2020年全球最新癌症负担数据显示,乳腺癌已成为全球最常见的癌症,预估2020年全球乳腺癌新发病例高达226万例,占总癌症发生病例的11.7%,死亡病例约为86万例,占总癌症死亡病例的6.9%[1]。虽然随着乳腺癌治疗方式的不断改进和调整,乳腺癌患者的5年生存率在不断提高,但乳腺癌的发病率在全球呈逐年上升趋势[2]。因此,阐释乳腺癌发生和发展机制,提高乳腺癌治疗效果和降低乳腺癌患者的死亡率至关重要。
长非编码RNAs(long non-coding RNAs, lncRNAs)是一类转录本长度超过200个核苷酸,并缺乏明显的开放式阅读框架的长链RNAs。LncRNAs参与调控细胞生长、分化和凋亡等多种细胞生物学过程[3-4]。越来越多的证据表明,LncRNAs可能通过作为“分子海绵”吸附miRNA,抑制miRNA的靶基因,在癌细胞中形成竞争性内源性RNA(competing endogenous RNA, ceRNA)网络,发挥促进或抑制肿瘤的作用[5-6]。研究发现,lncRNA HOTAIR通过结合miR-331-3p上调人表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)表达促进胃癌进展[7]。此外,外泌体传递的lncARSR可作为miR-34/miR-449的“分子海绵”,诱导间质表皮转化因子(c-mesenchymal-epithelial transition factor, c-MET)和AXL(Anexelekto)表达,介导肾细胞癌对舒尼替尼耐药[8]。MiR-661作为一种肿瘤抑制因子首次在乳腺癌中被发现,它通过抑制转移相关蛋白1(metastasis associated protein 1, MTA1)抑制肿瘤细胞的增殖和侵袭[9]。研究发现,HNF1A-AS1作为ceRNA与miR-661竞争性结合,上调细胞分裂周期34(cell division cycle 34, CDC34)的表达,促进胃癌进展[10]。前期我们分析TCGA(the cancer genome atlas)数据库中正常乳腺组织(113例)和乳腺癌组织(1 109例)中lncRNAs的表达情况,发现乳腺癌组织中LncRNA AL133467.1的表达明显下调,Kaplan-Meier生存分析提示,AL133467.1与乳腺癌癌患者的预后不良呈负相关。本研究将探索AL133467.1在乳腺癌中的生物学功能及其相关分子机制,为揭示AL133467.1在乳腺癌发生发展中的作用提供理论依据。
1 材料与方法
1.1 细胞培养
人乳腺癌细胞MDA-MB-231、T47D、SKBR3、BT549、BT474、MCF7、HCC1937和人正常乳腺上皮细胞MCF10A,以及人胚胎肾细胞HEK293T由本实验室保存,乳腺癌细胞接种于含10% FBS(Biological Industries公司)的1640培养基(Biological Industries公司)中,HEK293T细胞接种于含10% FBS的DMEM培养基(Biological Industries公司)中,MCF10A细胞接种于含有5%马血清,10 mg/ml胰岛素和0.5 mg/mL氢化可的松的DMEM/F12(1∶1)培养基(Gibco公司)中,细胞置于37 ℃、5% CO2培养箱中培养,取对数生长期细胞用于后续实验。
1.2 实时荧光定量PCR
用miRNA Isolation Kit试剂盒(Omega公司)提取细胞中mRNA和miRNA,用逆转录试剂盒(Thermofisher公司)将mRNA逆转录成cDNA,再用SYBR Master Mix 试剂盒(Fermentas公司)进行qRT-PCR,用All-in-one miRNA qRT-PCR Detection Kit试剂盒(GeneCopoeia公司)进行miRNA逆转录和qRT-PCR,上述操作按说明书进行,再于实时定量荧光PCR仪(BioRad)上运行相应程序。根据2-ΔΔct值计算并分析结果。miR-661和U6引物购于锐博生物,其他引物序列见Table 1。
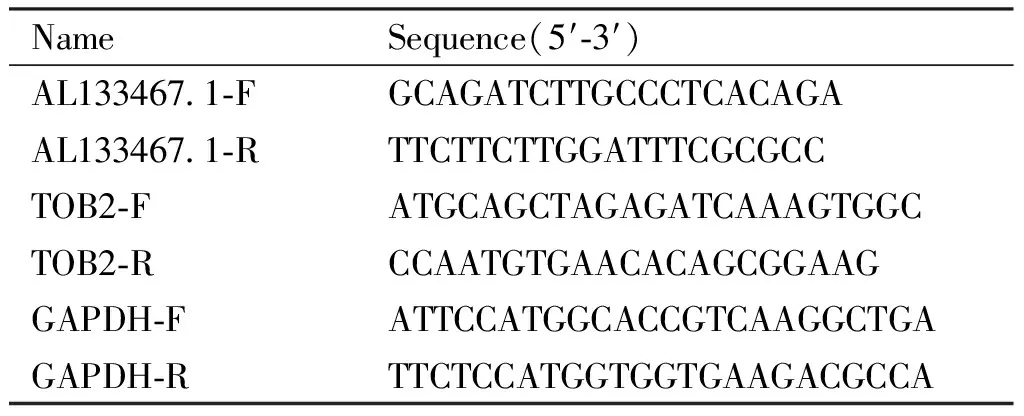
Table 1 List of primers
1.3 Western 印迹检测
实验所需细胞用预冷的PBS清洗2遍,用1/100蛋白酶抑制剂(cocktail)的RIPA裂解液裂解细胞,用刮子刮下细胞放入1.5 mL EP管中置于冰上超声5次(超声2 s,间隔5 s),4 ℃条件下12 000 g离心15 min,吸取离心后的上清,用BCA法测定蛋白质浓度,30 μg蛋白质上样进行电泳,经恒流200 mA转膜90 min,在室温下用5%脱脂牛奶封闭2 h,再孵育一抗anti-TOB2(1∶500,sc-293326,Santa cruz)、β-肌动蛋白(β-actin)(1∶3 500,A5316,Sigma),4 ℃摇床过夜,TBST洗膜后,孵育二抗(1∶5 000,Cat. #31430,Thermo Scientific),室温下摇2 h,TBST洗膜,在膜上滴加ECL液在暗室发光,待胶片晾干后扫描。
1.4 慢病毒包装和稳定细胞株的筛选
将AL133467.1全长序列克隆入pReceiver-Lv201载体,将TOB2全长序列克隆入pReceiver-Lv203载体。上述质粒及相应的过表达质粒用慢病毒包装试剂盒(Lenti-Pac HIV Expression Packaging Kit,广州易锦生物有限公司)进行病毒包装。步骤如下:1)将HEK293T细胞接种10×10 cm皿中,待密度达到80%左右;2)配制体系:(1)将5 μL lenti-Pac HIV mix,2.5 μg质粒和200 μL Optim-MEM轻轻混匀;(2)将15 μL EndoFection lenti和200 μL Optim-MEM轻轻混匀;(3)将(1)滴加到(1)中轻轻混匀,室温下静置18 min;3)将上述混合液加入到含有10 mL新鲜培养基的HEK293T细胞皿中培养12 h;4)将HEK293T细胞皿中的培养基换成含有20 μL TiterBoost 的10 mL新鲜培养基培养36 h,收集病毒液,离心后,于-80 ℃保存。将待转染细胞接种于12孔板中,密度约40%左右,每孔加入1 mL病毒液,转染48 h,用1 μg/mL嘌呤霉素进行细胞筛选。检测过表达稳定细胞系建立后,进行后续实验。
1.5 细胞计数
取500 μL完全培养基,重悬1×104个细胞/孔于24孔板中,每组细胞设置3个复孔,分别于1、2、3、4和5 d,将细胞消化。计数后,统计各孔细胞总数目,计算两组之间的P值,并绘制曲线。
1.6 Transwell实验
将实验细胞消化,并用无血清培养基清洗2遍,细胞计数1×106/mL,取200 μL细胞悬液,分别接种于已经水化基底膜Transwell小室的上室中,在下室中加入600 μL的完全培养基,再将细胞置于37 ℃、5%细胞培养箱中培养36 h。将Transwell小室放入甲醇中固定30 min,结晶紫中染色20 min。晾干后与显微镜进行拍照。
1.7 克隆形成实验
将实验细胞经消化和计数后,接种800个/孔细胞到6孔板中。每个孔含有2 mL完全培养基,然后置于37 ℃、5%细胞培养箱中,每隔3 d换液1次。培养8 d后,用甲醇固定细胞过夜,结晶紫染色20 min,经水漂洗干净,晾干后在显微镜下拍照,并统计克隆个数。
1.8 细胞划痕实验
将细胞消化和计数后,接种于12孔板中,第2 d待细胞贴壁后,进行细胞划痕,分别于0 h、24 h、72 h在显微镜下拍照。
1.9 细胞转染
提前1 d将HEK293T细胞以10 000个/孔接种于96孔板中,用Lipofectamine3000进行转染:(1) 50 μL无血清RPMI1640+0.5 μL Lipofectamine 3 000,轻轻混匀;(2) 50 μL无血清RPMI1640+0.03 μg RLTK和0.3 μg质粒,轻轻混匀;再将(1)和(2)轻轻混匀,室温下静置18 min;96孔板换成100 μL的完全培养基,再将上述混合物轻轻滴加入到96孔板中,于37 ℃、5% CO2培养箱培养48 h,用于后续检测。
1.10 双荧光素酶报告基因检测
用miRDB在线软件预测AL133467.1与miR-661的可能结合位点。分别合成含有 miR-661 结合位点的AL133467.1的 3′ UTR区片段。并将其克隆到荧光素酶报告基因pGL3载体上为野生型(WT),含有突变AL133467.1 3′ UTR 结合位点的载体,被克隆入荧光素酶报告pGL3载体为突变型(Mut)。按照上述转染步骤,分别将miR-661 mimics或Vector分别与野生或突变载体共转染至HEK293T,转染48 h,吸去培养基,PBS洗细胞2次,每孔加入25 μL 1×裂解缓冲液室温下慢速摇20 min。吸取每孔中20 μL裂解液转移到Costar白板上,每孔再加入50 μL萤火虫荧光素酶底物,再于多功能酶标仪检测;每孔再加入50 μL终止液&海肾荧光素酶底物,于酶标仪检测,计算萤火虫荧光值与海肾荧光值的比值。
1.11 统计学方法
采用GraphPad Prism 7分析所有实验数据。实验数据以Mean±SD表示,两组比较采用独立样本t检验,实验独立重复3次,P<0.05认为差异具有统计学意义。
2 结果
2.1 AL133467.1在乳腺癌中低表达并与患者预后相关
通过分析TCGA(The cancer genome atlas)数据库中113例正常乳腺组织和1 109例乳腺癌组织中AL133467.1的表达,发现AL133467.1在乳腺癌组织中的表达量明显低于正常乳腺组织(Fig.1A);进一步通过生存分析发现,AL133467.1的表达与乳腺癌患者预后不良呈负相关(Fig.1B);本文采用qRT-PCR检测了乳腺上皮细胞和乳腺癌细胞中的AL133467.1表达情况,结果发现,在乳腺癌细胞MDA-MB-231、T47D、SKBR3、BT549、BT474、MCF7、HCC1937的表达量分别是MCF10A细胞的0.39倍、0.49倍、0.1倍、0.24倍、0.16倍、0.36倍和0.6倍(Fig.1C)。

Fig.1 AL133467.1 is expressed at a low level in breast cancers and is correlated with prognosis of patients (A) The expression of AC009686.2 and (B) correlation between AL133467.1 expression and prognosis of breast cancer patients in normal breast tissues (n=113) and breast cancer tissues (n=1 109) in TCGA (The cancer genome atlas) database. (C) The qRT-PCR assay was used to determine the AL133467.1 expression, vs MCF10A, **P<0.01, ***P<0.001, ****P<0.0001
2.2 AC009686.2能抑制乳腺癌细胞的增殖和克隆形成能力
上述研究发现,AL133467.1在乳腺癌细胞SKBR3和BT474中表达量较低。为了进一步研究AL133467.1在乳腺癌中的作用,本文在SKBR3和BT474细胞中建立过表达AL133467.1的稳定细胞株,通过qRT-PCR验证过表达AL133467.1的细胞株成功建立(Fig.2A);进一步通过细胞计数和平板克隆检测发现,过表达AL133467.1能明显抑制SKBR3和BT474细胞的增殖能力(Fig.2B)(P<0.05)和克隆形成能力(P<0.001)(Fig.2C)。

Fig.2 AL133467.1 inhibited the proliferation and colony formation of breast cancer cells (A) AL133467.1 overexpression plasmids and control plasmids were transfected into SKBR3 and BT474 cells, respectively. qRT-PCR assays were used to evaluate AL133467.1 expression levels in each group, vs Vector, ****P<0.0001. (B) The proliferation and (C) Colony numbers of breast cells above were measured by MTS assays and colony formation assay, vs Vector, *P<0.05, **P<0.01, ***P<0.001, ****P<0.0001
2.3 过表达AL133467.1能抑制乳腺癌细胞的迁移和侵袭
为了进一步研究AL133467.1对乳腺癌细胞迁移和侵袭的影响,本文用细胞划痕实验检测发现,过表达AL133467.1能明显抑制SKBR3和BT474细胞的迁移能力(Fig.3A);进一步采用Transwell侵袭实验显示,相比于对照组,在SKBR3和BT474细胞中过表达AL133467.1侵袭能力下降了92.3%和93.2% (Fig.3B)。
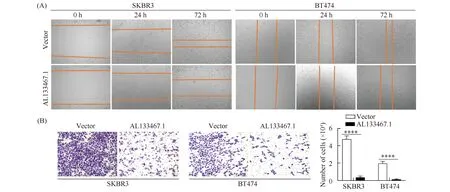
Fig.3 Overexpression of AL133467.1 inhibits the migration and invasion of SKBR3 and BT474 cells (A) Wound Healing assays detected the migration ability of SKBR3 and BT474 cells after overexpression of AL133467.1. (B) Transwell assays were used to show the number of invasion cells, vs Vector, ****P<0.0001
2.4 AL133467.1靶向调控miR-661表达抑制乳腺癌细胞的侵袭能力
为了阐明AL133467.1在乳腺癌中的作用机制,本文通过在线网站miRDB(http://mirdb.org/)预测可能与AL133467.1靶向结合的miRNA,发现AL133467.1可能与miR-661存在2个结合位点(Fig.4A);进一步采用qRT-PCR检测发现,miR-661在乳腺癌细胞MDA-MB-231、T47D、BT549、SKBR3、HCC1937、BT474、MCF7中的表达量分别是乳腺上皮细胞MCF10A的5.37倍、3.97倍、7.19倍、8.94倍、6倍、8.14倍,和6.02倍(Fig.4B);Kaplan-Meier 生存分析显示,miR-661高表达与乳腺癌患者的预后不良呈正相关(Fig.4C);为了观察AL133467.1与miR-661的相互作用,本文分别构建了野生型AL133467.1或具有miR-661靶向位点缺失突变的AL133467.1的荧光素酶报告基因载体,与miR-661 mimics或对照质粒共转染至HEK293T细胞中,双荧光素酶报告基因结果显示,miR-661 mimics能明显抑制野生型报告基因的荧光素酶活性,而对突变型的报告基因的荧光素酶报告的活性无明显影响(Fig.4D);此外,本文用qRT-PCR方法在过表达AL133467.1的乳腺癌细胞中检测miR-661的表达发现,与对照组相比,过表达AL133467.1后,乳腺癌细胞SKBR3和BT474细胞中miR-661表达分别是相应对照组的0.81倍和0.69倍(Fig.4E);为了进一步观察miR-661在AL133467.1抑制乳腺癌细胞侵袭中的作用,本文在SKBR3和BT474细胞中过表达AL133467.1的基础上进一步过表达miR-661,结果显示,过表达miR-661能明显消除过表达AL133467.1的抑制侵袭作用(Fig.4F)。

Fig.4 AL133467.1 inhibited breast cancer invasion by specifically regulating miR-661 (A) Schematic illustration of the interaction between AL133467.1 and miR-661 predicted with miRDB (http://mirdb.org/custom.html). (B) The expression of miR-661 was determined by qRT-PCR in breast cancer cells, vs MCF10A, ***P<0.001, ****P<0.0001. (C) Kaplan-Meier analysis indicated correlation between high miR-661 levels and poor overall survivals in breast cancer patients. (D) Luciferase activity indicated that miR-661 targeted AL133467.1, **P<0.01, ***P<0.001, ****P<0.0001. (E) The relative expression of miR-661 was detected after overexpression of AL133467.1, vs Vector, ****P<0.0001. (F) Ectopic expression of miR-661 diminished the effects of AL133467.1 overexpression on the invasion of SKBR3 and BT474 cells, ***P<0.001, ****P<0.0001
2.5 AL133467.1通过与miR-661相互作用促进酪氨酸激酶2传感器的表达
为了探讨AL133467.1在乳腺癌细胞中的下游调控机制,本文采用在线数据库miRDB(http://mirdb.org/)预测miR-661的可能靶基因,发现miR-661与TOB2的3′UTR存在结合位点(CCCAGGCA)(Fig.5A);为了进一步研究AL133467.1是否作为内源性RNA与TOB2竞争结合miR-661,本文在SKBR3和BT475细胞中单独过表达AL133467.1,或同时过表达AL133467.1和miR-661检测TOB2的mRNA和蛋白质水平,qRT-PCR检测结果发现,单独过表达AL133467.1能明显上调乳腺癌细胞中TOB2的mRNA水平,较对照组相比上调了14.4倍和18.1倍,而在此基础上进一步过表达miR-661能消除过表达AL133467.1引起的TOB2的mRNA水平上调,分别是对照组的0.17倍和0.18倍(Fig.5B);Western印迹显示同样的结果(Fig.5C);以上结果提示,在乳腺癌细胞中AL133467.1可作为miR-661的内源性竞争RNA促进TOB2的表达。

Fig.5 AL133467.1 regulated the expression of TOB2 by interacting with miR-661 (A) Schematic illustration of the binding site of miR-661 and TOB2 mRNA 3′UTR. (B) miR-661 mimics was transfected into SKBR3 and BT474 cells together with AL133467.1 overexpression plasmids. qRT-PCR assays were performed to evaluate TOB2 expression in these cells, vs Vec, ****P<0.0001. (C) Western blotting assays were used to measure TOB2 expression levels in each group
3 讨论
长非编码RNA是ncRNAs的主要组成部分,通过哺乳动物的转录组研究发现,lncRNA基因的数量可达蛋白质编码基因的3倍[11]。lncRNA能调控细胞内的基本过程,在表观遗传学、转录和翻译调控以及关键亚细胞结构或隔间的支架中发挥关键作用,lncRNA能识别细胞中的各种分子靶标,能调节蛋白质功能,有助于核结构形成,并协助转录和翻译因子具有正确的靶向性[12-14]。此外,lncRNA在人类疾病中至关重要,例如癌症、感染和发育障碍等。迄今为止,lncRNA被发现在调节细胞周期、生长和凋亡等细胞过程中发挥关键作用[15-16]。大量研究发现,lncRNA可以执行多种功能,包括顺式或反式的转录调节、蛋白质、核结构域的组织或RNA分子的调节[17]。反式作用的lncRNA可能通过调节其直接结合的蛋白质或RNA的活性或丰度发挥作用。lncRNA还能通过碱基配对相互作用调节与之结合的其他RNA的丰度或活性,它可以调节microRNA (miRNA)的活性,充当相互竞争的内源性RNA(competing endogenous RNA, ceRNAs)或天然的microRNA“海绵”,减少对其靶基因的抑制作用。研究发现,LINC01234可作为一种ceRNA,靶向miR-204-5p调节核心结合因子, β 亚基(core-binding factor subunit beta, CBFB)的表达,从而促进胃癌细胞增殖[18]。在骨肉瘤中,DANCR通过作为miR-335-5p和miR-1972的“分子诱饵”,促进Rho相关蛋白激酶(Rho-associated protein kinase-1, ROCK1)介导的肿瘤生长和肺转移[19]。在乳腺癌中,SNORD3A作为miR-185-5p的竞争性内源性RNA,导致尿苷单磷酸合成酶(uridine monophosphate synthetase, UMPS)蛋白质上调,特异性增加乳腺癌细胞对5-FU的化疗敏感性[20]。本文从TCGA(The cancer genome atlas)数据库分析发现,lncRNA AL133467.1在乳腺癌组织中低表达,并且与乳腺癌患者的预后相关。AL133467.1位于14号染色体上,全长993 bp,关于AL133467.1在乳腺癌中的相关研究暂未见到报道。本研究为了验证TCGA(The cancer genome atlas)数据库分析结果,利用qRT-PCR检测了乳腺上皮细胞和乳腺癌细胞中AL133467.1的表达,发现AL133467.1在乳腺癌细胞中明显低表达;并且发现过表达AL133467.1能明显抑制乳腺癌细胞的增殖、迁移和侵袭能力。通过生物信息学分析发现AL133467.1与miR-661存在2个结合位点。荧光素酶报告基因检测证实,AL133467.1可通过预测的2个结合位点与miR-661特异性结合。同时,在乳腺癌细胞中过表达AL133467.1能明显抑制miR-661的表达。microRNA是长度在20~22 nt的非蛋白质编码小RNA,参与细胞的增殖、凋亡和分化等多种生理过程,它们通过与mRNA的3′ UTR相互作用促进其降解或抑制其翻译,发挥抑癌因子或致癌基因的作用[21-22]。本研究通过qRT-PCR检测发现miR-661在乳腺癌细胞中高表达,Kaplan-Meier 生存分析发现miR-661高表达提示乳腺癌患者的预后不良,并且过表达miR-661能逆转过表达AL133467.1对乳腺癌细胞的侵袭能力的抑制作用。以上结果提示,AL133467.1在乳腺癌中发挥抑癌作用是通过靶向调控miR-661的表达实现的。
为了进一步研究miR-661的下游靶基因,通过生物信息学预测发现,miR-661与TOB2的3′ UTR存在结合位点。TOB2是 Tob/BTG 家族成员之一,据报道,TOB2在多种肿瘤中发挥作用,被认为是一种潜在的肿瘤抑制因子[23-24]。本文发现,过表达AL133467.1能明显上调乳腺癌细胞中TOB2的mRNA和蛋白质水平,而过表达miR-661能逆转这种作用。综上所述,AL133467.1可作为miR-661的内源性竞争性RNA上调TOB2的表达,从而抑制乳腺癌细胞的增殖、迁移和侵袭。本研究为以lncRNA为治疗靶点的乳腺癌的预防和治疗策略提供新的实验依据。

