黄连-黄芩药对治疗肥胖的作用机制探究
程浩洋,李长辉
1 辽宁中医药大学 辽宁沈阳 110000
2 辽宁中医药大学附属第一医院 辽宁沈阳 110000
随着新世纪的到来,我国居民的饮食结构和生活方式随着时代的发展而改变,繁忙的生活带来焦虑情绪和不规律的饮食,今年来流行的高油脂、高热量饮食所导致的肥胖严重威胁着我们的健康。根据《中国成人超重和肥胖症预防控制指南》中的诊断标准,我们认为BMI在 25.0到29.9之间为超重,BMI≥30即为肥胖[1]。2005年全国肥胖调查发现,男性肥胖率23%,女性肥胖率22.7%,男性超重率6.6%,女性超重率7.6%,城市肥胖率和超重率均高于农村[2]。郭春雷的研究显示,我国儿童超重率逐年显著提升,截至2014年已达7.3%[3]。基于1997-1998年12地区老年肥胖人口调查推测,我国老年群体男性超重率为32.92%,女性超重率为34.84%[4]。由此可见我国肥胖与超重在各个年龄段各个区域都有较高的发病率,肥胖作为多种疾病如高血压、2型糖尿病、冠心病、睡眠呼吸暂停等的高危因素,大大威胁现代居民的健康,寻求干预肥胖进展的手段已迫在眉睫。我国中医药对肥胖的认识已有千年之久,早在《黄帝内经》中对肥胖类型的认识即有脂人、膏人、肉人之别,李东垣的《脾胃论》中有“脾胃俱旺,能食而肥;脾胃俱虚,则不能食而瘦”,指出患者常由于食欲旺盛为最初原因引起肥胖,随着病情的演进,诸如痰浊、湿热、血瘀等病理产物的出现,肥胖的治疗手段也根据具体证型而调整。其中黄连-黄芩以苦寒燥湿泻热为主要功效,是湿热内蕴证型肥胖的常用药对,首见于《伤寒杂病论》中协热下利之葛根芩连汤证。现代对其药理学研究与观察从未中断,其中段阳泉所做的临床疗效观察显示,以二陈汤为基础方,针对湿热证型加黄连、黄芩、泽泻等,经3个月的治疗,患者体重下降15公斤[5]。现代药理学研究认为,黄连调节肠道菌群结构,促进有益菌群的增多,减少有害菌,以减轻慢性炎症反应,有着防治肥胖和延缓糖尿病并发症的积极疗效[6]。陈美珍[7]通过动物实验研究表明,黄芩素改善胰岛素抵抗,其机制可能是抑制TNF-α、IL-1β、IL-6等炎症因子表达,减轻炎症反应,黄芩苷能够促进NF-K B活化来减少炎症因子释放以减轻肥胖导致ASP时的肝损伤,其机制仍需进一步研究[8]。黄连碱对饮食诱导肥胖小鼠的体重有一定的控制作用,其机制是抑制LPS/TLR-4通路,缓解肝脏炎症反应,减少脂质在脂肪细胞中的合成与积累[9]。黄连素能够减轻氧化应激,降低PAH1的表达降低细胞内甘油三酯水平[10]。由此可见黄连-黄芩药对治疗肥胖及其并发症的全面性,但许多机制尚有许多不明之处。本研究欲以网络药理学的方式探究本药对治疗肥胖的基因位点和作用通路,以从系统性视角分析其作用机理。
资料与方法
1 相关数据库及工具
药 物 数 据 库 TCMSP:https://tcmspw.com,Pubchem:https://pubchem.ncbi.nlm.nih.gov/,Uniprot:https://www.uniprot.org/。 疾 病 数 据 库 Genecards:https://www.genecards.org/。
交 集 工 具 Venny2.1.0:https://bioinfogp.cnb.csic.es/。PPI网络绘制工具 STRING:https://stringdb.org/。GO,KEGG 富 集 工 具 Metascape:https://www.plob.org/tag/metascape。图表绘制微生信:http://www.bioinformatics.com.cn/。可视化分析软件Cytoscape3.8.0。
2 药物靶点筛选标准
在中医药数据库TCMSP中查找黄连-黄芩药对,根据 Lipinski 的 5 规则,即分子量 <500、-2< 脂水分配系数 < 5、氢键供体数(Hdon)< 5、氢键受体数(Hacc)< 10、旋 转 键数(RBN)< 10 和 ADME(absorption, distribution,metabolism,excretion) 特性,设置类药性(DL)≥0.18 和口服生物利用度(OB)≥30%筛选出活性较高的化合物。(来自《中国实验方剂学杂志》)并获取化合物的相应靶点MOLID及相应数据,并在Uniprot网站转换为基因名,剔除无效、重复靶点,建立药物靶点基因集。
3 收集肥胖相关基因位点
获取疾病靶点。使用Genecards数据库,输入“Obesity”,得到数据库收录的肥胖相关靶基因。搜集肥胖的疾病相关靶点,记录基因名(gene symbol),并建立肥胖基因集。
4 建立化合物-靶点-疾病网络
4.1 寻找交集基因 将药物靶点基因与疾病基因集导入Venny2.1.0绘制交集图,记录交集基因以建立交集基因集。
4.2 化合物-靶点-疾病网络映射 编辑交集基因,明确其中药-化合物-靶点-疾病关系,编写network、type文件,将其导入Cytoscape3.8.0,进行可视化分析,并进行美观改良,获得“化合物-靶点-疾病”网络图。
4.3 交集靶点的PPI网络建设 将交集基因的基因名(gene symbol)导入STRING网站进行分析,获取PPI网络图及tsv文件,将tsv文件导入Cytoscape3.8.0进一步分析改良以便于可视化图表展示。
4.4 GO富集与KEGG富集分析 将交集基因导入Metascape数据库,并选取智人基因(homo sapiens)选项,进行基因本体(gene ontology,GO)功能富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,其中,GO 功能富集分析的 BP 为生物学过程、CC 为细胞组成、MF 为分子功能。并以表格文件保留富集分析结果。使用微生信绘制图表,GO富集中的GOterm、Subgroup、Enrichment sroce,绘制柱状图。KEGG富集分析中的 Pathway、Pvalue、Enrichment、count导入微生信,绘制气泡图。
结 果
1 黄连-黄芩药对成分分析
黄连化合物成分计12种,黄芩化合物成分计30种,二者共有成分共2种为coptisine(黄连碱)与epiberberine(表小檗碱),黄连共计227个不重复药物靶点,黄芩共计196个不重复药物靶点,二者重叠靶点共13个。
2 疾病基因靶点汇总与药物疾病靶点交集
肥胖基因靶点9513个,占总基因的99.6%,只与黄连交集靶点89个,占比0.9%,只与黄芩交集靶点37个,占比0.4%,与黄连黄芩共同交集70个,占比0.7%,见图 1。
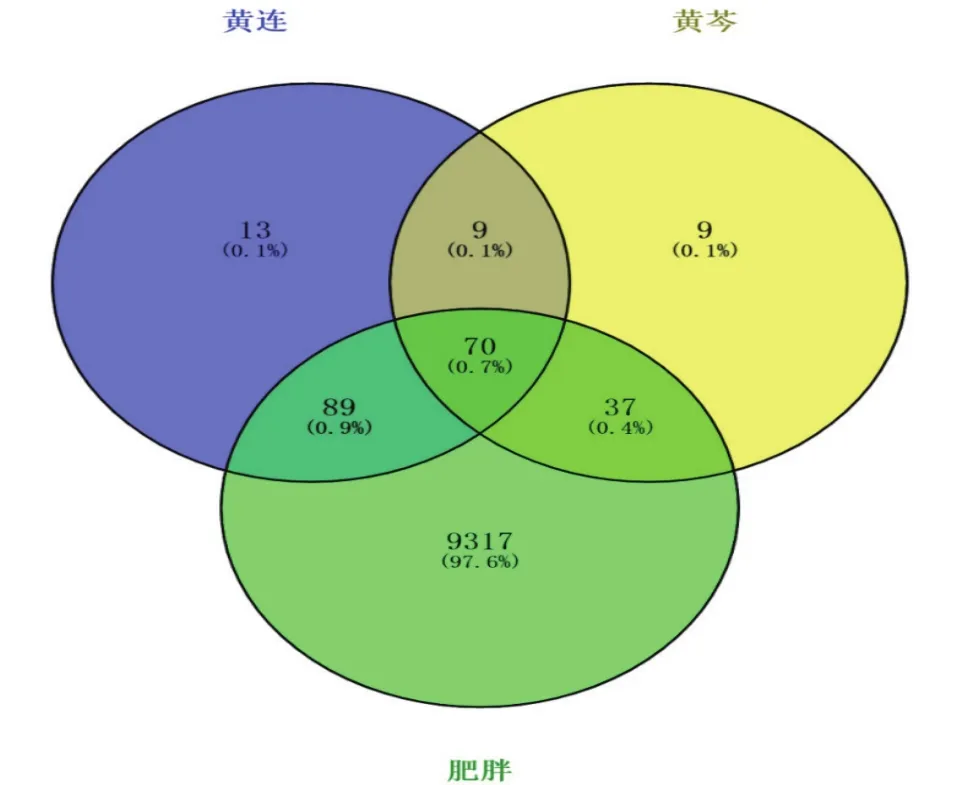
图1 黄连-黄芩药对作用靶点与肥胖基因位点Venny图
3 化合物-靶点-疾病网络
利用STRING对213个交集基因进行分子互相作用,得到3466个连结边数并绘制分子互相作用网络图,将PPI互质网络图导入cytoscape3.8.0进行可视化分析,并绘制核心靶点PPI互质网络图,取大于2倍degree值的中位数为核心靶点,共计39个核心靶点 MAPK1、JUN、PRKCA、RELA、MYC、TP53、PRKACA、EGFR、TNF、AKT1、MAPK14、FOS、ESR1、CAV1、TGFB1、STAT1、PRKCB、IFNG、PRKCD、CXCL8、GSK3B、FN1、AR、VEGFA、EGF、RB1、IL1B、IL6、CDKN1A、BCL2、PPARG、CCND1、ERBB2、CASP3、IL2、HSPB1、HSPA5、HIF1A、E2F1。见图 2-4,表1-2。

图2 化合物-靶点-疾病网络

图4 核心靶点PPI分子互相作用网络
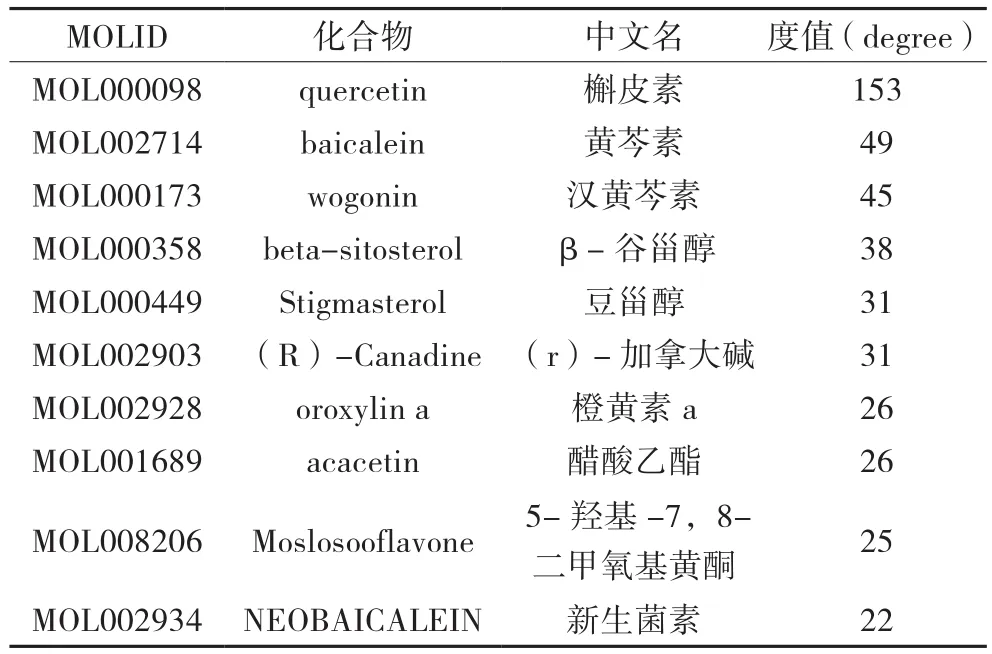
表1 度值前10化合物

表2 度值前10基因靶点
4 GO富集分析与KEGG富集分析结果展示
黄连-黄芩药对治疗肥胖所涉及的生物过程有:有毒物质反应、受伤反应、活性氧代谢过程、脂多糖反应、凋亡信号通路、对氧气水平反应等。涉及的细胞成分:膜筏、突触后膜、受体复合物、囊泡内腔、枝晶膜等。涉及的分子功能:转录因子结合、蛋白结构域特异性结合、蛋白激酶结合、核受体活性、神经递质受体活性、蛋白质均二质活性等。癌症的途径、糖尿病并发症中的AGE-RAGE信号通路、乙型肝炎、蛋白聚糖在癌症中、IL-17信号通路、HIF-1信号通路、铂金抗药性、阿米巴病、血清素能突触、甲状腺激素信号通路是治疗肥胖的主要作用通路,见图5-7。
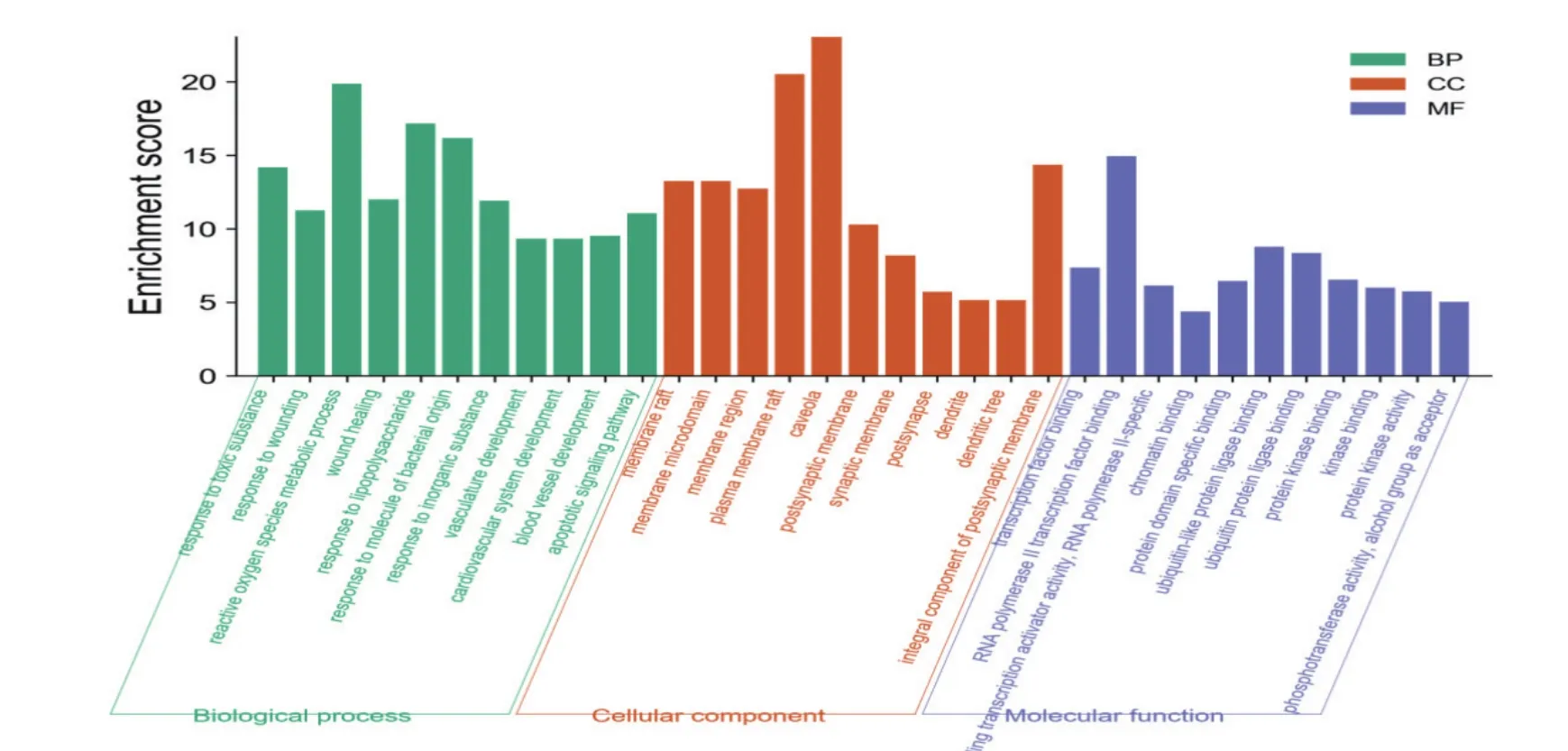
图5 GO富集分析
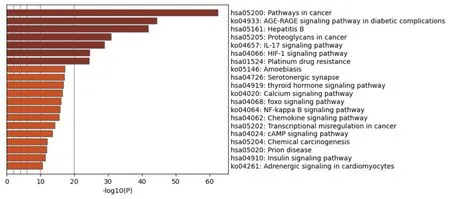
图6 KEGG分析通路可信度排行

图7 KEGG分析气泡
讨 论
根据本次网络药理学KEGG富集分析结果所得通路,将“化合物-疾病-靶点”网络图所得度值前十名基因位点进行对应,发现HIF-1信号通路、IL-17信号通路、血清素能突信号通路极有可能是黄芩-黄连药对治疗肥胖的作用途径。
低氧诱导因子具有广泛的生物效应,有实验研究表明,当受试小鼠HIF-1通路受抑制时下丘脑炎症反应增加,降低其葡萄糖摄取能力和基础代谢率,使体重增加[11]。高糖水平下食欲控制神经元中HIF-1的表达增加,抑制葡萄糖的摄取,使食欲减退[12]。脂肪形成和高胰岛素血症均能促进HIF-1αmRNA的表达,加重慢性炎症反应使肥胖加剧[13]。HIF-1信号通路中的HIF-1α与葡萄糖依赖性促胰岛素多肽受体(GIPR)的表达正相关,GIPR在脂肪细胞中大量增殖产生IL-6等炎症因子,破坏脂肪细胞的胰岛素敏感性[14]。诸多研究表明,HIF-1信号通路对肥胖的调控是双向的,更具体的作用机制仍需要进一步研究。
IL-17能从基因调控的方面影响肥胖,通过调控炎症基因如 TNF- α,IL-6,IL- β,COX-2,IL-17RA,IL-17RC,CXCL1等在脂肪组织中的表达以影响代谢[15],例如其中NF-α,IL-6和IL-1β能阻碍胰岛素信号通路的表达[16]。IL-17抑制小鼠3T3-L1前脂肪细胞的转录因子以及脂质、葡萄糖代谢相关基因的表达以抑制向脂肪细胞的分化,对于已分化的脂肪细胞,IL-17能减少其摄取葡萄糖[17]。实验研究,IL-17基因敲除小鼠脂肪细胞分化减少,脂肪细胞中促脂肪形成转录因子和脂肪因子的mRNA表达受抑制,改善了饮食引起的肥胖、脂肪肝、葡萄糖和脂质代谢。其机制可能是当IL-17缺乏时,脾脏和肝脏中的TBK1和IKBKE的表达降低,以改善代谢功能障碍[18]。Chong Chen[19]的研究表明,血清胰岛素,胰岛素样生长因子1(IGF1)和白介素17(IL-17)之间有一个共有的基因位点GSK3,使二者常发生串扰,将GSK3基因敲除即可阻断串扰,可改善胰岛素代谢。
血清素能突触(Serotonergic synapse)又名5-羟色胺能突触,5-羟色胺(5-HT)在人体内作用于不同组织的受体产生多种多样的作用,近年来发现其对减重治疗存在巨大的的研究价值。针对肥胖患者而言,5-HT能够激活胃肠道平滑肌5-HT2受体或肠壁内神经节细胞5-HT4受体均可以引起胃肠道平滑肌收缩,使胃肠道张力增加[20]。目前临床上已有使用5-HT的主要受体5-HT2CR的激动剂改善肥胖和血糖控制[21]。其能够在孤立脑干核中选择性激活,以抑制食欲,减少饮食[22]。使用5-HT2CR突变小鼠的实验研究显示,突变体在中年时期表现出较多食物摄取和肥胖症候群的倾向。对高脂喂养更敏感,更易发生肥胖和2型糖尿病[23]。
由此推论可得出,涉及以上三个通路的高频核心靶点为 PTGS2、NOS2、PRKACA、PTGS1,涉及此四个靶点三个及以上的核心化合物有黄芩素(4)、汉黄芩素(3)、槲皮素(3)、(r)- 加拿大碱(3)、橙黄素 a(3)、醋酸乙酯(3)、5- 羟基 -7,8- 二甲氧基黄酮(3),可推测以上化合物可能是黄连-黄芩药对治疗肥胖的主要活性成分。由此推论HIF-1信号通路参与活性氧代谢过程和对氧气水平反应恢复胰岛素敏感性,利用IL-17信号通路影响脂肪的转录因子减少前脂肪细胞转化为脂肪细胞,以及干预血清素能突触通路中的神经递质与受体结合以抑制食欲,以上三种模式来达到减肥疗效。本文以应用网络药理学系统性探究黄连-黄芩药对治疗肥胖的作用机制为主旨研究得出以上结论,希望能为其进一步实验研究提供理论基础,为探寻其他中药组方治疗肥胖提供新思路。

