甜菜M14品系BvM14-UNG基因克隆及生物信息学分析
王盛昊,于 冰
(1黑龙江大学农业微生物技术教育部工程研究中心,哈尔滨 150500;2黑龙江大学生命科学学院/黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080)
0 引言
尿嘧啶出现在DNA中是由dUTP的错误引入或者胞嘧啶的自发脱氨导致的[1]。在生物体中,尿嘧啶错误引入会导致U:A错配,具有细胞毒性[2],而去氨基胞嘧啶会产生U:G错配,如果在复制前不修复,会导致C:G到T:A转换突变[3]。为应对产生尿嘧啶这类DNA损伤,细胞形成了多种DNA修复机制。一种途径是细胞通过脱氧尿嘧啶核苷三磷酸水解酶(dUTPase)将dUTP水解为dUMP降低dUTP的含量,从而减少尿嘧啶的错误掺入[4]。另一种更为重要的途径是细胞通过碱基切除修复(base-excision repair,BER)有效去除错误掺入和自发脱氨的尿嘧啶。尿嘧啶DNA糖基化酶(uracil DNA glycosylase,UDG)负责切除尿嘧啶,该酶活性能够裂解N-糖苷键,将尿嘧啶作为游离碱基去除,在DNA中产生一个无碱基的(apurinic apyrimidinic site,AP)位点[5]。修复是通过随后的步骤完成的,包括在AP部位切开、产生缺口、修复合成缺口和连接磷酸二酯键[6]。
1974年Lindahl课题组[7]首次从大肠杆菌提取物中检测到UDG酶活性。此后,在真核、原核等生物中均发现了UDG并进行了原核表达[8-10]。DNA糖基化酶根据特征基序可以分为UDG超家族和螺旋-发夹-螺旋-GPD糖基化酶(Helix-Hairpin-Helix-GPD glycosylases,HHH-GPD)超家族,HHH-GPD超家族具有标志性的螺旋-发夹-螺旋和甘氨酸/脯氨酸(Gly,G/Pro,P)富含环,其后是一个保守的天冬氨酸(Asp,D)。UDG超家族根据保守的基序和结构相似性又可以分为UDG-F1、UDG-F2、UDG-F3、UDG-F4和UDG-F5共5个亚家族。UDG-F1以大肠杆菌UNG(uracil N-glycosylase)酶和人类UNG酶为代表,一般UDG-F1亚家族蛋白也被称为UNG,主要切除由胞嘧啶自发脱氨形成的尿嘧啶并在dsDNA和ssDNA上都有活性[11-12]。UNG与底物结合发生在一个“口袋”中,其可以提供尿嘧啶的形状和静电作用,并且这个“口袋”不能容纳嘌呤。对蛋白进行结晶结构分析后发现,尿嘧啶的结合需要“核苷酸旋转”后才能实现,位于口袋正上方保守亮氨酸(Leu)可以帮助实现这一过程[11]。UNG包括3个保守的基序,第1个是水激活基序(在人类UNG中为GQDPYH),其可以和催化中心的水分子配位。其在UDG-F1和UDG-F2中高度相似,但是UDG-F1中的D(天冬氨酸)在UDG-F2中为N(天冬酰胺),这是区分UDG-F1和UDG-F2的标志。第2个是尿嘧啶结合基序(GVLLLN),该基序在UNG家族中保守,通过与尿嘧啶环上的极性分子形成氢键识别尿嘧啶[13]。第3个基序是小沟插入环基序(HPSPLS),它在驱动尿嘧啶进入口袋的过程具有重要作用,其组氨酸(H)和第一个脯氨酸(P)具有高度的保守型。UDG-F2以大肠杆菌MUG和人类TDG为代表,与UDG-F1不同的是UDGF2的主要作用之一是去除错误掺入的dUMP残基并对dsDNA具有依赖性[14]。UDG-F3以脊椎动物的SMUG1代表,相较UDG-F1和UDG-F2其不仅可以修复尿嘧啶还可修复5-羟甲基尿嘧啶(5-HMU)、3,N4-乙烯胞嘧啶(ɛC)和5-氟尿嘧啶(5-FU)引起的突变,并对dsDNA和ssDNA都有活性。人们还在嗜热菌和古菌中鉴定出UDG-F4和UDG-F5[15]。
与细菌、酵母和哺乳动物中的UDG相关研究相比,对植物中尿嘧啶切除修复的了解仍然非常有限。已经从胡萝卜、小麦、洋葱和玉米等植物的离体组织中初步提取了含有UDG的活性物质并检测了UDG活性[3,6,16-17]。Dolores等[3]克隆获得了拟南芥(Arabidopsis thaliana)AtUNG基因,进行生物信息学分析发现其属于UDG-F1,将其在大肠杆菌中异源表达并纯化得到AtUNG蛋白,检测活性发现其具有UDG酶活性,对dsDNA、ssDNA均有活性,并表现出对ssDNA更好的偏好性。
甜菜M14品系是郭德栋[18]利用二倍体栽培甜菜(Beta vulgaris)与四倍体野生白花甜菜(Beta corolliflora)杂交及回交获得的甜菜单体附加系,含有1条附加的野生白花甜菜第9号染色单体[19],具有耐盐、无融合生殖等特性,是克隆抗逆基因和其他优质基因的特殊种质资源。实验室前期对甜菜M14品系的Bv-MDHAR、BvM14-glyoxalase I、BvM14-cystatin等多个基因进行了耐盐基因功能研究[20-23]。
生物都具有DNA修复系统[24],为提高对于各种逆境胁迫的耐受性以保证生存[25],植物进化出了多种特殊机制来应对环境变化,一种DNA修复酶通常具有多种不同功能[26],或同一功能可由多种不同的DNA修复酶执行。甜菜M14品系是具有耐盐、无融合生殖等优良特性的植物材料,因此是挖掘和利用DNA修复酶的优质种质资源。Bv-UNG在甜菜M14中的功能尚未明确,本研究对甜菜M14品系Bv-UNG基因进行克隆和生物信息学分析,旨在为进一步探究Bv-UNG蛋白活性以及在BER途径的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 以甜菜M14品系(专利号CN1263695A)作为植物材料,种植于植物培养室。
1.1.2 主要试剂和引物 pMD18-T Vector Kit、Agarose Gel DNA Purification Kit、Ex Taq、DNA Marker、感受态细胞DH5α RNAPCR Kit(AMV)Ver.3.0试剂盒均购于TaRaKa公司。根据NCBI二倍体甜菜DNA序列设计引物,实验订购的引物(表1)均由上海生工负责合成。

表1 实验所需引物
1.2 方法
1.2.1 总RNA提取 利用TRIzol试剂提取甜菜M14品系根部总RNA。检测总RNA样品的A260/A280及RNA的完整性。
1.2.2 cDNA第一链的合成 参照赵冬美[21]的方法进行甜菜M14品系cDNA第一链的合成。反转录的实验条件为30℃ 10 min、42℃ 30 min、99℃ 5 min、5℃ 5 min。
1.2.3 BvM14-UNG基因cDNA的获得 使用Primer Premier 5.0软件分别设计BvM14-UNG基因的上游和下游的特异性引物BvM14-UNG-S、BvM14-UNGAS。以BvM14 cDNA为模板,进行PCR扩增及琼脂糖凝胶电泳检测。
1.2.4 BvM14-UNG基因生物信息学分析 利用NCBI网站中的ORF Finder程序、CDD、Blast程序分别进行开放阅读框分析、保守结构域分析、BvM14-UNG基因进行同源序列搜索;利用Expasy网站、ProParam软件对亲/疏水性和蛋白质的理化性质进行分析;利用SMART软件进行结构域的预测;利用SOPMA软件、Swiss-model数据库进行蛋白质二级结构和三级结构模型预测;利用DNAMAN、MEGA 5软件进行蛋白多重序列比对和系统进化树构建。
2 结果与分析
2.1 BvM14-UNG基因的克隆
2.1.1 总RNA的提取 利用TRIzol提取甜菜M14品系叶和根部的总RNA,A260/A280分别为1.95、1.96,浓度为1.92、1.93 μg/μL。电泳检测结果如图1,电泳结果表明提取的RNA纯度较高。

图1 盐胁迫下甜菜M14品系根总RNA的1%琼脂糖凝胶电泳图
2.1.2 BvM14-UNG基因cDNA全长的获得 以cDNA第一链为模板,利用BvM14-UNG-S和BvM14-UNGAS进行PCR,产物电泳检测结果如图2所示。BvM14-UNG基因PCR扩增条带大小在1000 bp和2000 bp之间,测序结果正确。
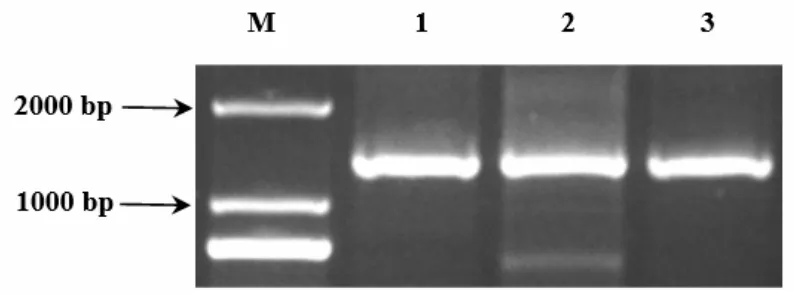
图2 BvM14-UNG基因cDNA全长PCR扩增产物的1%琼脂糖凝胶电泳图
2.2 BvM14-UNG基因的生物信息学分析
2.2.1 BvM14-UNG基因的ORF分析 经过分析,cDNA序列全长为1124 bp(包括终止密码子),编码374个氨基酸。如图3中黑色方框和红色方框为起始密码子和终止密码子。

图3 BvM14-UNG基因cDNA全长开放阅读框分析
2.2.2 BvM14-UNG蛋白的理化性质分析 预测BvM14-UNG蛋白分子式为C1866H2940N520O547S11,等电点(pI)为9.19,分子量为41763.69 Da。
BvM14-UNG蛋白/亲疏水性分析如图4所示。最高分值(疏水性最强)出现在第270位为2.133,最低分值(亲水性最强)出现在第66位为-2.989,亲水性氨基酸占比较多。
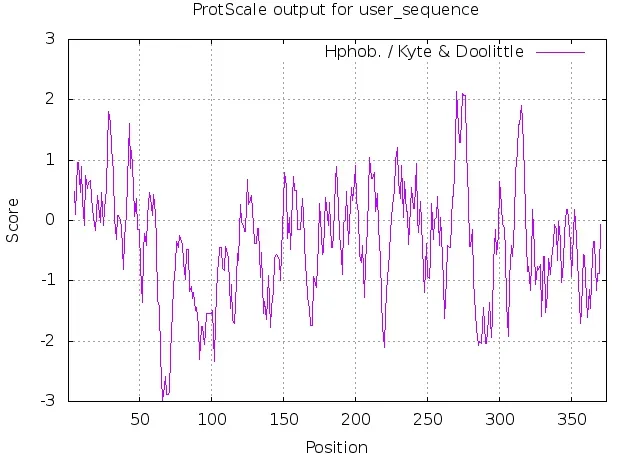
图4 BvM14-UNG蛋白亲/疏水性预测结果
2.2.3 BvM14-UNG蛋白的二级结构与三级结构预测分析 BvM14-UDG蛋白二级结构预测分析结果如图5所示。BvM14-UNG蛋白中无规卷曲(黄色c)占比41.18%,α螺旋(蓝色h)占比为30.21%,延伸链(红色e)占比21.39%,β转角(绿色t)占比7.22%。该蛋白主要由无规卷曲和α螺旋构成。
BvM14-UNG蛋白三级结构预测结果如图6所示。BvM14-UNG蛋白水激活基序(Motif Ⅰ)能够形成类似于“口袋”结构(图6红色部分),尿嘧啶结合基序(Motif Ⅱ)与“口袋”紧邻。尿苷酸进入口袋后不能直接和Motif Ⅱ(图6绿色部分)结合,需要借助与Motif Ⅱ位置相对的Leu位点(图6黑色部分),使尿苷酸翻转才可以与Motif Ⅱ结合。
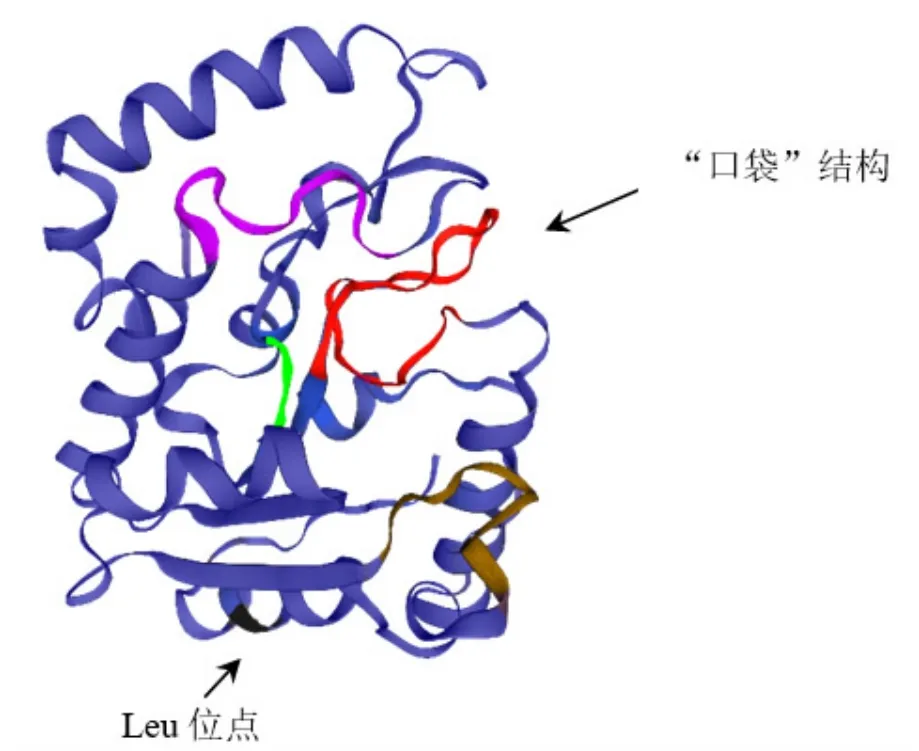
图6 BvM14-UNG蛋白的三级结构预测结果
2.2.4 BvM14-UNG蛋白保守结构域分析 蛋白保守结构域分析如图7所示,BvM14-UNG蛋白具有水激活基序(Motif Ⅰ)、尿嘧啶结合基序(Motif Ⅱ)、小沟插入环基序(Motif Ⅲ)、UGI结合位点和Leu位点,具有UDG家族保守结构域。

图7 BvM14-UNG保守结构域分析
2.2.5 BvM14-UNG蛋白同源序列比对 采用NCBI网站在线Blastp工具对BvM14-UNG蛋白与甜菜(Beta vulgaris)、拟南芥(Arabidopsis thaliana)、藜麦(Chenopodium quinoa)、河岸葡萄(Vitis riparia)、葡萄(Vitis vinifera)、菠菜 (Spinacia oleracea)、雷公藤(Tripterygium wilfordii)、陆地棉(Gossypium hirsutum)、木薯(Manihot esculenta)、可可(Theobroma cacao)、乌木海葵 (Herrania umbratica)、碧桃 (Prunus persica)、梅(Prunus mume)、欧洲甜樱桃(Prunus avium)、扁桃(Prunus dulcis)、荷花(Nelumbo nucifera)、吉野樱变种(Prunus yedoensis var.nudiflora)、黄薯蓣亚种(Dioscorea cayenensis subsp.rotundata)物种的UNG蛋白进行检索,利用DNAMAN软件进行多重序列比对,如图8所示,BvM14-UNG蛋白具有水激活基序(Motif Ⅰ)、尿嘧啶结合基序(Motif Ⅱ)、小沟插入环基序(Motif Ⅲ)、UGI结合位点和Leu位点,并且在BvM14-UNG水激活基序(Motif Ⅰ)中为天冬氨酸(D),而非天冬酰胺(N),符合UDG-F1的序列特点,因此确定BvM14-UNG蛋白属于UDG-F1家族。多重序列比对结果表明,BvM14-UNG蛋白序列与甜菜的BvUNG氨基酸序列相似度高达98%,其次为藜麦CqUNG,相似性高达80.05%。利用MEGA5构建系统进化树分析如图9,表明BvM14-UNG与甜菜BvUNG亲缘性最近,其次为藜麦。

图8 BvM14-UNG蛋白多重序列比对结果
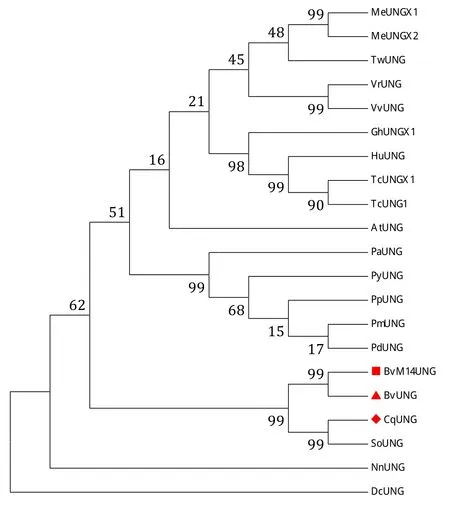
图9 BvM14-UNG蛋白系统进化树分析
3 结论与讨论
UNG是UDG超家族中重要的亚家族,UNG是尿嘧啶BER途径中的第1个酶。UNG在人及其他动物中研究比较深入,但是在植物中的研究相对较少。Bones等[17]检出了玉米、烟草、油菜、萝卜、土豆等高等植物中UNG的酶部分活性,并未对UNG活性进行深入系统的研究。
笔者从甜菜M14品系中克隆获得BvM14-UNG基因的cDNA全长序列。生物信息学分析表明,该基因编码374个氨基酸,pI为9.19,分子量为41763.69 Da;BvM14-UNG蛋白表现出较强的亲水性,可能为可溶性蛋白;BvM14-UNG蛋白主要由无规卷曲和α螺旋构成;对BvM14-UNG蛋白进行保守结构域分析,表明其具有水激活基序、尿嘧啶结合基序、小沟插入环基序、UGI结合位点和Leu位点,具有UDG-F1的结构特点,属于UDG-F1;同源序列比对以及构建系统进化树分析表明,BvM14-UNG蛋白与甜菜BvUDG蛋白亲缘性最近。
本研究仅是从生物信息学方面探究了BvM14-UNG结构和功能,但是BvM14-UNG蛋白的针对尿嘧啶以及尿嘧啶类似物产生的突变的修复活性有待证实,BvM14-UNG蛋白是否具有与拟南芥相同的对单链更好依赖性也需要更多实验证明。本研究可为后续开展甜菜M14品系BER途径中BvM14-UNG酶活性研究提供参考。

