鸭呼肠孤病毒TaqMan与SYBR Green荧光定量检测方法的建立及比较
陆 婧,李 敏,王 艳,朱盈名, 赵自亮, 邓欣竹, 刘 霞, 张立武, 程方俊*, 赵光伟* (.西南大学 动物医学免疫研究中心,重庆060;.上海海关,上海 005;.贵州省动物疫病预防控制中心,贵州 贵阳 550008;.重庆三捷众新生物工程有限公司,重庆060)
新型鸭呼肠孤病毒病是由新型鸭呼肠孤病毒(novel duck orthoreovirus,NDRV)引起的一种急性传染病,该病可发生于雏番鸭、雏半番鸭、樱桃谷北京鸭及其他品种雏鸭[1-3],多发于7~35日龄鸭。感染鸭出现精神沉郁、腹泻、死亡鸭喙呈紫黑色等症状[4]。剖检发病鸭常见肝脏明显肿大,脾脏坏死[5]。该病在我国南方水禽饲养区广泛流行,疫区有逐年扩大的趋势,给我国水禽养殖业造成严重的经济损失[6]。
NDRV属于呼肠孤病毒科正呼肠孤病毒属,为分节段的双股RNA病毒,含有10个RNA片段:Ll、L2、L3、M1、M2、M3、S1、S2、S3、S4[7-9]。其中S1基因的第3个ORF为σC基因,该基因编码σC蛋白,σC蛋白为NDRV结合细胞受体的主要位点,对病毒的吸附、增殖与合胞体的形成起重要作用[10]。而MDRV的σC是由S4基因编码,且NDRV的S3基因与MDRV和ARV的分子特征具有很大的区别,故可以根据S1的差异对病原进行分类[11-12]。通过对本试验毒株DRV-SL株(GenBank登录号为MW196679-MW196688)测序和比对发现,该毒株与GenBank中已公布NDRV流行毒株亲源性较近,但各片段所编码的氨基酸序列均存在不同的差异,同源性为99.63%~94.37%,其中属S1片段的变异性最大,同源性为94.37%~98.64%,推断该毒株是鸭呼肠孤病毒(duck orthoreovirus,DRV)变异株的一种。
目前该病的诊断方法有中和试验、琼扩试验、RT-PCR等。但这些方法耗时久、准确性低、且操作复杂,不适用于该病的快速诊断[13-14]。最常用的NDRV荧光定量检测方法是TaqMan和SYBR Green法[15]。由于对NDRV致病机制的研究尚少[16],目前各地建立的NDRV荧光定量检测方法对于其他地区出现的变异株具有不可靠性[17]。为此,本试验根据GenBank数据库中公布的DRV-SL株S1基因全序列,设计合成1对特异性引物和1条MGB探针,建立检测NDRV的TaqMan探针和SYBR GreenⅠ荧光定量检测方法,并对比两种方法在准确性、特异性、重复性、灵敏性等方面存在特点,最终确定适用临床快速检测NDRV方法。
1 材料与方法
1.1 毒株新型鸭呼肠孤病毒(novel duck reovirus SL,DRV-SL)由本实验室从发病鸭的肝脏、脾脏等组织分离获得(GenBank登录号为MW196679-MW196688);番鸭细小病毒(DPV)、A 型鸭甲肝病毒( DHV-1)、C型鸭甲肝病毒( DHV-3)、鸭传染性支气管炎(IBV)、鸭坦布苏病毒(DTMUV)、鹅星状病毒(JSHV)毒株为本实验室保存。
1.2 主要试剂病毒核酸提取试剂盒购自北京全式金生物科技有限公司;反转录试剂盒、TB Green®Premix Ex TaqTMⅡ、Probe qPCR Mix、DNA Marker购自TaKaRa公司;SanPrep柱式质粒DNA小量抽提试剂盒购自生工生物工程(上海)股份有限公司;pBLUE -T载体、DH5α感受态细胞购自北京庄盟国际生物基因科技有限公司。
1.3 引物和探针的设计与合成参照S1基因全序列,设计合成1对引物,上游引物F1:5′-TGAGACGCCTGACTACGATT-3′;下游引物R1:5′-ATGCTTGGAGTGAGACGACT-3′。预计扩增片段为380 bp。根据GenBank已发布的DRVS1基因序列(GenBank登录号:MW196682),利用NCBI的Primer引物设计功能和BLAST检索工具,设计合成1对特异性荧光引物和1条MGB探针,上游引物P1:5′-TTGTAGGTGCAAGGGAGCTT-3′,下游引物P2:5′-GCAGACGTCCACTCTAACGA-3′;MGB探针:FAM-TCGGCGCACCACCCGA-TCGT-MGB,该探针5′端标记的荧光报告基团为FAM,3′端标记的荧光淬灭基团为MGB。荧光引物预扩增片段为139 bp,所有引物和探针均由华大基因科技有限公司合成。
1.4 阳性标准品的制备按照病毒核酸提取试剂盒操作说明提取总RNA,反转录为cDNA,以cDNA为模板,F1和F2为引物,反应体系:rTaq Mix 12.5 μL,无菌ddH2O 8.5 μL,上、下游引物各1 μL,cDNA 2 μL。反应条件:94℃预变性5 min;94℃ 40 s,55℃ 40 s,72℃ 45 s,共33个循环;72℃延伸10 min,4℃保存。扩增获得特异性目的条带,经DNA凝胶回收试剂盒切胶回收后,将目的片段克隆至pBLUE-T载体中,转化入大肠杆菌DH5α细胞,接入含氨苄青霉素的 LB 液体培养基中,37℃培养12 h,用质粒提取试剂盒提取重组质粒,送华大基因科技有限公司测序。经 PCR和测序鉴定无误后,通过NanoDrop2000分光光度计测定质粒的DNA浓度,并按照以下公式换算为拷贝数,拷贝数=阿伏伽德罗常数×浓度×10-9/(片段大小×660),获得阳性质粒的拷贝数为 1.89×1010拷贝/μL,-80℃保存备用。
1.5 荧光定量PCR反应程序及体系优化以制备的阳性标准品为模板,采用20 μL反应体系。通过矩阵法对TaqMan探针法的探针和引物浓度进行优化,同样对SYBR GreenⅠ法的引物浓度进行优化,以获得最佳反应体系。通过设置不同的退火温度,根据反应扩增曲线最小Ct值和最高荧光值为标准,确定最佳退火温度,最终获得最佳反应体系和最佳反应条件。反应条件:TaqMan法:95℃ 3 min;95℃ 10 s,55~60℃ 20 s,共40个循环。SYBR Green Ⅰ法:95℃ 30 s;95℃ 5 s,55~60℃ 20 s,共40 个循环。
1.6 标准曲线的建立将制备的阳性质粒标准品按10倍倍比稀释,获得1×109~1×103拷贝/μL系列标准模板,利用1.5中优化好的条件进行TaqMan和SYBR GreenⅠ实时荧光定量PCR扩增,以起始模板量拷贝数的对数作为横坐标,Ct 值作为纵坐标绘制标准曲线。
1.7 敏感性试验将制备的阳性质粒标准品按10倍极限稀释后,取1×109~1×10-2拷贝/μL标准品作为模板,同时设置无菌ddH2O为阴性对照,利用1.5中优化好的条件分别进行TaqMan和SYBR GreenⅠ实时荧光定量PCR扩增,获得两种检测方法的最低检测限度,比较两种方法的灵敏度。
1.8 特异性试验按照1.5中建立的优化反应体系,分别以DPV、DHV-1、DHV-3、IBV、DTMUV、JSHV核酸作为模板,以稀释后为1×106拷贝/μL NDRV阳性质粒标准品作为阳性对照,以无菌ddH2O为阴性对照,以1.5中建立的最优反应条件分别进行TaqMan和SYBR GreenⅠ实时荧光定量PCR扩增,检测并比较两种方法的特异性。
1.9 重复性试验取上述稀释质粒(109~105拷贝/μL) 共5个浓度的质粒作为模板,用1.5中已优化的反应条件进行组间和组内的TaqMan和SYBR GreenⅠ实时荧光定量PCR扩增,每个浓度设置3个重复。根据计算出Ct 值平均值、标准差以及变异系数(CV),从而比较两种实时荧光定量PCR方法的重复性及稳定性。
1.10 临床样品的检测利用已建立的两种qRT-PCR检测方法,分别对本实验收集的30份疑似NDRV的病料(肝脏和脾脏)进行检测,比较两种方法的符合率。
2 结果
2.1 引物的特异性及阳性标准品的制备以cDNA为模板,分别用F1,F2和P1、P2这2对引物进行PCR的扩增,得到大小约380,139 bp的2条目的片段,与预期片段大小相符(图1)。通过测序验证,确定为DRV。构建的阳性重组质粒标准品质量浓度为69.62 mg/L,经转化拷贝数为1.89×1010拷贝/μL。

M.DL5000 DNA Marker;1.荧光引物;2.RT-PCR引物
2.2 反应程序及体系的优化通过改变反应体系中引物和探针浓度、退火温度,确定最终的反应体系和反应程序。TaqMan法:Probe qPCR Mix(2×)10.0 μL,MGB探针0.2 μL,上、下游引物(P1,P2)各0.8 μL,模板DNA 1.0 μL,ddH2O 7.2 μL,共20 μL体系。反应程序:95℃ 3 min;95℃ 10 s,60℃ 20 s。SYBR Green Ⅰ 法:TB Green Premix Ex Taq Ⅱ(2×)10 μL,上、下游引物(P1,P2)各0.8 μL,模板DNA 2.0 μL,ddH2O 6.4 μL,共20 μL。反应程序:95℃ 30 s;95℃ 5 s,60℃ 20 s,共40 个循环。
2.3 标准曲线的建立用1.89×109~1.89×103拷贝/μL系列重组质粒作为模板,分别进行TaqMan和SYBR GreenⅠ荧光定量PCR扩增,得到扩增动力学曲线,以起始拷贝数的对数值为横坐标,Ct值为纵坐标绘制标准曲线获得标准曲线方程式:SYBR GreenⅠ:y=-3.576 9x+34.225,相关系数R2=0.999(图2A)。TaqMan:y=-3.028 6x+24.714,相关系数R2=0.999(图2B)。溶解曲线呈现单一峰,无引物二聚体和非特异性扩增,Tm值为 85.5℃左右。
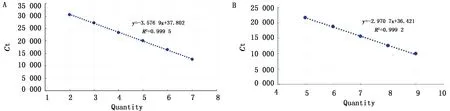
A.SYBR GreenⅠ荧光定量 PCR 方法标准曲线;B.TaqMan荧光定量 PCR 方法标准曲线
2.4 敏感性试验用建立的两种方法对10倍极限稀释的系列阳性标准品质粒(1.89×109~1.89×10-2拷贝/μL)进行实时荧光定量PCR扩增。两种方法阳性标准品均出现特异性扩增,阴性对照无荧光扩增,结果表明,TaqMan法最低可以检出的标准品浓度为1.0×101拷贝/μL(图3A),SYBR GreenⅠ法最低可以检出的标准品浓度为1.0×100拷贝/μL(图3B)。

A.SYBR GreenⅠ实时荧光定量 PCR敏感性试验;B.TaqMan实时荧光定量 PCR敏感性试验;1~12.标准质粒浓度分别为1.89×109~1.89×10-2拷贝/μL;13.阴性对照
2.5 特异性试验用已建立的两种方法同时对NDRV、DPV、DHV-1、DHV-3、IBV、DTMUV、JSHV进行检测,除了NDRV为阳性以外,其余均为阴性(图4A,B)。
2.6 重复性试验用已建立的TaqMan实时荧光定量PCR方法对5个拷贝数的阳性标准品分别进行3次批内和3次批间的重复试验(5A,B),结果显示SYBR GreenⅠ法的具有组间和组内CV均小于2.1%(表1),TaqMan法的组间和组内CV均小于1.8%(表2)。
2.7 临床样品的检测使用已建立的两种荧光定量PCR检测方法,分别对收集的30份疑似NDRV的病料(肝脏和脾脏)进行检测,SYBR GreenⅠ实时荧光定量PCR方法检出30份(图6A),检出率为100%;TaqMan实时荧光定量PCR方法检出29份(图6B),检出率为97%,两种荧光定量PCR方法的检测符合率为97%。

A.SYBR GreenⅠ实时荧光定量 PCR的特异性试验;B.TaqMan实时荧光定量 PCR的特异性试验。1~7.分别为NDRV、DHV-1、DHV-3、IBV、DTMUV、JSHV

A.SYBR GreenⅠ实时荧光定量 PCR 方法重复性试验;B.TaqMan实时荧光定量 PCR 方法重复性试验。1~5.标准质粒浓度分别为1.89×109~1.89×105拷贝/μL

图5 荧光定量PCR重复性试验

表2 TaqMan实时荧光定量 PCR 重复性试验
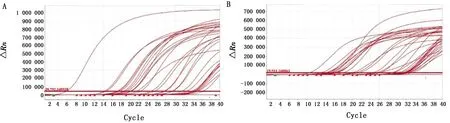
A.SYBR GreenⅠ 荧光定量PCR临床检测试验;B.TaqMan-MGB 荧光定量PCR临床检测试验
3 讨论
NDRV、MDRV和ADV都是禽正呼肠孤病毒,生物学特征表现基本相同,但是临床和抗原性表现有很大不同,NDRV感染宿主谱更广,可引起各品种鸭及鹅感染发病,且致病性也更强[18-19]。其次,在L、M和S群基因组片段中,S群基因组片段序列变异性最大,S1基因编码的结构蛋白σC和非结构蛋白P10序列变异性最大[20-21]。研究发现,造成NDRV致病性增强、致病宿主谱扩大的原因可能与结构蛋白σC的变异有关[22]。随着NDRV致病性的增强和宿主范围的不断扩大,对NDRV的防控难度也不断增大。建立一种快速、准确、敏感的NDRV检测方法是临床上防控该病的前提。
荧光定量PCR方法因为其快速、能定量、且灵敏度高于普通PT-PCR的优点被广泛应用于临床诊断[23]。目前常用于检测NDRV的荧光定量PCR方法主要是探针法和染料法(如TaqMan和SYBR GreenⅠ/Ⅱ)[24]。TaqMan-MGB探针是一种新型的TaqMan探针类型,与其他类型相比,MGB探针具有本身不发光的优点,且由于MGB基团的修饰,可以使探针的Tm值在不增加碱基数的前提下增加10℃左右,既降低了合成成本,也使得探针的设计成功率大大提高[25]。SYBR Green Ⅰ法是现在最常用的一种荧光定量检测方法,具有操作简单成本低的特点[13]。为了建立一种最快速、准确的NDRV荧光定量检测方法,本实验室根据DRV-SL的S1全基因序列设计合成了1对特异性引物和1条特异性MGB探针,通过对反应体系和反应条件的优化,建立了基于TaqMan探针和SYBR GreenⅠ检测模式的两种荧光定量PCR方法。这两种方法建立的标准曲线线性良好(R2=0.999),其中TaqMan方法的最低检测限度为101拷贝/μL,SYBR GreenⅠ为100拷贝/μL,后者比前者的敏感度高了1个数量级。两种方法对DPV、DHV-1、DHV-3、IBV0、DTMUV、JSHV的检测结果均为阴性,仅NDRV的检测结果为阳性,说明两种方法都具有很好的特异性。重复性试验结果显示,SYBR GreenⅠ和TaqMan法的组间和组内变异系数均分别小于2.1%和1.8%,说明TaqMan具有更好的重复性和稳定性。利用已建立的两种荧光定量PCR方法对30份NDRV疑似病料进行检测,TaqMan方法检出29份阳性,检出率为97%;SYBR GreenⅠ方法检出30份阳性,检出率为100%,TaqMan方法与SYBR GreenⅠ方法的符合率为97%。总体来看本试验建立的两种检测方法中,SYBR GreenⅠ法更优于TaqMan法。
由于TaqMan与SYBR GreenⅠ 两种方法的检测原理和方法不同,导致这两种荧光定量检测方法具有各自的特点,如探针法的检测时间比SYBR GreenⅠ短,准确性也更高,但是在反应体系中额外加入探针溶液,增加了反应体系被污染的风险,且探针的成本比SYBR GreenⅠ高。SYBR GreenⅠ方法虽然容易产生非特异性扩增和引物二聚体但可通过优化引物最大程度的避免,且SYBR GreenⅠ法操作简单,被污染的可能性较探针法小,所以SYBR GreenⅠ法更适合用于NDRV临床样本的检测。本试验将有助于选择合适的NDRV检测方法,对NDRV的防治起到一定作用。
——一道江苏高考题的奥秘解读和拓展

