瘦素对牦牛乳腺上皮细胞(MECs)中瘦素受体及STAT5a蛋白表达的影响
董宝霞,杨玉莹,荆海霞,张勤文,魏 青 (青海大学 农牧学院,青海 西宁 810016)
牦牛(yak)是世界最著名的牛种之一,分布在青藏高原及其毗邻的周边地区[1],可稳定适应高原低氧、低压、高寒的恶劣环境,其可利用的有乳、肉、皮毛和皮革、粪便等,也可生产一些文化或医药意义上的副产品[2],不仅具有极为重要的经济价值,还表现了特殊的生态和社会地位,被誉为“高原珍宝”[3]。其中,牦牛乳是最具有经济价值的一种天然资源,绿色、高品质、高营养为其优势特点[4]。牦牛乳乳香浓郁,味道微甜,是一种营养丰富的特种乳[5],具有抗炎症、抗氧化、抗缺氧及抗疲劳等特殊生理功能[6-7]。但牦牛饲养分散,且由于放牧环境、饲养方式、品种特性等原因[8-10],牦牛乳产量相对较低[4,11],不仅极大限制牦牛乳及其制品在市场上的经济地位,也在一定程度上造成了优质资源浪费,因此深入探讨影响牦牛乳腺上皮生长及蛋白合成的相关因子、提高牦牛的产奶量以及牦牛乳的品质显得尤其重要。
瘦素(leptin,LEP)主要由脂肪细胞合成并分泌,LEP及其受体在乳腺的腺泡上皮细胞中特异表达,可作为乳腺代谢的自分泌和旁分泌介质,维持哺乳期间乳腺腺泡上皮细胞活性[12],支持LEP在乳腺中的生物学重要性[13]。LEP在乳腺泌乳期主要激活JAK-STAT5/STAT3信号转导途径[14],它的激活与细胞生长、增殖、分化有关,也参与乳腺上皮细胞(MECs)的凋亡和退化[15]。
LEP通过与其分布广泛的受体(leptin receptor,LEPR)结合而发挥多样功能性,而LEPR不具有内在酪氨酸激酶结构域,需与细胞质激酶结合,在乳腺泌乳期通过激活JAK/STAT5信号通路诱导乳腺乳酪蛋白基因表达和乳蛋白的合成[15-16]。目前关于乳腺LEP的研究相对丰富,但大部分还是集中在组织分布上[17],关于外源性LEP作用MECs并深入探讨信号转导与分子机制的研究数据相对薄弱,尤其以牦牛MECs为载体的探究更为少见。故本研究以无催乳素(prolactin,PRL)和有催乳素添加(500 μg/L)为前提,拟通过RT-qPCR方法检测不同质量浓度LEP对牦牛MECs STAT5a mRNA表达水平的影响,Western blot技术检测STAT5a及LEPR蛋白水平表达特点,探讨不同质量浓度LEP对STAT5a和LEPR表达规律的影响,旨在分析LEP对牦牛乳蛋白合成相关因子的影响,也为LEP提高牦牛乳品质等方面的研究提供一定的理论基础。
1 材料与方法
1.1 细胞来源和试剂实验室分离纯化后的第5代牦牛MECs;DMEM/F12基础培养液(01-172-1ACS);胰岛素-转铁蛋白-硒(41400-045)、氢化可的松(H0135)、表皮生长因子(E4127)、催乳素(peprotech-100-07)、0.25% 胰蛋白酶/0.05% EDTA(03-052);总RNA提取试剂盒(离心柱型)(DP419)、核酸染料(RT210)、一步法反转录试剂盒(KR118-02)、Super Real荧光定量预混试剂-增强版试剂盒(FP205);全蛋白提取试剂盒(KGP250)、BCA蛋白浓度测定试剂盒(PC0020)、4×蛋白上样缓冲液(P1016)、凝胶制备试剂盒(P1200)、LEPR兔抗多克隆抗体(bs-0961R)、STAT5a兔抗多克隆抗体(bs-1142R)、HRP-羊抗兔IgG(BA1054)、β-actin鼠抗单克隆抗体(BM0627)、HRP-羊抗鼠IgG(BA1050)、脱脂奶粉(232100)、ECL Plus超敏发光液试剂盒(PE0010)。
1.2 试剂配制传代培养液:DMEM/F12基础培养液+2% 双抗+15% FBS+1 mg/L胰岛素-转铁蛋白-硒+200 μg/L氢化可的松+10 μg/L表皮生长因子;LEP/PRL(-)培养液:LEP(0,50,100,200,400,800 μg/L)+传代培养液;LEP/PRL(+)培养液:LEP(0,50,100,200,400,800 μg/L)+传代培养液+PRL(500 μg/L)。
1.3 样品处理选择处于对数生长期的第4代牦牛MECs,经0.25%胰酶/0.05% EDTA消化、收集并离心,利用传代培养液统一细胞浓度,等量接种于细胞培养瓶中并作好标记。每个LEP处理质量浓度均设置3个重复,其中以0 μg/L处理组作为对照。待细胞长满至培养瓶底壁约80% 时,弃去培养液,加入2~3 mL PBS将细胞表面润洗2~3遍,在各培养瓶中加入对应处理组的培养液,于培养箱内培养48 h后进行后续操作。
1.4 总RNA提取及cDNA合成根据总RNA提取试剂盒操作说明提取处理后细胞的总RNA,利用蛋白核酸测定仪测定RNA浓度及纯度,1%琼脂糖凝胶电泳检测其完整性后按一步法反转录试剂盒操作说明进行cDNA第1链合成,产物置于-20℃保存备用。
1.5 实时荧光定量PCR(RT-qPCR)根据NCBI公布的牦牛STAT5a(XM_005899207.2)及内参β-actin(XM_005887322.2)的基因序列,利用Primer Premier 5.0设计引物,并应用NCBI的BLAST功能对序列进行同源性分析以保证引物专一性,引物序列见表1,送由华大基因合成;STAT5a和β-actin基因在61℃退火温度下进行普通 PCR 扩增后,用1%琼脂糖凝胶电泳检测,发现其扩增产物条带单一,产物大小与预期相符。以反转录获得的cDNA为模板,β-actin为内参基因,通过RT-qPCR检测STAT5a在mRNA水平上的相对表达量,反应体系为20 μL,其中10 μL 2×SuperRealPreMixPlux,上、下游引物各0.6 μL,1 μL cDNA,7.8 μL ddH2O。扩增程序为94℃预变性5 s;94℃变性5 s,61℃退火30 s;72℃延伸30 s共40个循环,各处理组样品均做3次组内重复。反应结束后观察溶解曲线,采用2-ΔΔCt方法计算目的基因的相对表达量。

表1 引物序列及参数
1.6 蛋白质免疫印迹(Western blot)试验根据全蛋白提取试剂盒及BCA蛋白浓度测定试剂盒操作说明进行细胞全蛋白的提取及浓度测定,统一蛋白浓度后,以细胞全蛋白∶4×蛋白上样缓冲液=3∶1制备预混液,100℃处理5 min进行蛋白变性;根据内参β-actin和STAT5a、LEPR相对分子质量分别为42,90,28 kDa,选择制备12%和8%的分离胶及5%的浓缩胶。电泳条件:浓缩胶恒压80 V 30 min;分离胶恒压120 V 80 min,转膜前将PVDF膜于甲醇内浸泡3 min,于转膜液中平衡10 min。转膜条件:200 mA 120 min,1×TBST洗膜15 min,换液2次;将PVDF膜放入1×TBST配制的5%脱脂乳中,37℃摇床内(80 r/min)封闭120 min;于一抗(1∶1 000稀释)内4℃孵育过夜;1×TBST洗膜90 min,换液6~9次,于25℃摇床内(90 r/min)孵育二抗(1∶5 000稀释)120 min;1×TBST洗膜90 min,换液6~9次,ECL试剂曝光,利用化学发光凝胶成像系统拍照记录;用AIC.AlphaView软件检测目的蛋白及β-actin蛋白条带的灰度值。
1.7 数据处理以β-actin为内参,0 μg/L LEP处理组为对照,利用Excel 2010、IBM SPSS Statistics 23.0和Origin 8.0进行LEPR以及STAT5a蛋白的相对表达水平(n=3)的单因素方差分析及结果图形的绘制。
2 结果
2.1 不同质量浓度LEP下牦牛MECs STAT5a mRNA表达水平经检测,不同质量浓度LEP作用下的细胞总RNA纯度均较高,D260/D280值为1.9~2.1 ,电泳后清晰可见3条带,且28S条带亮度约为18S的2倍(图1),说明所提取的RNA可用于后续操作。溶解曲线显示:STAT5a和β-actin的Tm值均一且无杂峰,说明引物特异性良好,所收集的荧光强度均来自特异性的扩增产物(图2)。
RT-qPCR结果显示,培养液内有无PRL对STAT5a mRNA在不同质量浓度LEP作用下的相对表达量影响较大:无PRL时,不同质量浓度LEP对STAT5a mRNA表达均具有一定的抑制作用,基因表达量均相对较低(P<0.05),且随LEP质量浓度的升高,抑制效果未发生明显变化(P>0.05)。当添加500 μg/L PRL时,LEP对STAT5a的影响效果发生较大改变:总体来说,随LEP质量浓度升高,STAT5a mRNA相对表达量呈现先上升后降低变化趋势,当LEP为200 μg/L时,其相对表达水平最高(P<0.05),50,800 μg/L LEP对STAT5a的表达几乎无显著性影响(P>0.05)(图3)。

1~12.分别代表无PRL和有PRL时0,50,100,200,400,800 μg/L LEP下细胞总RNA;M.DL2000 DNA Marker
2.2 不同质量浓度LEP作用下 LEPR和STAT5a蛋白表达水平变化分析Western blot检测结果显示,有PRL刺激时,随LEP质量浓度的增大,蛋白表达量均呈现为先升高后降低趋势,且均在 200 μg/L LEP时,表现出最高水平的相对表达。

图2 STAT5a与β-actin溶解曲线

注:组间字母相同表示差异不显著(P>0.05);不同表示差异显著(P<0.05)
在本试验培养体系中,无PRL存在时,LEPR蛋白水平随LEP质量浓度的增大逐渐降低,而有PRL时,LEPR和STAT5a相对表达量逐渐升高,200 μg/L LEP时,相对表达量达到最高水平,后又有所降低(图4B、图5B)。
无PRL作用时,100,200 μg/L LEP对乳蛋白合成信号通路关键因子STAT5a的蛋白水平表现出显著地抑制作用(P<0.05),当PRL为100和200 μg/L 时表达水平升高(P>0.05)。高质量浓度LEP均抑制STAT5a蛋白的相对表达量(图4C、图5C)。
3 讨论
LEPR与其他Ⅰ类细胞因子受体(如IL-6受体家族的gp130亚单位)的同源性表明其与LEP结合可能介导细胞因子受体样信号,包括Janus激酶(JAKs)和信号转导子和转录激活子(STATs)的激活,因此,作为细胞因子受体超家族成员的LEPR的早期识别导致JAK/STAT通路激活,其是LEP激活的主要信号级联之一[18]。
许多细胞因子如PRL、生长激素、LEP等的刺激时均可导致STAT5激活[19]。RNA-Seq数据分析表明,STAT5a在乳腺组织中的表达与其他组织相比差异显著,提示STAT5a在乳腺内具有重要生物学功能[20]。本试验利用不同质量浓度LEP作用牦牛MECs,发现在无PRL时,STAT5a mRNA的表达被抑制,但在50 μg/L LEP作用下,STAT5a的蛋白水平相对表达较高,与之前的报道一致[21]。当PRL存在时,随着LEP作用质量浓度的升高,表现出对STAT5a mRNA先促进后抑制的作用特点,其中100,200 μg/LLEP显著促进STAT5a mRNA水平表达,并与STAT5a在蛋白水平表达的趋势一致,可能因为PRL通过激活JAK2/STAT5通路介导泌乳水平的生物作用[22],LEP可协同促进PRL对乳蛋白基因表达[23]。高浓度时,细胞因子信号抑制因子(SOCSs)负反馈作用增强,利用SH2结构域与JAK2结合,抑制其磷酸化,阻止JAK2与底物结合,另一方面诱导JAK2/STAT3信号通路启动乳腺细胞的凋亡,进而降低对STAT5a的转导[24]。

A.LEPR、STAT5a蛋白条带图(1~6.分别代表LEP质量浓度为0,50,100,200,400,800 μg/L);B.LEPR蛋白相对表达量;C.STAT5a蛋白相对表达量。组间字母相同表示差异不显著(P>0.05);不同表示差异显著(P<0.05)。下同
LEP对LEPR基因有下调作用,其机制除配体诱导的受体下调外,还可能是SOCS3对LEP的信号转导发挥负反馈抑制作用。LEP受体被激活后可诱导SOCS3[25],通过抑制JAK的酪氨酸磷酸化及活化后的JAK所诱导的LEPR的酪氨酸磷酸化,进而阻断LEP信号产生LEP抵抗[26]。本研究中无PRL时,LEP以剂量依赖性方式抑制LEPR蛋白水平表达。SZYSZKA等[27]在DU145和PREC细胞系中发现LEP抑制LEPR亚型的表达,HepG2(人肝癌细胞)中LEPRb mRNA水平也随LEP作用浓度的增大而降低[28],与HIKITA等[29]利用神经母细胞瘤细胞的研究结果一致,猜测LEP对牦牛MEC的作用过程中发生LEP抵抗。
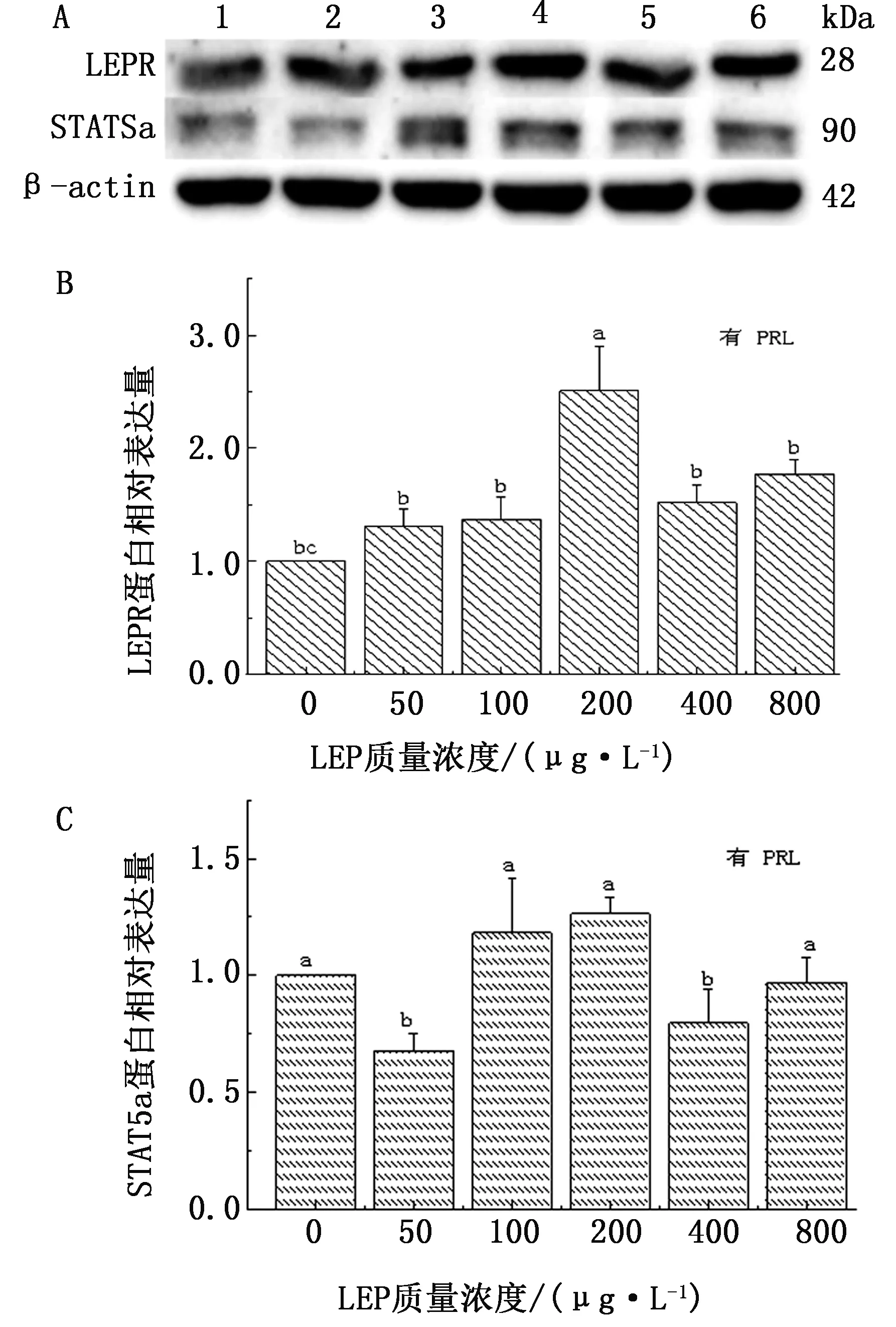
图5 有PRL时不同质量浓度LEP下牦牛MECs中LEPR、STAT5a蛋白表达
乳蛋白的合成受基因转录、蛋白翻译和代谢水平等多层次影响,因尚未涉及不同质量浓度LEP下信号通路相关因子的磷酸化研究,故LEP对相关因子的表达影响机制及与乳蛋白合成的机理还需进一步的探讨。本试验通过检测不同质量浓度LEP对牦牛MECs乳蛋白合成的相关因子的作用及表达规律,为LEP对乳腺或其他组织的相关性研究提供一定的理论基础。

