电场作用下S修饰C24N24从CO2/N2混合气体中选择性吸附CO2的第一性原理计算
张世轩,王 岚,王向岭,张淑洁,邢盈盈,王军凯
(河南理工大学 材料科学与工程学院 河南省深地材料科学与技术重点实验室,焦作 454003)
1 引 言
在过去的几十年里,对能源需求的增加导致了空气质量迅速恶化.特别是与化石燃料燃烧密切相关的温室气体的剧烈排放,已经造成了许多严重的环境问题,如全球气候变化以及危害人类身体健康等问题[1].二氧化碳是一种重要的温室气体,具有很高的全球变暖潜势.虽然二氧化碳自然存在于大气中,但人类活动,如化石燃料的燃烧以及森林的砍伐,已经造成大气中二氧化碳浓度急剧增加[2, 3].另外,从燃烧后气体(主要是CO2/N2混合物)中高效分离CO2是控制大气CO2浓度的最具挑战性的任务之一[4].因此,设计和优化有效的策略来捕获和储存二氧化碳是非常必要的.
在众多CO2吸附/存储材料中,金属-有机骨架[5-7]、氮化硼纳米片[7, 8]、活性炭[9]和碳纳米管[10, 11]等以其比表面积大和选择性高等优点得到了广泛的研究.但是这些材料在脱附过程中通常需要高温加热才能释放CO2.因此,寻找新材料及脱附工艺控制CO2的捕获/释放过程具有十分重要的意义.
近年来的研究表明,外加电场是调控材料对二氧化碳捕获和释放的有效手段.Wang等人[12]在电场作用下利用五边形石墨烯(PG)纳米片在H2、CH4及CO2的混合气体中选择性吸附CO2.结果表明,施加电场可显著提高CO2在PG纳米片上的结合强度.随着电场强度增大,CO2的吸附由物理吸附转变为化学吸附.通过改变外加电场的大小,CO2在PG纳米片上的吸附/脱附可以很容易得到控制.这说明在连续变化的电场中,CO2可以有效地从混合物中分离出来.Guo等人[13]在外加电场作用下利用六方氮化硼薄片(h-BN)吸附CO2.结果表明,与没有外加电场的情况相比,有电场作用时,CO2分子在h-BN纳米片上的吸附强度增加.这说明在电场的作用下,h-BN片对CO2的吸附优于其他气体分子,六方氮化硼片可以用于捕获CO2.Sun等人[14]研究了电场作用下MoS2单层膜对CO2的捕获行为.结果表明,在没有电场的情况下,CO2与MoS2单分子层仅形成弱相互作用,但在电场作用下,CO2与MoS2单分子层发生强相互作用.这说明在电场作用下,MoS2单层膜对CO2气体具有较强的吸附作用,特别是在以CO2和N2为主要成分的燃烧后气体混合物中可控捕获CO2.Esrafili等人[15]利用磷掺杂石墨烯(P-Gr)吸附和储存二氧化碳.结果表明,在没有电场的情况下,CO2与P-Gr中的P原子发生了弱相互作用.然而,当施加电场时,CO2与P-Gr产生强烈的化学吸附作用.同时,随着电场的去除,化学吸附的CO2很容易从P-Gr表面释放出来.这说明施加电场可以控制CO2的储存和释放.以上研究表明,外加电场确实可以控制二氧化碳在材料表面的吸附和脱附过程,但是目前的研究大部分局限于外加电场作用下二维材料对CO2的吸附/脱附.关于外加电场作用下零维材料对CO2吸附/脱附的研究还比较少.
近年来,氮掺杂多孔碳纳米材料因其表面积大、合成成本低和吸附性能优异等特点引起了广泛的关注[16-20].氮掺杂的多孔碳纳米结构通常可以通过磁控溅射反应或化学气相沉积法快速合成[21-23].由于C和N原子之间存在电荷转移,将N原子插入碳富勒烯的多孔结构会激活碳的π电子,因此氮掺杂的碳富勒烯中的N-C键是亲电/亲核反应的首选位点[24].据此,Srinivasu和Ghosh提出了一种新型的N掺杂多孔富勒烯模型,称为C24N24,它由八个C-C键连接成三个环组成,内部形成六个N4腔[25].据报道,由过渡金属和Si原子掺杂的C24N24多孔富勒烯不仅可作为储氢和催化材料[25-27],而且Si和Fe原子掺杂的C24N24(Si@C24N24和Fe@C24N24)富勒烯对CO的氧化和NO的还原都显示出良好的催化活性[28-30].这些研究表明,可通过形成牢固的N的金属共价键使它们成为活性底物来锚定金属原子,金属原子优先锚定于C24N24富勒烯中的N4空穴中,因此不容易在C24N24上发生团聚.最近的研究还表明,P修饰的C24N24富勒烯(P@C24N24)在0.014 a.u.的外加电场下可以从CO2/N2混合气体中选择性吸附CO2[31].与P原子相比,S原子拥有更多的价电子,因此S修饰的C24N24富勒烯(S@C24N24)可能具有更高的表面性能和反应活性.
基于此,本文采用第一性原理计算的方法研究了外加电场控制下S@C24N24从CO2/N2混合气体中可控捕获/释放CO2的行为.本研究对设计高选择性CO2吸附/脱附材料,减缓全球变暖具有一定的理论指导及现实意义.
2 计算方法
文中所有计算均采用Materials-Studio软件中基于密度泛函理论的DMol3软件包,电子和电子相互作用的交换关联能函数采用的是广义梯度近似(GGA)的PBE交换关联泛函.考虑到范德华力的影响,计算中采用了基于Grimme的DFT-D校正方法.基组采用双数值极化函数(DNP),内核电子处理方法采用引入相对论校正的半经验赝势(DSPPs).自治迭代收敛偏差为10-6Ha,原子间相互作用力和最大位移分别是0.02 Ha·nm-1和5×10-4nm.为了加速自洽迭代的收敛速度,采用热拖尾效应方法应用到占据轨道上,拖尾值为0.005 Ha.使用公式(1)计算吸附能(Ead);
Ead=Ecomplex-(Eadsorbent+Eadsorbate)
(1)
其中,Ecomplex,Eadsorbent和Eadsorbate分别是CO2/S@C24N24,S@C24N24和CO2分子的总能量.Ead数值越负,吸附作用越强.
采用Mulliken电荷分布来分析衬底与吸附物之间的电荷转移.为研究S@C24N24的稳定性,还计算了S@C24N24的结合能(Ebin):
Ebin=ES@C24N24-(EC24N24+ES)
(2)
其中,ES@C24N24、EC24N24及ES分别是S@C24N24、纯C24N24及单个S原子的总能量.另外,外部电场是通过在输入文件中插入“电场x,y和z值”关键字的方式加入的,x,y和z分别代表x、y及z方向的电场矢量大小.在当前计算中,使用沿z方向的电场.
3 结果与讨论
3.1 C24N24富勒烯的稳定性
C24N24富勒烯具有六个N4腔,这是固定外来原子的宿主位点.其中C—C和C—N键的距离分别为1.55 Å和1.34 Å(图1a).在进行掺杂之前,需要研究C24N24富勒烯的能量,动力学和热力学稳定性.首先,我们通过以下公式确定C24N24富勒烯的能量稳定性:
(3)
其中,EC24N24是多孔富勒烯的总能量,EnN和EnC分别是n个N原子和C原子的能量(n=24),nCN表示富勒烯中的总原子数(nCN=48).首先,Ef值为-7.63 eV,与先前的研究吻合良好[32].Ef为负值表明C24N24富勒烯可以稳定存在.其次,图2中所示的振动频率均为实数,说明该结构具有动力学稳定性.此外,进行了从头算分子动力学(AIMD)分析,温度设定为1000 K,时间为1 ps,步长为1 fs.得到的最终几何构型如图1(b)所示,势能变化图如图1(c)所示.研究结果表明,1000 K条件下没有观察到C24N24键的断裂,同时其势能在一定幅度内波动,表明C24N24能够在高达1000 K的高温下稳定存在,其热力学稳定性良好.
3.2 S@C24N24的结构和电子性质
图3(a-f)显示了S@C24N24的几何优化结构、分波态密度(PDOS)、电荷密度(ED)、最高被占据分子轨道(HOMO)及最低未被占据分子轨道(LUMO)图.首先将硫(S)原子置于N4腔的上方,并进行几何优化.结果表明,S原子和N原子之间形成了四个等价的S-N键,键长为1.903 Å,N-S-N构成的键角为132°,这表明S原子在N4腔平面上略微凸出,S原子锚定在N4腔中.S原子与C24N24富勒烯的结合能为-2.95 eV,一方面,这说明S原子与相邻N原子之间存在强相互作用力;另一方面,这也说明S原子不容易在C24N24上形成团簇.Mulliken电荷分析结果表明,N4腔上的S原子的带电量为0.419 e,而N4腔上的N原子带电量为-0.426 e,说明电荷从S原子转移到了相邻的N原子上.因此,N和S原子之间的电荷分配产生了具有部分离子特征的S-N键.此外,PDOS(图3(c))结果表明,S原子在N4腔中的锚定有助于C24N24在费米能级附近的电子态的增加.由于这些电子态的增加,S@C24N24与被吸附物之间很容易发生电荷转移.根据PDOS图可知,在费米能级附近,S原子和C24N24富勒烯的电子态之间存在相当大的重叠,因此S原子能吸附在C24N24-N4腔中.图3(d)的ED图表明S与N原子之间形成了强的共价键,这增强了S@C24N24的稳定性.HOMO-LUMO(图3(e))分析表明,掺杂S原子可降低C24N24的HOMO-LUMO轨道之间的能隙(Egap=0.178 eV),这意味着在吸附CO2气体时,S@C24N24结构可能比单独的C24N24更敏感.
3.3 无电场条件下S@C24N24吸附CO2
S@C24N24吸附CO2(CO2/S@C24N24)的几何优化结构及其PDOS图分别如图4(a)和4(b)所示,其几何参数和吸附能(Ead)示于表1.从图4(a)可以看出,无电场条件下S@C24N24中的S原子与CO2分子的C原子之间的结合距离为3.377 Å.同时键长和键角的测量结果表明,CO2分子中的C=O键长和O=C=O键角几乎没有变化,说明无电场条件下S@C24N24与CO2的相互作用较弱.一般认为Ead值大于-0.45 eV的吸附过程被认为是物理吸附.而此时CO2/S@C24N24的吸附能(Ead)仅为-0.05 eV,表明该吸附为弱的物理吸附.Mulliken电荷分析也表明,从S@C24N24中的S原子到CO2中的C原子的电荷转移仅为0.001 e,几乎可以忽略不计.从PDOS图(图4(b))中可以看出,费米能级附近S和CO2的轨道之间几乎不存在重叠.这些结果均表明,在没有外加电场的情况下,S@C24N24不易捕获CO2.
3.4 外加电场对S@C24N24吸附CO2的影响
进一步研究了外加电场作用下S@C24N24对CO2的吸附特性,采用了沿z方向的垂直电场(EF),其范围为0.000至0.018 a.u..图5示出了电场强度为0.015、0.016、0.017及0.018 a.u.时,CO2在S@C24N24上的最稳定吸附构型.随电场强度的增加,S和C原子之间的距离、CO2键角、吸附能(Ead)和电荷转移变化如图6所示.首先,当EF从0.000增至0.007 a.u.时,S和C原子的距离从3.377 Å减少到3.320 Å,Ead减小到-0.09 eV,电荷转移仅略有增加;当EF从0.009 a.u.增加到0.016 a.u.时,S和C原子的距离,O=C=O键角和Ead发生了相对明显的变化,EF = 0.015 a.u.时,S和C原子的距离减少到3.130 Å(表1),比EF = 0.009 a.u.时短约0.178 Å,且O=C=O键角减小到175.253°(表1),表明吸附过程中CO2略有弯曲;当施加的EF从0.017变为0.018 a.u.时,Ead更负(表1),为-0.794 eV,比零电场时小0.745 eV.S和C原子的距离和O=C=O键角也发生了明显的变化:O=C=O键角减小为139.352°,S和C原子距离减小至2.116 Å.Mulliken电荷转移分布表明,从S@C24N24的S原子到CO2分子中C原子的电荷转移更多(0.431 e,表1).ED图(图7)也表明S原子和C原子之间较强的电荷转移导致了更强的S…C共价键形成.这些结果都表明,在EF=0.018 a.u.时,CO2与S@C24N24之间的吸附已经转化为强的化学吸附,外加电场的存在确实显著促进了S@C24N24对CO2的吸附.
表1 计算体系的电场EF(a.u.)、键长(Å)、键角(°)、吸附能Ead (eV)及电荷转移Q(|e|)
Table 1 Electric fields EF(a.u.), bond lengths(in Å), bond angles(°), adsorption energies Ead(eV)and charge transfers QCT(in|e|)for the computed systems
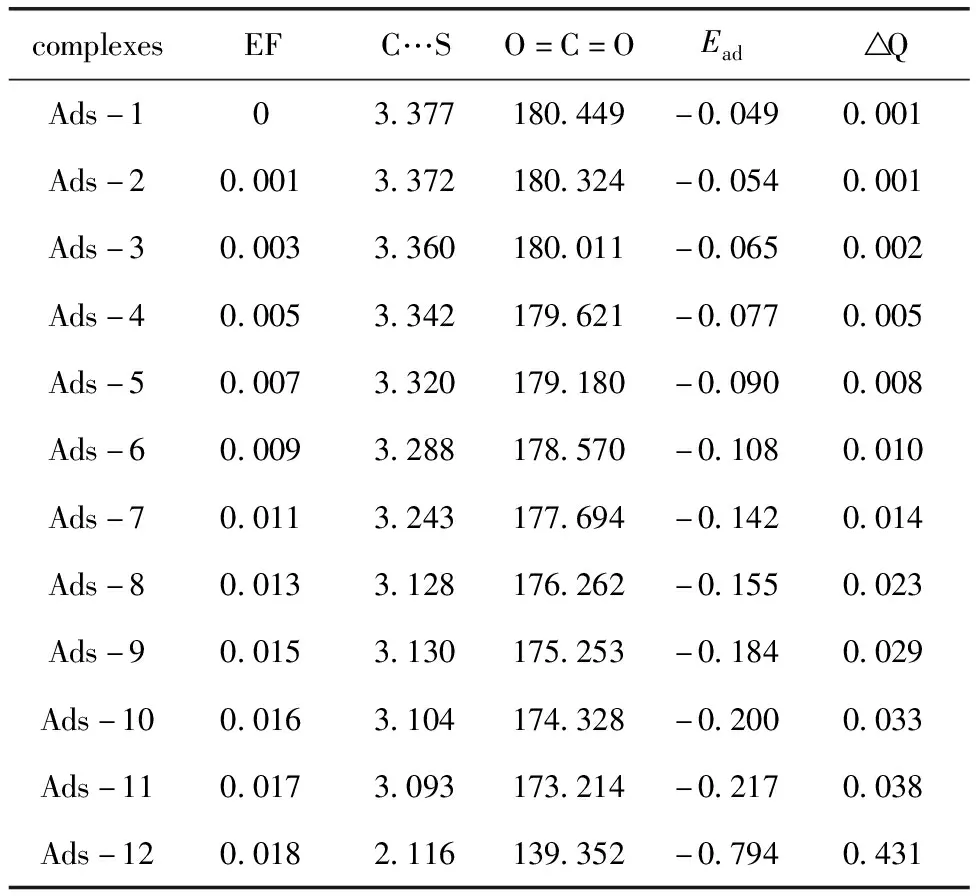
表1 计算体系的电场EF(a.u.)、键长(Å)、键角(°)、吸附能Ead (eV)及电荷转移Q(|e|)
complexesEFC…SO=C=OEa QAds-103.377180.449-0.0490.001Ads-20.0013.372180.324-0.0540.001Ads-30.0033.360180.011-0.0650.002Ads-40.0053.342179.621-0.0770.005Ads-50.0073.320179.180-0.0900.008Ads-60.0093.288178.570-0.1080.010Ads-70.0113.243177.694-0.1420.014Ads-80.0133.128176.262-0.1550.023Ads-90.0153.130175.253-0.1840.029Ads-100.0163.104174.328-0.2000.033Ads-110.0173.093173.214-0.2170.038Ads-120.0182.116139.352-0.7940.431
为了进一步阐明S@C24N24吸附CO2的机理,关闭了在CO2化学吸附构型中的电场.从化学吸附(EF = 0.018 a.u.,Ead=-0.794 eV)到物理吸附(EF = 0.000 a.u.,Ead=-0.049 eV)过程的能量变化如图8所示,可以看出关闭电场后S和C原子之间的距离及O=C=O键角均恢复到最初未加电场时的状态,这表明电场关闭后,CO2与S@C24N24之间的化学吸附又转变成了弱的物理吸附.此外,从中还可以看出,该过程是放热的,而且不需要跨越任何能垒就可以完成.据此可以得出结论,通过打开/关闭外加电场,可以控制CO2在S@C24N24上的吸附/释放.
为了了解电场对S@C24N24上吸附的CO2电子性能的影响,进一步研究了其PDOS(图9).PDOS图显示,当EF从0.017增至0.018 a.u.时,S@C24N24与CO2在费米能级附近的重叠轨道有所增加.
3.5 S@C24N24分离CO2/N2
由于大气的主要成分是氮气,因此研究中还考虑了S@C24N24吸附N2的情况,以检验其是否能够从CO2/N2混合气体中分离出CO2.如图10(a)所示,在EF为0的情况下,N2和S原子之间的结合距离为3.785 Å,Ead为-0.03 eV,显示出弱的物理吸附性质.此外,N2分子的Ead值高于CO2的Ead值,表明S@C24N24捕获CO2的潜力略高于N2分子.Mulliken电荷分析表明,从S原子到N2的电荷转移仅为0.002 e,基本可以忽略不计.这表明N2与CO2类似,在没有电场的情况下,S@C24N24也不能很好地吸附N2.另一方面,由于N2和CO2的吸附能仅存在微弱的差异,因此在没有电场的情况下,S@C24N24也不适用于在CO2/N2混合气体中选择性吸附CO2.
为了进一步研究N2的吸附情况,在垂直方向施加EF=0.016、0.017及0.018 a.u.的电场.N2在S@C24N24上最稳定的吸附构型如图10(b-d)所示.结果表明,将EF从0.016增加到0.018 a.u.时,N2分子与S@C24N24之间的结合距离变化不大(图10(e)).EF=0.018 a.u.时,N2分子到S的距离为3.895 Å,比EF = 0.000 a.u.仅变化0.11 Å.类似地,如图10(f)所示,随着EF从0.000 a.u.调整到0.018 a.u.,N2的Ead略微增大.在EF=0.018 a.u.时N2的Ead仅为-0.20 eV.这表明,与CO2不同,即使在外加电场下,N2也很难在S@C24N24上吸附.例如,使用相同的EF = 0.018 a.u.,CO2的Ead为-0.794 eV,而N2的Ead为-0.20 eV.这表明在相同的EF条件下,S@C24N24吸附CO2的Ead值比吸附N2的小0.594 eV.综上所述,通过控制EF的强度,S@C24N24可以从CO2/N2混合气体中选择性吸附CO2.
4 结 论
本文采用第一性原理计算的方法研究了S@C24N24从CO2/N2混合气体中可控吸附/释放CO2的行为.主要研究结论如下:
(1)S原子通过与相邻的N原子形成共价键,可以牢固地锚定在C24N24富勒烯的N4腔中.S@C24N24的结合能为-2.95 eV,表明S@C24N24具有高稳定性.
(2)在无电场的情况下,CO2在S@C24N24上的吸附为弱的物理吸附,吸附能仅为-0.049 eV;在0.018 a.u.的电场作用下,物理吸附转变为化学吸附,吸附能为-0.794 eV,且S原子到C原子的距离缩小为2.116 Å.当关闭电场时,释放CO2的过程是放热的,没有能量势垒,因此吸附的CO2容易释放.而同样电场条件下,S@C24N24对N2的吸附仅为弱的物理吸附.
(3)通过施加外电场,S@C24N24可以选择性地从CO2/N2混合气体中吸附CO2.因此,S@C24N24有望成为选择性吸附CO2的候选材料.

