一种基于神经细胞膜电位荧光探针的河豚毒素毒性检测细胞模型*
戴小宇 张吉芊竹 李劲锋 任丽君 贾 睿 朱玉平 朱江波 陈基快△
(海军军医大学,1 海军医学系卫生毒理学教研室,2 基础医学院实验教学中心,上海 200433;3 上海海洋大学海洋生态与环境学院,上海 201306)
河豚毒素(tetrodotoxin,TTX)[1-2]是迄今发现毒性最强的海洋神经毒素之一,为一种电压门控钠通道(VGSCs)[3]的阻滞剂,能选择性地与肌细胞、神经细胞膜表面的钠离子通道受体结合,通过对钠离子通道的阻断而导致神经冲动的传导障碍,进而引起一系列神经麻痹反应,最终导致生物因呼吸抑制至衰竭而死亡[4]。TTX 毒性极强,引起动物死亡的最小剂量为8 μg/kg[5],中毒潜伏期短,短至10~30 min 发病,若不急救最快10 min 内发生死亡[6]。TTX 中毒目前尚无特效解毒药[7],因此,开展TTX 的新型定性定量检测技术和毒性评价平台研究具有重要意义。目前海洋毒素的常用检测法有小鼠生物法、酶联免疫(ELISA)检测法和高效液相色谱法等,均存在一些不足之处[8]。体外细胞检测法是一种新型海洋毒素的检测方法,具有成本低、操作方便、符合动物福利等优点,值得进一步探索。大部分海洋毒素通过与可兴奋膜中的电压敏感钠通道相互作用而发挥作用[9]。SH-SY5Y 人神经母细胞瘤细胞可以稳定表达一系列电压门控的Ca2+和Na+通道,常被用于评价生物毒素的毒性作用[10]。膜电位荧光探针是用于研究离子通道的重要工具。本研究拟采用SH-SY5Y 细胞和膜电位荧光探针建立一种可以快速评价河豚毒素功能的细胞模型,用于后续的毒性评价和解毒剂筛选。
1 材料和方法
1.1 材料
本实验选择复苏后扩增3 代以上的SH-SY5Y细胞株(和元生物技术(上海)股份有限公司)。
1.2 试剂与耗材
TTX(批号1903044,上海阿拉丁生化科技股份有限公司);藜芦定Veratridine(批号19510020,Anpel公司);DiBAC4(3)(Bis(1,3-dibutylbarbituric acid)trimethine oxonol,sodium salt)( 批号PM850,同仁化学公司);DMSO(批号E201BA0030,BBI Life Science公司);Hanks平衡盐溶液(批号G210713,BasalMedia公司);MEM培养基(批号70100200,Biosharp公司);F12培养基(批号70110020,Biosharp公司);Sodium pyruvate solution(批号RNBF2884,Sigma公司);GlutaMAXTM-l(批号2088878,Glibco公司);小牛血清(批号26219002,Corning公司);胰蛋白酶(批号2277047,Glibco公司);PBS(批号21036449,Biosharp公司);全黑底透96孔细胞培养板(Costar公司,型号3603)。
1.3 仪器
SpectraMax M2/M2e 多功能酶标仪(美国Molecular Devices 公司);IX71 倒置荧光显微镜(日本奥林巴斯公司);ZHJH-C111IC 超净工作台(上海智城分析仪器制造有限公司);Centrifuge 5804R离心机(德国Eppendorf 公司)。
1.4 细胞悬液制备
SH-SY5Y 细胞以MEM:F12(1∶1)培养基,添加L-谷氨酰胺、丙酮酸钠、10%小牛血清,在37 ℃、5% CO2环境下培养,待生长至融合状态80%以上时,弃培养基,PBS 洗涤3 次,用0.25%胰蛋白酶进行消化,调整细胞浓度为6×105/mL。
1.5 细胞种板
配制后的细胞悬液,以6×104细胞/孔为宜,接种到全黑底透96 孔细胞培养板,每孔体积100 μL,常规培养24 h。
1.6 荧光测量
所有的实验均在全黑底透96 孔细胞培养板上进行,使用多功能酶标仪在波长490/525 nm 处测定荧光。每孔用PBS 溶液洗涤后加入Hanks 平衡盐溶液100 μL,每2 min 测一次荧光,检测10 min。用DiBAC4(3)荧光探针暴露SH-SY5Y 细胞的膜电位变化来评估TTX 毒性,加入序列浓度的DiBAC4(3)溶液100 μL,使终浓度为0、30、100、300、1 000、3 000 nmol/L,每5 min 测一次荧光,监测1 h。用藜芦定溶液使细胞去极化,加入序列浓度的藜芦定溶液5 μL,使终浓度为0、50、100、200、400 μmol/L,每2 min 测一次荧光,检测10 min。加入序列浓度的TTX 溶液5 μL,使终浓度为0、1、3、10、30、100 μmol/L,每2 min 测一次荧光,监测30 min。每次药物干预后最后一个时间点利用荧光显微镜拍照。每个浓度设6 个复孔。
2 结果
首先,本实验探索6 种浓度DiBAC4(3)在加入SH-SY5Y 细胞后产生的荧光变化,目的是找到合适的浓度以及合适的反应时间使荧光趋于稳定,便于开展后续实验。结果显示不同浓度DiBAC4(3)孵育后 3 000 nmol/L 组细胞荧光显著增强(图1),荧光读数呈浓度依赖性升高,并且在1 h 后保持稳定(图2)。根据最佳数值在10%~15%酶标仪每秒计数最大值原则,选择1 000 nmol/L 浓度用于后续实验。

图1 SH-SY5Y 细胞在不同浓度DiBAC4(3)作用1 h 的荧光变化,标尺=50 μm。A、B、C、G、H、I:分别是0、30、100、300、1 000 nmol/L 和 3 000 nmol/L DiBAC4(3)处理1 h 后细胞明场照片;D、E、F、J、K、L:分别是0、30、100、300、1 000 nmol/ L 和3 000 nmol/L DiBAC4(3)处理1 h 后细胞的绿色荧光照片.

图2 SH-SY5Y 细胞在不同浓度DiBAC4(3)作用下随时间的荧光读数变化.
然后,给予钠通道激动剂藜芦定放大细胞膜电位,从而能够更好地观察TTX 对细胞膜电位的改变。1 000 nmol/L DiBAC4(3) 条件下,藜芦定随着浓度增加每组细胞荧光强度均有增强(图3),表明藜芦定能使细胞去极化,200 μmol/L 藜芦定处理SH-SY5Y 细胞10 min 后荧光读数显著升高,并保持稳定(图4),因此选择200 μmol/L 用于后续实验。
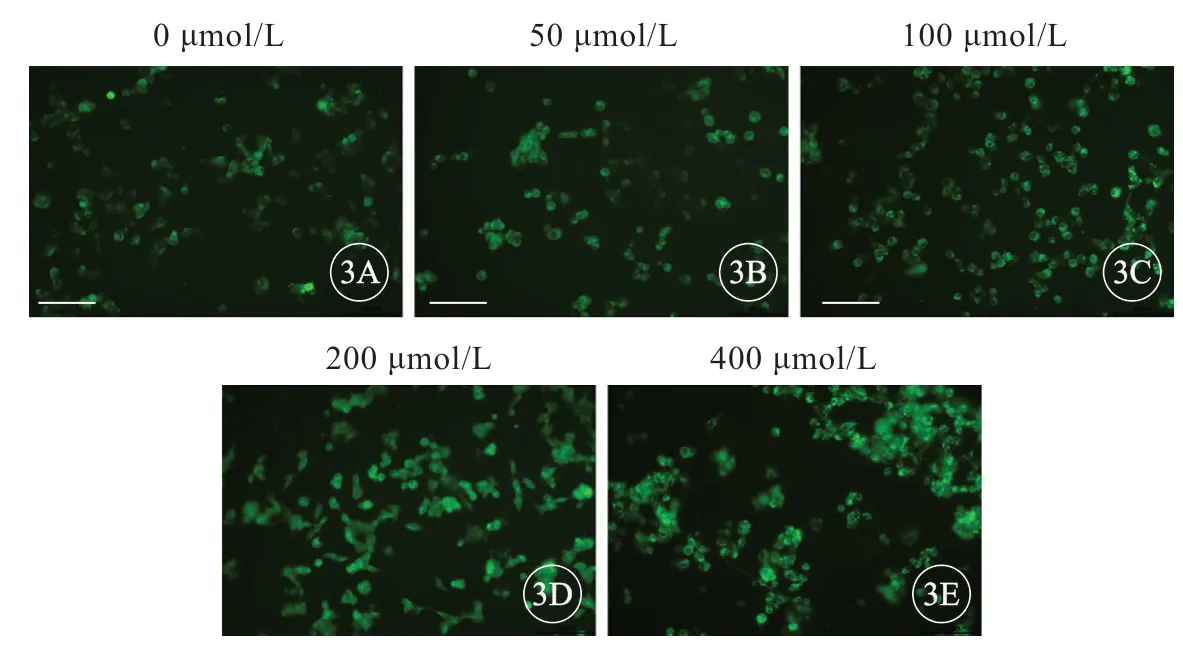
图3 SH-SY5Y 细胞在1 000 nmol/L DiBAC4(3)环境下不同浓度藜芦定作用后随时间的荧光变化,标尺=50 μm。A、B、C、D、E:分别是0、50、100、200 μmol/L 和500 μmol/L 藜芦定处理后细胞的绿色荧光照片.

图4 SH-SY5Y 细胞在1 000 nmol/L DiBAC4(3)环境下不同浓度藜芦定作用后随时间的荧光读数变化.
最后,给予TTX 检测其对细胞膜电位的影响,显示细胞荧光强度在TTX 浓度为100 μmol/L 时明显变弱(图5),荧光读数显著降低,且恢复至添加藜芦定之前的水平(图6)。

图5 SH-SY5Y 细胞在1 000 nmol/L DiBAC4(3)、200 μmol/L 藜芦定环境下不同浓度河豚毒素作用后随时间的荧光变化,标尺50 μm。A、B、C、D、E、F:分别是0、1、3、10、30 μmol/L 和100 μmol/L 河豚毒素处理后细胞的绿色荧光照片.

图6 SH-SY5Y 细胞在1 000 nmol/L DiBAC4(3)、200 μmol/L 藜芦定环境下不同浓度河豚毒素作用后随时间的荧光读数变化.
3 讨论
海洋毒素种类复杂多样,毒性较高,亟需建立毒素的快速检测、应急处置与防治方法,因此建立快速、灵敏、特异性高的海洋毒素检测方法已成为应对中毒事件的关键。新颁布的《食品安全国家标准水产品中河豚毒素的测定》[11-12]于2017年6月23日实施,该国标重新规定了水产品中TTX 的4 种检测方法,其中小鼠生物法[13]能够检测所有毒素对动物的毒性反应,但不能满足实验动物福利的要求,具有灵敏度低,特异性及重复性差等缺点;液相色谱串联质谱法需要知道待测毒素的分子量大小,才可以进行定性分析,另外还需要专业的检测人员以及昂贵的设备[14];液相色谱-荧光检测法 灵敏度极高,能够消除非荧光成分的干扰,但不是所有毒素在实验时能发射荧光,缩小了应用的范围[15];酶联免疫吸附法 的技术难点在于单克隆抗体制备,检测试剂盒价格昂贵限制了其推广[16]。
以上经典的检测方法以毒素的化学结构为基础进行定性定量分析,但不能观察毒素对受试对象本身的毒性表现。为此,研究者们陆续开发了以细胞为载体的新的检测方法,例如细胞毒性检测法、细胞生物传感器检测法及膜片钳检测法等。最初的细胞毒性检测手段是直接用显微镜进行观察分析[17],之后发展为四甲基偶氮唑盐(MTT)比色法[18]、F-肌动蛋白荧光分析法[19]等。虽然细胞毒性试验减少了实验动物的使用,可在一定程度上评价毒素毒性,但可检测的毒素种类较少。细胞生物传感器可动态、实时监测细胞的新陈代谢以及细胞的激活与阻滞,能够实时动态以及快速检测,但稳定性较低[20]。膜片钳 通过测量单离子通道和全细胞离子电流分析化学物质、电刺激等因素与细胞膜电位、离子浓度等之间的关系,分析对细胞功能的影响,但是膜片钳检测通道偏少,实验效率较低,成本较高,限制了其在高通量、自动化等方面的发展[21]。
本实验探索了适合的DiBAC4(3)及藜芦定浓度,以及适当的时间点来添加DiBAC4(3)、藜芦定和TTX。在实验中使用的DiBAC4(3)[22]是Bisoxonol 型阴离子膜电位敏感染料,由于它的负离子特性,该染料受正电位影响,由细胞膜外迅速进入膜内使荧光瞬间增强,并根据细胞膜电位的改变而出入细胞膜。我们记录了不同时间的荧光变化,发现DiBAC4(3)染色后孵育1 h 左右基线稳定。藜芦定[23]是百合科植物中发现的生物碱毒素,可以导致电压门控的Na+通道持续打开,有效激活细胞膜上钠离子通道,使钠离子持续性内流,表现为细胞荧光强度显著增强,产生去极化。加入不同浓度TTX 后,细胞去极化受到显著抑制,与TTX浓度存在一定的依赖性。100 μmol/L TTX 使细胞荧光强度降至添加藜芦定之前的荧光强度,可见100 μmol/L TTX 可以作为后期细胞水平筛选TTX解毒剂的理想浓度。
动物福利是本课题组一直在关心的问题,开发替代性筛选实验具有重要意义。基于荧光探针建立的微板测量法通过测量TTX 诱导的膜电位变化量化TTX 的毒性,克服了仪器分析方法不能直接反映毒素实际毒性的不足,重复性及稳定性很好。本实验的创新点在于建立了微板分析法定量TTX 毒素,并找到了基于此方法筛选TTX 解毒剂的理想浓度,对于实现TTX 检测高通量筛选有重要意义。麻痹性贝类毒素与TTX 的毒作用机制相似[24],因其与细胞膜上Na+通道位点的氨基酸残基亲和性较高,可选择性阻断Na+内流,抑制动作电位形成和阻断电兴奋传播,造成神经系统传导障碍。麻痹性毒素[25]目前已发现20 多种,包含石房蛤毒素、新石房蛤毒素、漆沟藻毒素1-4 等,可以尝试将此细胞模型应用到以上毒素,开展对细胞毒性的检测。但该细胞模型仍存在不足之处需要进一步摸索,例如:未与常用的TTX 检测方法一致性进行对比;如何推广此细胞模型来进行未知浓度TTX 的检测;未明确检测范围等。以上方向可以作为下一阶段的研究重点找寻优化方法。

