酿酒酵母产脂肪酸乙酯代谢途径改造
姜 慧,张利华,夏媛媛,陈献忠
(江南大学 生物工程学院,江苏 无锡 214122)
酿酒酵母是一种适合微生物大规模长期培养的候选菌,被认为是最具潜力的大规模生产菌种。酿酒酵母具有生长周期短、发酵能力强,容易进行大规模培养等优点,一直是基础及应用研究的主要对象,在食品、医药等领域应用广泛。酿酒酵母也被用于其他具有重要工业价值代谢产物的发酵,例如乙醇、脂肪酰辅酶A等。通过分子改造阻断底物葡萄糖的分流从而累积FAEE形成的前体物质乙醇和脂肪酰辅酶A[1-2],再充分利用WS2的酯化作用[3-4],有效生成生物柴油的前体物质FAEE,这不仅促进了工业和经济的发展,对环境的改善作用也不容小觑。
现阶段对于通过细胞工厂生产FAEE的研究并不是很多,更多的研究集中在利用化学合成生产FAEE作为柴油的前体物质,不过化学合成高效率的背后却对环境和原料损耗方面有着极大的负担,因此从长远角度考虑,利用细胞工厂生产FAEE更顺应时代潮流。目前已尝试在大肠杆菌E.coli、酿酒酵母Saccharomyces cerevisiae[5-6]、产油酵母Yarrowia lipolytica等微生物体内通过代谢途径改造生产FAEE,其中在产油酵母Yarrowia lipolytica中通过代谢改造等手段使FAEE产量达到1.18 g/L,是目前报道中最高的[7]。在酿酒酵母中单纯通过基因敲除阻断分支途径以及异源表达WS2等手段获得的FAEE最高产量为34 mg/L[8],本研究FAEE的代谢改造见图1,FAEE摇瓶产量达到144.4 mg/L,发酵罐产量达到1.35 g/L,此结果在利用酿酒酵母生产FAEE中均处于较高水平。
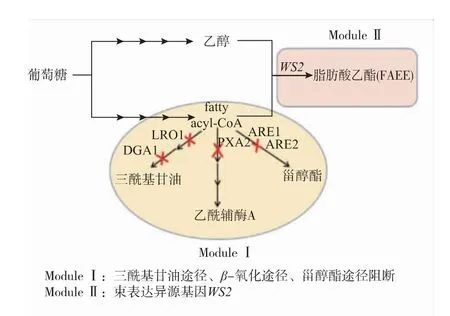
图1 代谢改造酿酒酵母产FAEE的策略Fig.1 Metabolic modification of S.cerevisiae for FAEE production
根据生成FAEE过程中前体物质富集以及前体物质酯化将代谢途径改造分为Module I和Module II两个模块,Module I分子改造主要为基因敲除,Module II分子改造主要为基因整合。Module I通过对编码甾醇酰基转移酶的基因ARE1、ARE2敲除来阻断甾醇酯途径;对编码甘油酰基转移酶的基因LRO1、DGA1敲除来阻断三酰基甘油途径以及对编码长链脂肪酸转运体的基因PXA2的敲除来阻断β氧化途径;Module I中3条途径阻断最终富集FAEE前体物质——脂肪酰辅酶A。Module II是在Module I基础上再异源表达,酿酒酵母密码子优化的蜡酯合成酶基因WS2将乙醇和Module I中富集的脂肪酰辅酶A在WS2酯化作用下转化成我们所需的目的产物FAEE[9]。
1 材料与方法
1.1 材料
1.1.1 菌株,质粒和引物实验所用菌株见表1,BY4741是酿酒酵母组氨酸、亮氨酸、甲硫氨酸和尿嘧啶缺陷型菌株;质粒pMRI-21:由作者所在实验室保藏,见表2;pMD19-T Simple载体:购自TaKaRa公司;PCR引物:由苏州泓迅生物科技股份有限公司合成,见表3。

表1 本研究涉及菌株Table 1 Strains involved in this study

表2 本研究所用质粒Table 2 Plasmids used in this study
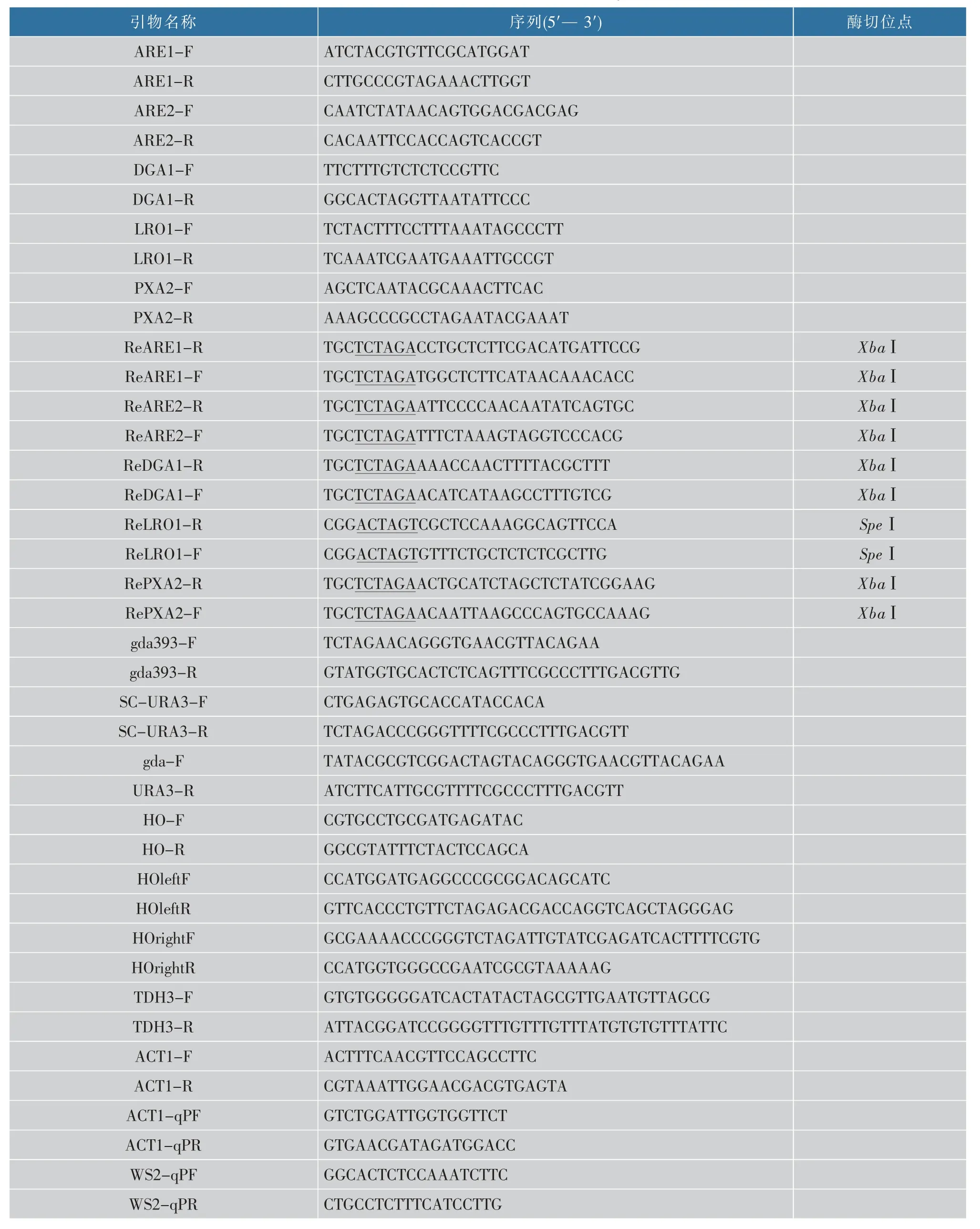
表3 本研究所用引物Table 3 Primers used in this study
1.1.2 主要培养基
LB培养基(组分g/L):蛋白胨10,酵母粉5,NaCl 10。
YPD培养基(组分g/L):蛋白胨20,酵母粉10,葡萄糖20。
MM培养基(组分g/L):YNB 6.7,葡萄糖20,硫酸铵10。
SM培养基(组分g/L):YNB 6.7,葡萄糖20,硫酸铵10,尿嘧啶0.06。
筛选培养基(组分g/L):YNB 6.7,葡萄糖20,硫酸铵10,尿嘧啶0.06,5-FOA 1。
发酵培养基(组分g/L):葡萄糖20,YNB 6.7,酵母粉6,蛋白胨3,K2HPO47.2,KH2PO49.3,醋酸3,尿嘧啶0.06。
BYD5W2发酵罐培养基(组分g/L):葡萄糖60,YNB 6.7,酵母粉18,蛋白胨3,K2HPO47.2,KH2PO49.3,醋酸3,尿嘧啶0.06。
BYD5W2*发酵罐培养基(组分g/L):葡萄糖60,YNB 6.7,酵母粉18,蛋 白胨3,K2HPO47.2,KH2PO49.3,醋酸3。
1.1.3 主要试剂与仪器正己烷(色谱级)、乙酸乙酯(色谱级):阿拉丁试剂公司产品;酵母氮基(YNB)、5-氟乳清酸(5-FOA):上海生物工程股份有限公司产品;月桂酸乙酯(Ethyl dodecanoate)、肉豆蔻酸乙酯(Ethyl myristate)、棕榈酸乙酯(Ethyl palmitate)、硬脂酸乙酯(Ethyl Stearate)、二十酸乙酯(Ethyl arachidate)、顺-9-十八稀酸乙酯(cis-9-Octadecenoic acid ethyl ester/Ethyl oleate):Sigma公司产品;十七烷酸乙酯(Ethyl heptadecanoate)、顺-9-十六稀酸乙酯(Ethyl cis-9-Hexadecenoate):TCI公司产品;一步克隆试剂盒(ClonExpress II One Step Cloning Kit):南京诺唯赞生物科技有限公司产品;酵母RNA提取试剂盒:Takara生物试剂公司(SYBR Premix Ex Taq ll(Tli RNaseH Plus))产品。
隔水式恒温培养箱:上海精宏试验设备有限公司制造;PCR扩增仪:上海东胜兴业科学仪器有限公司制造;控温摇床:太仓市实验设备厂制造;UV-2100可见分光光度计:上海尤尼科有限公司制造;干燥箱:杭州汇尔仪器设备有限公司制造;高速台式离心机、ISQ单四级杆气质联用仪、超高效液相色谱串联四级杆飞行时间质谱联用仪:赛默飞世尔科技有限公司制造;自动高压蒸汽灭菌锅:日本三洋电机公司制造;超净工作台:苏州净化设备厂制造;电泳凝胶成像系统:BIO-RAD公司制造;实时荧光定量基因扩增仪:美国伯乐公司制造;全自动制冰机:GRANT公司制造;生物传感分析仪:山东省科学院生物研究所制造;pH计:梅特勒-托利多公司制造。
1.2 方法
1.2.1 敲除盒构建过程对酿酒酵母BY4741基因组进行分析,获得5个基因,分别为ARE1、ARE2、DGA1、LRO1、PXA2基因,根据基因序列构建敲除盒。以基因ARE1敲除盒构建为例,设计引物ARE1-F和ARE1-R,以酿酒酵母BY4741基因组为模板,PCR扩增ARE1基因,经PCR试剂盒纯化后,与pMD19-T Simple载体进行连接,获得重组质粒Ts-ARE1;以质粒Ts-ARE1为模板,设计引物ReARE1-F和ReARE1-R(分别添加XbaⅠ酶切位点),反向PCR得到片段ARE1U-Ts-ARE1D,凝胶回收该片段,将该片段与质粒Ts-HO-gda-URA3同时经限制性内切酶XbaⅠ消化,凝胶回收后将片段ARE1U-Ts-ARE1D与片段gda393-URA3连接,获得重组质粒Ts-ARE1-gda393-URA3。以上述重组质粒为模板,用引物ARE1-F和ARE1-R,PCR得到敲除盒ARE1U-gda393-URA3-ARE1D,见图2。利用相似策略,构建其他基因敲除盒。

图2 重组质粒TS-ARE1-gda-URA3构建过程Fig.2 Construction process of recombinant plasmid TS-ARE1-gda-URA3
1.2.2 ARE1等基因敲除过程以尿嘧啶缺陷型菌株BY4741为出发菌株,以URA3基因为筛选标记,采用醋酸锂转化法[10]将敲除盒依次转入酿酒酵母BY4741中[14]。敲除盒转入宿主后涂布到MM固体培养基挑取转化子,提取基因组,PCR验证鉴定出正确转化子;将上述步骤正确的转化子涂布到5-FOA培养基上,再次挑选转化子,提取基因组,PCR初步验证弹出URA3基因后,将PCR产物送至公司测序,序列比对无误后保藏正确菌株;此方法可以重复利用筛选标记[15-16]。
1.2.3 WS2整合框构建过程对酿酒酵母BY4741基因组进行分析,选取整合位点HO[11],根据基因序列构建整合框。首先设计引物HO-F和HO-R,以酿酒酵母BY4741基因组为模板,PCR扩增HO基因,经PCR试剂盒纯化后,与pMD19-T Simple载体进行连接,获得重组质粒Ts-HO;以质粒Ts-HO为模板,设计引物ReHO-F和ReHO-R(分别添加XbaⅠ酶切位点),反向PCR得到片段HOU-Ts-HOD,凝胶回收后将片段HOU-Ts-HOD与片段gda393-URA3(两端具有XbaⅠ酶切位点)连接,获得重组质粒Ts-HO-gda393-URA3。以PMRI-21质粒为载体骨架,将GAL10启动子替换成酿酒酵母强启动子TDH3[12-13],蜡酯合成酶基因WS2是根据酿酒酵母密码子优化后的基因,两端带有酶切位点Bam H和Xho I,通过酶切连接可以将蜡酯合成酶基因WS2插入质粒PMRI-21的启动子TDH3和终止子CYC1之间,形成WS2的表达框,质粒命名为pMRI-21-TDH3-WS2-CYC1。用Sma I酶切Ts-HO-gda393-URA3将其线性化,最后通过一步连接将WS2表达框TDH3-WS2-CYC1连接到Ts-HO-gda393-URA3上形成重组质粒Ts-HO-gda393-URA3-TDH3-WS2-CYC1。以上述重组质粒为模板,用引物HO-F和HO-R,PCR得到WS2整合框HO-gda393-URA3-TDH3-WS2-CYC1,具体整合框构建过程见图3。
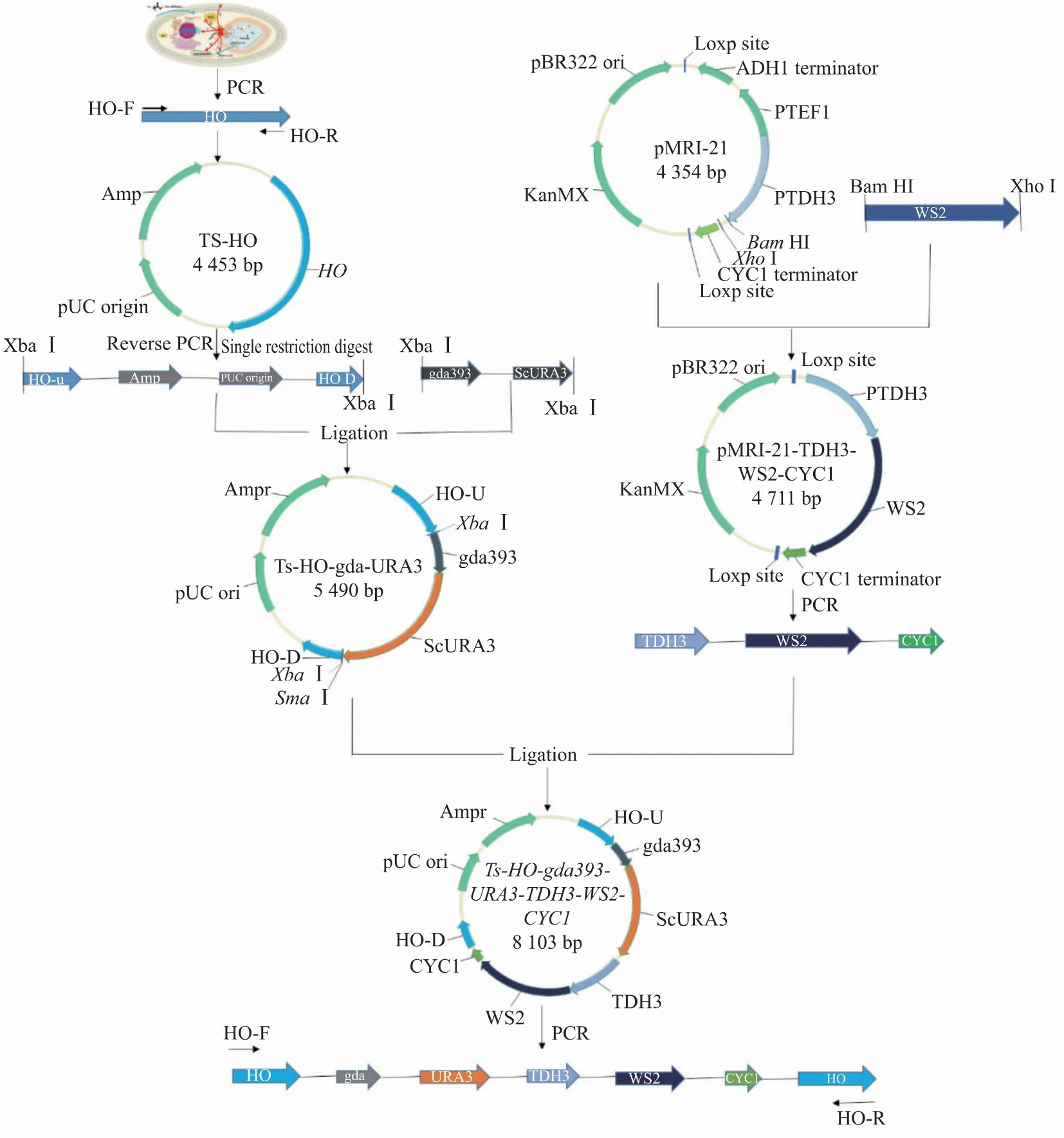
图3 WS2整合框的构建Fig.3 Construction of WS2 integration box
1.2.4 WS2基因整合过程以BYD5为出发菌株,仍以URA3基因为筛选标记,采用醋酸锂转化法将整合框转入出发菌株中[14]。整合框转入宿主后涂布到MM固体培养基挑取转化子,提取基因组,PCR验证鉴定出正确转化子;将上述步骤正确的转化子涂布到5-FOA培养基上,再次挑选转化子,提取基因组,PCR初步验证弹出URA3基因后,将PCR产物送至公司测序,序列比对无误后保藏正确菌株;此方法可以重复利用筛选标记[14-15]。
1.2.5 摇瓶发酵优化从-70℃超低温冰箱中取出甘油管保藏的重组酿酒酵母菌株,挑取菌株于YPD固体平板上划线活化,置30℃培养箱中培养48 h获得单菌落。从平板上挑取单菌落接种至10 mL的YPD液体培养基中培养36 h,以体积分数2%接种体积分数接种于50 mL YPD液体培养基中,于30℃、200 r/min摇床中发酵培养60 h[16]。在发酵过程中对是否添加乙醇和菜籽油、发酵时间以及乙醇添加模式这3个因素进行优化。
1.2.6 发酵罐发酵实验从平板上分别挑取尿嘧啶缺陷菌株BYD5W2的单菌落和尿嘧啶未缺陷菌株BYD5W2*的单菌落,接种至10 mL的YPD液体培养基中培养36 h,以2%接种体积分数接种于50 mL YPD液体培养基中,培养至OD为2时以10%接种体积分数接种于3 L的发酵罐。发酵过程中待初始葡萄糖低于5 g/L时开始流加80 g/dL葡萄糖以维持发酵罐的糖质量浓度为10 g/L,乙醇从36 h开始保持流加量为8 mL/h,首次添加乙醇时一次性添加体积分数2%菜籽油并通过手动补加5 mol/L NaOH调节发酵罐pH保持在5.5左右。在发酵罐发酵过程中,从12 h开始每4 h取样检测OD和葡萄糖质量浓度,从48 h开始每12 h取样检测FAEE产量。
1.2.7 产物FAEE的提取取发酵液10 mL,加入终质量浓度5 mg/mL的蜗牛酶振荡混匀,置37℃培养箱反应12 h进行初步破壁处理,然后再利用超声波破碎仪在35 W冰上低温破碎100 min破壁,使细胞彻底释放出产物。在超声破碎细胞后立即向细胞液中加入20 mL正己烷,上下颠倒使其充分混匀,在振荡仪上振荡15 s后于7 000 r/min离心10 min,分离并收集有机层。重复添加正己烷进行二次萃取,在真空离心浓缩仪中利用正己烷的易挥发性对萃取的FAEE进行浓缩[16]。
1.2.8 GC-MS分析将萃取浓缩后的样品按比例复溶于正己烷中,过膜后取1 mL进行气质检测。气质分析条件为:DB-5MS毛细管色谱柱(30 m×0.25 mm×0.25μm),进样器温度和柱温均为300℃。升温程序:起始80℃,维持1 min;然后以2℃/min升温至100℃;15℃/min升温至280℃,保持2 min;最后以30℃/min升温至300℃,保持3 min。质谱:EI离子源,四级杆检测器;电离能70 eV,离子源表面温度为280℃[17]。
2 结果与讨论
2.1 Module I基因突变株的构建
构建了ARE1、ARE2、DGA1、LRO1和PXA2基因敲除盒质粒,用限制性内切酶Xba I单酶切验证,条带大小均与理论一致,测序结果表明ARE1、ARE2、DGA1、LRO1和PXA2基因敲除质粒构建成功。
用上述重组质粒为模板,PCR扩增出相应的敲除盒,通过醋酸锂转化法依次转入宿主中,挑取转化子,并提取基因组;使用对应同源臂外侧上下游引物进行验证,验证正确后,将转化子弹出URA3后再依次用上述引物扩增,扩增条带大小均与理论一致,最终测序结果表明构建成功,将成功构建的菌株分别命名为BYD1、BYD2、BYD3、BYD4、BYD5。
2.2 Module II蜡酯合成酶WS2基因的表达
HO位点的敲除不影响宿主细胞及其他生理功能,因此在酿酒酵母染色体整合表达操作中,HO位点成为首要选择。根据PARTOW等人的研究筛选出TDH3、TEF1、PGK1、TPI等启动子均为酿酒酵母中的强启动子[12-13],因此选择其中较优的TDH3启动子以及对应终止子CYC1过表达目的基因WS2,以提高表达效率。
构建了WS2基因整合框质粒,用限制性内切酶Nco I单酶切验证,条带大小与理论一致,测序结果表明WS2基因整合框质粒构建成功。
用上述重组质粒为模板,PCR扩增出相应的整合框,将其通过醋酸锂转化法分别转入宿主BY4741和BYD5中,挑取转化子,并提取基因组;使用对应同源臂外侧上下游引物进行验证,理论上应扩增出2 100 bp的条带,将WS2整合表达在BYD5中且未弹出URA3的菌株命名为BYD5W2*;将转化子弹出URA3后再依次用上述引物扩增,理论上应扩增出2 100 bp的条带,PCR结果与预期大小一致,C1为上述未弹出URA3的对照菌株,见图4。将PCR产物纯化并送公司测序,结果显示构建成功,将成功构建的菌株分别命名为BYW2和BYD5W2。

图4 WS2转化BY4741,BYD5弹URA3验证Fig.4 WS2 transform BY4741 and BYD5 projectile URA3 for verification
蜡酯合成酶基因WS2表达后进行荧光定量PCR验证,如图5所示,以ACT1为内参基因,WS2基因表达量为内参基因ACT1的1.42倍,证明WS2已成功表达。

图5 WS2基因荧光定量PCRFig.5 Fluorescence quantitative PCR of WS2 gene
2.3 FAEE摇瓶发酵优化
FAEE摇瓶发酵过程中,首先对菌株生长情况进行探索,见图6(a)。原始出发菌株BY4741的菌体浓度OD600最大为20.3,BYW2在出发菌株BY4741的基础上有些许提升,菌体浓度OD600达到21.7,而目的菌株BYD5W2相较于BY4741与BYW2生长明显受限,菌体浓度OD600只能达到5.1。由此可见,甾醇酯途径、三酰基甘油途径以及β氧化途径的敲除会阻碍菌株的生长。
从菌株BY4741,BYW2和BYD5W2出发,对FAEE产量进行测定,见图6(b)。在只补加葡萄糖的发酵条件下,菌株BYD5W2的FAEE产量最高,为11.72 mg/L;FAEE不同碳链混标质谱图见图6(c),样品BYD5W2中FAEE检测质谱图见图6(d)。

图6 重组菌BY4741、BYW2、BYD5W2摇瓶水平的细胞生长和FAEE生产Fig.6 Cell growth and FAEE shake-flask production by precom-binant strains of BY4741,BYW2 and BYD5W2
乙醇作为FAEE生产的两大前体物质之一,由于其价格低廉且易获取,通过直接外源添加的方式满足FAEE生产需求;酿酒酵母可以利用油性碳源,使其成为将废油等油性物质转化为有用且廉价的酯化原料的合适宿主。另外,培养基中存在菜籽油等疏水底物,可以触发细胞外脂肪酶的分泌,将植物油水解成甘油和脂肪酸,为FAEE生产提供充足碳源,从而提升FAEE产量。
因此后期对菌株BYD5W2进行发酵优化,从添加乙醇和菜籽油、发酵时间以及乙醇添加模式3个因素考察。如图7(a)所示,只补加葡萄糖发酵时,BYD5W2的FAEE产量为11.72 mg/L,在此基础上补加乙醇,FAEE产量提升到36.1 mg/L,相对于只补加葡萄糖,FAEE产量提升了3.1倍;在此基础上继续补加体积分数2%菜籽油,FAEE产量提升到59.3 mg/L,相对于仅补加葡萄糖时FAEE产量提升了5.1倍。结果表明,FAEE发酵过程中补加乙醇和菜籽油会显著提升FAEE产量。
在摇瓶中添加乙醇和菜籽油,对发酵时间进行优化,分别发酵48、60、72、84、96 h终止发酵,测定FAEE产量。如图7(b)所示,发酵时间为60 h时FAEE产量最高,为59.3 mg/L。
确定发酵时间为60 h后,对乙醇的添加模式进行探索,由于一次性加入过量乙醇会影响菌体生长[5],所以采用分批等量的方式以相同间隔时间进行乙醇的添加。如图7(c)所示,首次补加乙醇时间 取12、16、20、24、28、32、36、40、44、48、52、56 h,发现在20 h开始补加乙醇,每次补加量为体积分数2%,间隔时间为6 h时,FAEE产量最高,为144.4 mg/L。


图7 BYD5W2摇瓶发酵优化Fig.7 BYD5W2 shake flask fermentation optimization
2.4 发酵罐发酵检测FAEE
在摇瓶发酵过程中,BYD5W2生长受到影响,菌体浓度OD600只能达到5.1,这也是限制FAEE产量的重要因素之一,因此采用发酵罐发酵,并对比了尿嘧啶缺陷菌株BYD5W2与尿嘧啶未缺陷菌株BYD5W2*的FAEE产量的差别,如图8(a)所示,尿嘧啶缺陷的BYD5W2菌株最大菌体浓度OD600达到24.8,尿嘧啶未缺陷的BYD5W2*菌株最大菌体浓度OD600可以达到35.2;如图8(b)所示,尿嘧啶缺陷的BYD5W2菌株的FAEE最高产量为0.618 g/L,而尿嘧啶未缺陷的BYD5W2*菌株的FAEE最高产量达到了1.35 g/L。
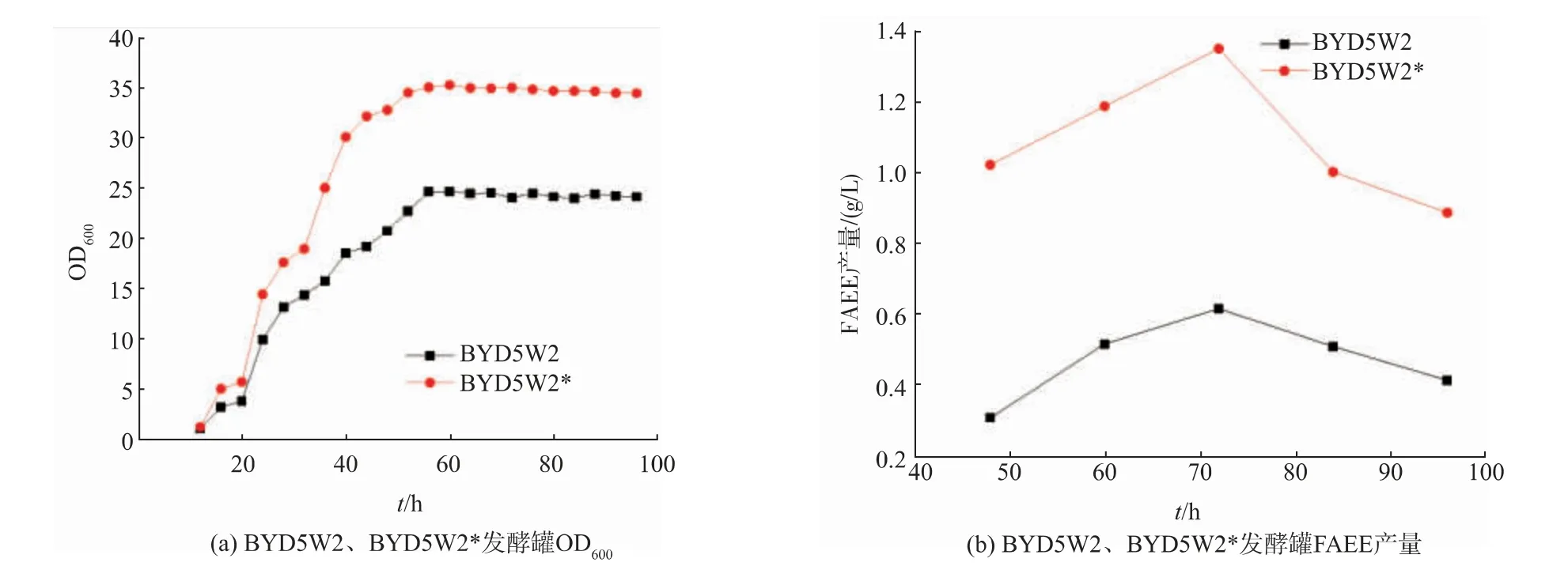
图8 5 L发酵罐水平优化FAEE生产Fig.8 Optimization of FAEE production in 5 L bioreator
3 结 语
作者对酿酒酵母代谢途径进行改造,阻断甾醇酯途径、三酰基甘油途径和β氧化途径以减少脂肪酰辅酶A的分流,成功构建了不同突变株菌株;利用同源重组在HO位点整合表达了根据酿酒酵母密码子优化的外源蜡酯合成酶基因WS2,在WS2的酯化作用下乙醇和脂肪酰辅酶A形成FAEE.为了提升FAEE产量,摇瓶发酵阶段对是否添加乙醇和菜籽油、发酵时间以及乙醇添加模式这3个方面进行优化,与此同时进行发酵罐发酵进一步提升FAEE产量,获得以下结论:
阻断甾醇酯途径、三酰基甘油途径和β氧化途径显著提升了FAEE产量,相较于BYW2菌株FAEE产量提升了9倍。以BYD5W2为出发菌株,FAEE发酵过程中补加乙醇和体积分数2%菜籽油会显著提升FAEE产量,达到59.3 mg/L,相对于只添加葡萄糖发酵的FAEE产量提升了5.1倍;最佳发酵时间为60 h,从20 h开始分批定量补加体积分数2%的乙醇,间隔补加时间为6 h时,FAEE产量最高,达到144.4 mg/L,相对于只添加葡萄糖发酵菌株BYD5W2的FAEE产量提升了12.3倍。发酵罐发酵比较了尿嘧啶缺陷菌株BYD5W2与尿嘧啶未缺陷菌株BYD5W2*的FAEE产量的差别,结果表明,尿嘧啶未缺陷菌株BYD5W2*的FAEE产量最高,达到1.35 g/L,是目前报道的酿酒酵母中产FAEE产量较高的水平。

