邻苯二甲酸单甲酯对大鼠血液生化指标的影响及毒理研究
高旭,于霞,李信薇,池振兴,3,*
1. 哈尔滨工业大学(威海)海洋科学与技术学院,威海 264209 2. 威海环境再生能源有限公司,威海 264200 3. 浙江省污染暴露与健康干预重点实验室,杭州 310015
邻苯二甲酸酯类(phthalate esters, PAEs)能够增加塑料制品的可塑性[1],其在工业生产过程中常作为增塑剂被应用于医疗器械、洗涤护理产品、清洁剂、化妆品和食品包装等各个领域[2],与人们日常生活息息相关。相关产品在生产、使用和处置过程中,可不断释放PAEs到环境中[3],污染土壤[4]、水体[5]和大气[6]。环境中的PAEs能够通过皮肤接触、呼吸和进食等多种途径进入人体[7-8],危害机体健康。血液是人体极其重要的组织,具有携氧、免疫、物质运输、调节体温及信息传递等多种功能。进入人体的部分PAEs会被血液吸收,并在内源性酯酶的作用下被水解代谢为相应的邻苯二甲酸单酯(mPAEs)[9]。此外,环境中的mPAEs也能以各种方式进入生物体血液[10-12]。研究人员已经在男性血液、母血和脐带血中检测到了mPAEs的存在[13-14]。存在于血液中的PAEs及其代谢产物随血液循环被输送到全身各处,损害体内的组织和器官,引发疾病。
目前,关于PAEs及其代谢产物毒性的研究主要集中在生殖发育、神经和遗传等方面[15-21],涉及血液毒性及其作用机制的研究鲜有报道,且研究对象主要针对分子量较大、毒性较强的邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸二正丁酯(DBP)、邻苯二甲酸丁苄酯(BBP)及其代谢产物邻苯二甲酸单(2-乙基己基)酯(MEHP)、邻苯二甲酸单丁酯(MBP)、邻苯二甲酸单苄酯(MBzP)。张弘等[22]的研究表明,DEHP(500 mg·kg-1)亚慢性染毒90 d会使大鼠白细胞、红细胞数量及血红蛋白含量显著下降。另有研究表明,MEHP也与血液中血红蛋白含量的下降有关[23-24]。Sicińska[25]通过体外实验发现,DBP、BBP(25 μg·mL-1)及其代谢产物MBP、MBzP(250 μg·mL-1)会使红细胞出现溶血现象。此外,DBP、BBP、MBP和MBzP还会增加离体红细胞中活性氧(ROS)含量,改变其抗氧化酶(超氧化物歧化酶(SOD)、过氧化氢酶(CAT))活性,使胞内高铁血红蛋白(MetHb)含量升高[26]。
邻苯二甲酸二甲酯(dimethyl phthalate, DMP)作为一种分子量较低的PAEs已经被列入我国优先污染物黑名单[27],其一级代谢产物邻苯二甲酸单甲酯(monomethyl phthalate, MMP)具有急性毒性、致畸和致癌活性[28-29]。目前,DMP和MMP在人体的各种体液中均已被检测到[30-32]。Babu-Rajendran等[33]采用气相色谱-质谱联用法测定了人体尿液中的PAEs,发现尿液中DMP的浓度范围为nd~141 ng·mL-1。陈甘讷等[34]的研究表明,MMP在孕妇分娩后母血和脐血中的浓度分别为1.89~2.07 μg·L-1和2.41~2.67 μg·L-1。针对研究现状的不足,本实验选取MMP(DMP的代谢产物)为研究对象,以Sprague Dawley(SD)大鼠为受试动物,通过检测血细胞(红细胞、白细胞、淋巴细胞和中性粒细胞)数量、血液生化指标(总胆固醇、尿素氮、总蛋白和碱性磷酸酶)以及氧化应激水平(抗氧化酶SOD、CAT和丙二醛(MDA))以探究MMP(50、250和500 mg·kg-1)对大鼠血液的毒性影响及作用机制,有助于完善PAEs类代谢物对血液毒性效应的研究,为其风险评价和相关疾病预防提供科学依据。
1 材料与方法(Materials and methods)
1.1 主要仪器设备与试剂耗材
主要仪器设备:动物版血液分析仪(HF-3800,济南汉方医疗器械有限公司,中国)、紫外-可见分光光度计(岛津UV-1700,Shimadzu,日本)、离心沉淀机(80-2,上海荣泰生化有限公司,中国)、数显恒温水浴锅(HH-S,常州翔天实验仪器厂,中国)、旋涡混合器(XH-C,金坛市白塔新宝仪器厂,中国)、电热鼓风干燥箱(101-00A,上海路韵仪器设备有限公司,中国)。
主要试剂耗材:邻苯二甲酸单甲酯(MMP;分析纯,国药集团化学试剂有限公司,中国)、乙酸(冰醋酸;分析纯,国药集团化学试剂有限公司,中国)、肝素钠(heparin sodium salt;185 USP units·mg-1,上海麦克林生化科技有限公司,中国)、长寿花金胚玉米油(山东三星玉米产业科技有限公司,中国);总超氧化物歧化酶(total superoxide dismutase, T-SOD)测试盒、过氧化氢酶(catalase, CAT)测试盒、丙二醛(malonicdialdehyde, MDA)测试盒、总胆固醇(total cholesterol, T-CHO)测试盒、尿素氮(BUN)测试盒、总蛋白(total protein, TP)定量试剂盒、酸性磷酸酶(acid phosphatase, ACP)试剂盒(南京建成生物工程研究所,中国)。
1.2 实验动物
本研究选用的SD大鼠购自正规畜牧中心,所有大鼠均健康。在实验过程中,大鼠被饲养在实验室动物房中,温度控制在18~25 ℃,相对湿度控制在(55±5)%,接受正常光照,可自由获取标准动物饲料和经过滤的自来水。按照本地法规进行动物实验。
1.3 实验方法
1.3.1 SD大鼠染毒及采血
设置3个不同剂量的染毒组(低剂量50 mg·kg-1、中剂量250 mg·kg-1、高剂量500 mg·kg-1)和对照组,每组选用3只SD大鼠,按照体质量计算出每只大鼠灌胃所需MMP质量,用玉米油配成1.5 mL染毒液,对大鼠灌胃染毒。对照组灌胃等量的1.5 mL玉米油。
染毒结束后,用固定器将SD大鼠固定,在鼠尾中下部涂抹75%酒精消毒,用5.5号静脉输液针扎入静脉采集所需血液。
1.3.2 血细胞检测
将SD大鼠灌胃染毒3 h后,从尾部采集血液至EDTA-K2抗凝管中,使用HF-3800动物版血液分析仪的全血模式检测血液中红细胞、白细胞、淋巴细胞和中性粒细胞的数量,记录检测结果。
1.3.3 血液生化指标检测
对SD大鼠灌胃染毒24 h(禁食12 h)和连续染毒7 d(每天同一时间灌胃染毒)后,从大鼠尾部取全血于离心管中,以3 000 r·min-1将血样离心15 min,取上层血清用于检测血液中总胆固醇、总蛋白的含量及酸性磷酸酶的活性。从大鼠尾部采取染毒24 h和连续染毒7 d后的全血于肝素抗凝离心管中,在3 000 r·min-1条件下离心15 min,取上层血浆用于检测血液中的尿素氮含量。根据总胆固醇、尿素氮、总蛋白和酸性磷酸酶试剂盒说明书上的操作步骤,使用紫外-可见分光光度计检测。
1.3.4 血液氧化应激水平检测
对SD大鼠灌胃染毒3 h后,从尾部取全血于离心管中。将血样以3 000 r·min-1离心15 min,取上层血清用于检测血液中SOD、CAT活性和MDA含量。根据SOD、CAT和MDA试剂盒说明书上的操作步骤,使用紫外-可见分光光度计检测。
1.4 数据分析
用Origin 2018和SPSS 25.0软件计算平均值和标准差,对各组红细胞、白细胞、中性粒细胞和淋巴细胞等血细胞数量,总胆固醇、尿素氮、总蛋白的含量和酸性磷酸酶活性等血液生化指标,以及SOD、CAT的活性和MDA含量等氧化应激指标之间的差异性进行单因素方差分析(One-Way ANOVA),方差齐性采用LSD检验,并绘制柱状图。
2 结果(Results)
2.1 MMP对SD大鼠血液中血细胞数量的影响
染毒3 h后,MMP对大鼠血液中红细胞、白细胞、淋巴细胞和中性粒细胞的毒性影响如表1所示。统计分析表明,随着MMP剂量的增加,SD大鼠血液中红细胞、白细胞、淋巴细胞和中性粒细胞数量总体上均呈现下降趋势。低、中、高剂量染毒组红细胞数量与对照组相比分别下降1.11%、4.7%和9.13%,但均无显著差异(P>0.05)。淋巴细胞和中性粒细胞数量呈现低剂量兴奋效应[35],高剂量组白细胞、淋巴细胞和中性粒细胞数量与对照组相比分别下降43.57%、30.7%和26.44%,均有显著性差异(P<0.05)。这表明,MMP会导致大鼠血液中的血细胞数量出现不同程度的降低。
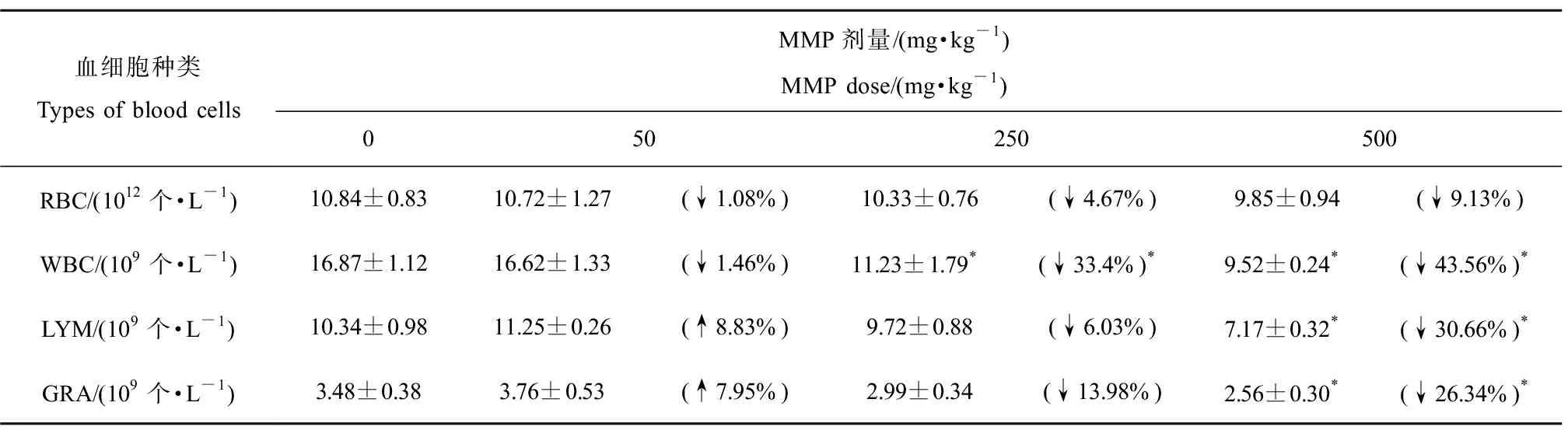
表1 不同剂量邻苯二甲酸单甲酯(MMP)染毒3 h后对SD大鼠血液中血细胞数量的影响Table 1 The number of blood cells of SD rats after monomethyl phthalate (MMP) exposure for 3 h
2.2 MMP对SD大鼠血液生化指标的影响
染毒24 h和连续染毒7 d后,MMP对大鼠血液总胆固醇、尿素氮、总蛋白含量和酸性磷酸酶活性的影响如图1所示。
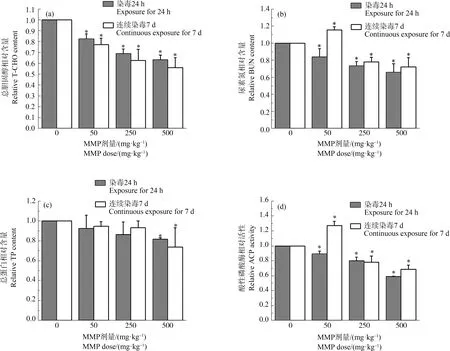
图1 不同染毒时间下MMP对SD大鼠血液生化指标的影响注:T-CHO表示总胆固醇,BUN表示尿素氮,TP表示总蛋白,ACP表示酸性磷酸酶;*表示染毒组与对照组有显著性差异(P<0.05)。Fig. 1 Blood biochemical indexes of SD rats after MMP exposure for different timeNote: T-CHO stands for total cholesterol, BUN stands for blood urea nitrogen, TP stands for total protein, and ACP stands for acid phosphatase; * indicates significant difference from the control (P<0.05).
随着MMP剂量增大,大鼠血液中总胆固醇含量均呈现出下降趋势,且连续染毒7 d后下降得更快(图1(a))。染毒24 h后,低、中、高剂量组总胆固醇含量分别下降17.47%、31%和36.67%,与对照组相比均差异显著(P<0.05)。连续染毒7 d后,与对照组相比,低、中、高剂量组总胆固醇含量分别下降22.97%、37.4%和43.97%,均有显著差异(P<0.05)。连续染毒7 d后,各剂量组总胆固醇含量均比染毒24 h后低,且500 mg·kg-1剂量下总胆固醇含量为最低。这表明,摄入MMP的时间越久、剂量越大总胆固醇含量降低越快,对血液损害越大。
MMP均会导致血液中尿素氮含量减少,且总体呈现下降趋势(图1(b))。其中,染毒24 h后,低、中、高剂量组尿素氮含量和对照组相比差异均显著(P<0.05),分别下降15.97%、26.43%和34.33%。连续染毒7 d后,尿素氮含量呈现低剂量兴奋效应,中、高剂量MMP使尿素氮含量较对照组分别下降22.13%和28%,差异显著(P<0.05)。这表明,短时间摄入不同剂量MMP均会使大鼠血液尿素氮含量减少;而长时间摄入低剂量MMP时,大鼠血液尿素氮含量会升高;MMP剂量增大后,血液中尿素氮含量会减少。
血液中总蛋白含量均随着MMP剂量增加而减少,呈下降趋势,但连续染毒7 d后下降趋势较慢(图1(c))。其中,高剂量MMP染毒24 h和连续染毒7 d后,总蛋白含量分别减少18.25%和26.35%,与对照组相比差异显著(P<0.05);连续染毒7 d后高剂量组的总蛋白含量最低。这表明,长时间高剂量摄入MMP会使大鼠血液总蛋白含量大幅降低。
MMP能使大鼠血液中酸性磷酸酶活性下降(图1(d))。其中,染毒24 h后,血液中酸性磷酸酶活性随着MMP染毒剂量的增加而下降,低、中、高剂量组较对照组分别显著下降10.63%、19.93%和41.37%(P<0.05)。连续染毒7 d后,低剂量组酸性磷酸酶活性与对照组相比显著上升27.4%(P<0.05),呈现低剂量兴奋效应;中、高剂量MMP分别使酸性磷酸酶活性显著下降21.87%和31.43%(P<0.05)。这表明,无论短时间还是长时间,摄入MMP剂量越大,大鼠血液中酸性磷酸酶活性越低。
2.3 MMP染毒后SD大鼠血液氧化应激水平
不同剂量MMP染毒3 h后,大鼠血液中SOD、CAT相对活性及MDA相对含量如图2所示。
随着MMP剂量增加,SOD活性呈下降趋势(图2(a))。与对照组相比,低、中、高剂量MMP使SOD活性分别下降3.6%、11.7%和17.5%(P>0.05)。这表明,MMP能够抑制SOD活性,但影响较小。
各剂量MMP对大鼠染毒3 h后,血液中CAT活性均低于对照组,且随着MMP剂量的增加呈现下降趋势(图2(b))。低、中、高剂量染毒组CAT活性与对照组相比分别下降19.57%、24.13%和57.68%(P<0.05)。这表明,MMP会使CAT活性下降,损害血液的抗氧化防御体系。
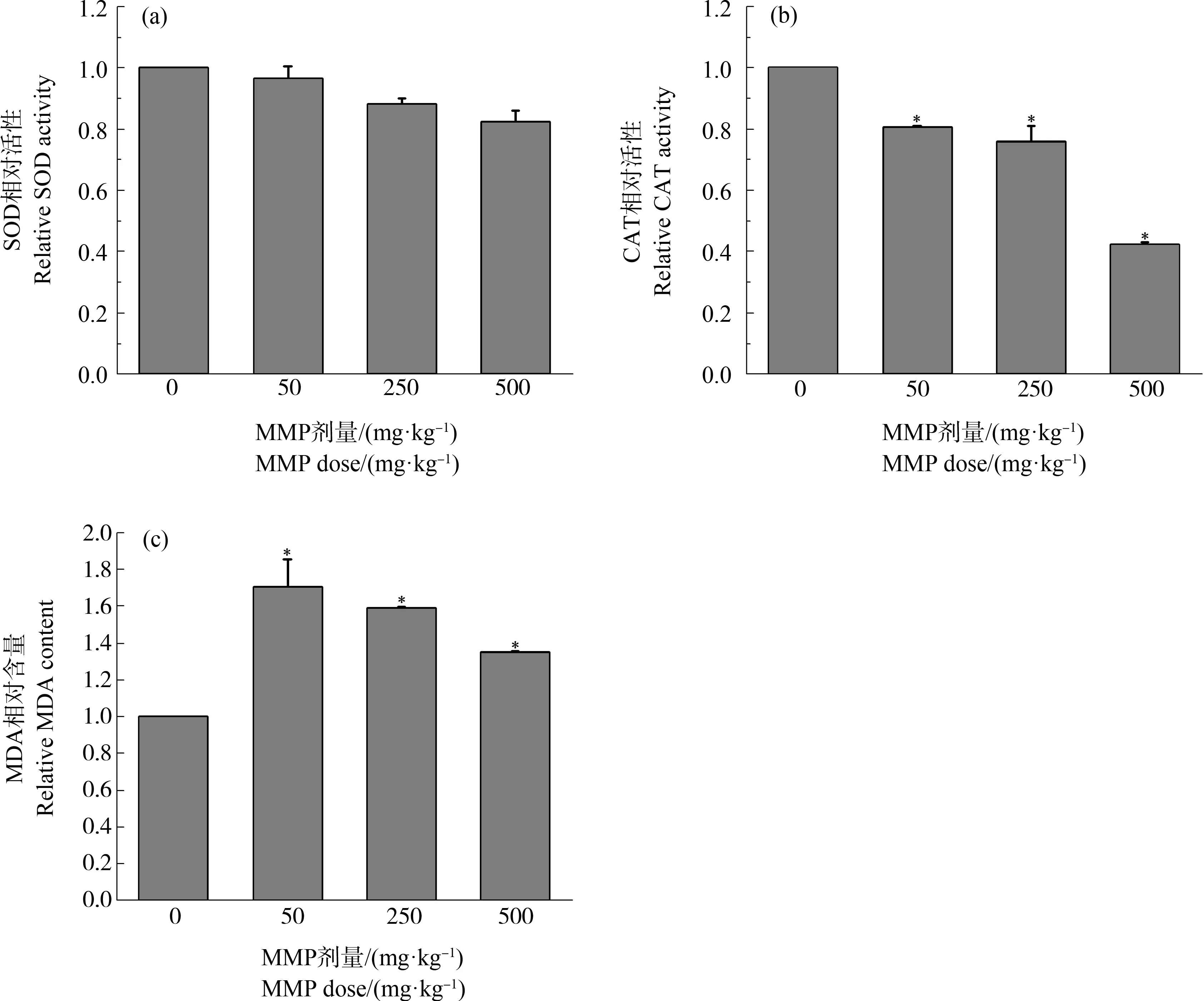
图2 不同剂量MMP染毒3 h后大鼠血液氧化应激水平注:SOD表示超氧化物歧化酶,CAT表示过氧化氢酶,MDA表示丙二醛;*表示染毒组与对照组有显著性差异(P<0.05)。Fig. 2 Oxidative stress level in the blood of SD rats after MMP exposure for 3 h Note: SOD stands for superoxide dismutase, CAT stands for catalase, and MDA stands for malonic dialdehyde; *indicates significant difference from the control (P<0.05).
不同剂量染毒组MDA含量均高于对照组,且均有显著差异(P<0.05) (图2(c))。与对照组相比,低、中、高剂量组MDA含量分别升高70.43%、59%和34.8%。这表明,MMP进入机体后能够诱导血液发生氧化应激反应,引起血液MDA含量升高。
3 讨论(Discussion)
3.1 MMP对SD大鼠血液功能的影响
血液是机体重要的组织,由血细胞和血浆组成,具有携氧、免疫等功能。血细胞包括红细胞、白细胞和血小板。大量研究证实,红细胞的主要功能是运输氧气和二氧化碳[36-37],同时还具有免疫功能,参与免疫应答调节[38-39]。白细胞是血液中执行免疫功能最主要的细胞[40],其能够通过吞噬细菌等途径来抵御和杀死入侵的病原体[41],对机体防御系统的建立有重要意义。淋巴细胞和中性粒细胞均属于白细胞,分别在机体特异性和非特异性免疫功能方面发挥重要作用[41-43]。
已有研究表明,PAEs会造成血细胞数目下降,影响机体的免疫功能[44],但对其代谢物的影响仍不明确。本研究结果显示,MMP(DMP的代谢产物)会对血液中红细胞、白细胞、淋巴细胞及中性粒细胞造成不同程度的损伤,使其数目下降;且随着MMP剂量的增大,细胞数目下降愈发明显(表1)。这表明,作为PAEs类代谢物MMP也会使血液中的血细胞数量减少,进而造成血液的携氧和免疫等功能下降。
临床上,红细胞、白细胞、淋巴细胞和中性粒细胞也常作为诊断病理变化的重要依据。红细胞数量下降意味着机体可能出现贫血、白血病等疾病;白细胞数目减少代表机体的造血功能出现障碍;淋巴细胞数目偏低会导致机体免疫缺陷;中性粒细胞数量减少表明机体受到化学损伤,出现骨髓造血异常等疾病。由此推测,MMP会影响血液的携氧和免疫等功能,进而可能会引发机体出现贫血、免疫缺陷及骨髓造血功能障碍等疾病。
3.2 MMP对SD大鼠血脂代谢、肾、肝功能的影响
总胆固醇是反映机体内脂肪代谢水平的一项重要指标[45],其含量过多过少都会对机体产生危害。Zhu等[46]研究发现PAEs类代谢物会使胆固醇含量下降。本研究也得到了相似的结果,无论短时间还是长时间摄入MMP,机体血液总胆固醇含量均呈现下降趋势(图1(a))。这表明,MMP会影响血液中脂质的新陈代谢水平。
尿素氮是蛋白质代谢的终末产物,其常作为机体肾功能评价的重要指标[47]。在正常情况下,尿素氮会被肾小球滤过排出体外,若其含量偏低则代表着肾功能失调,含量偏高则意味着过滤功能可能失效,造成器质性肾功能损害。本研究中,机体摄入MMP后,血液中尿素氮含量下降(图1(b))。这表明,MMP会影响机体肾功能,导致其功能失调。
总蛋白含量能够反映肝脏的合成功能以及储备能力[48]。酸性磷酸酶也是描述机体肝功能的一个重要指标[49]。本研究发现,MMP会使血液中总蛋白含量以及酸性磷酸酶活性下降(图1(c)、图1(d))。总蛋白含量下降可能是因为机体摄入MMP后使肝细胞受损,肝脏合成功能出现障碍,最终导致其合成蛋白质减少。由于PAEs类代谢物具有亲脂性容易渗入膜脂质[50],因此推测酸性磷酸酶活性下降可能是因为MMP与溶酶体膜相互作用,抑制了酸性磷酸酶的释放,也可能因为MMP妨碍了溶酶体和质膜的融合,阻止酸性磷酸酶分泌到胞外而导致其活性下降[51]。总蛋白含量和酸性磷酸酶活性下降均反映出MMP对肝功能有一定影响。由于肝脏是胆固醇和尿素氮合成的主要场所,因此推测两者含量的下降也可能是肝功能受损造成的[52-53]。
综上所述,机体摄入MMP后,会导致血脂代谢能力以及肾、肝功能受损。临床上,总胆固醇含量偏低意味着机体可能出现肝硬化、贫血等疾病。尿素氮含量减少表明机体肾功能出现障碍且可能有严重的肝脏疾病。总蛋白含量偏低代表机体可能患有肾炎、肝炎和肝硬化等疾病。酸性磷酸酶活性下降代表机体可能患有贫血、肾炎等疾病。本研究中,4个指标相互印证,且与3.1推测相吻合,因此MMP可能会诱导机体出现贫血、肾炎、肾功能障碍、肝炎和肝硬化等疾病。
3.3 MMP对SD大鼠血液抗氧化能力的影响
氧化应激(oxidative stress, OS)是指机体氧化与抗氧化平衡被破坏,生成过多的氧自由基而无法被清除,从而对机体产生的一种负面作用[54]。由于氧自由基可以直接或间接氧化DNA、脂质和蛋白质,诱发基因突变、脂质过氧化以及蛋白质变性,因此氧化应激通常被认为是污染物对机体产生毒性的作用机制之一[55]。已有研究表明,苯、四氯化碳及重金属铅、镧、钛等污染物能够通过氧化应激引起机体造血、肾、肝功能受损,进而诱发贫血、造血功能障碍、肾炎、肾功能失调以及肝炎、肝硬化等疾病[56-60]。因此,笔者从氧化应激的角度探究MMP对大鼠血液、肾、肝损伤的可能作用机制。
SOD和CAT作为机体抗氧化酶系极其重要的组成部分,其存在可以减轻氧化应激产生的损伤[61]。其中,SOD能够催化超氧阴离子进行歧化反应[62],清除有害的超氧化物自由基;CAT能够催化过氧化氢将其迅速转化为无害或毒性较小的物质[63],防止过氧化氢过多积累对机体造成损伤。本研究发现,机体摄入MMP后会使血液中SOD和CAT活性下降,且随着MMP剂量的增加,SOD和CAT活性呈现出下降趋势(图2(a)、图2(b))。这表明,MMP能够抑制血液中抗氧化酶SOD和CAT的活性,进而损害血液的抗氧化系统。
MDA作为脂质过氧化物的产物,其含量的多少可以反映出机体氧化损伤的程度[64]。本研究发现,各剂量MMP染毒组的MDA含量均高于对照组(图2(c))。这表明,机体摄入MMP后导致血液抗氧化防御体系受损,清除自由基的能力下降,引起氧化应激反应,对血液造成损伤。Holland等[65]研究发现妇女妊娠期尿液中的某些PAEs类代谢物会引起8-异丙醇烷(脂质过氧化的生物标志物)水平升高,使机体发生抗氧化损伤及氧化应激反应。本研究结果与之相符。
综上所述,MMP作为PAEs类代谢物的一种,会使血液的抗氧化能力下降,诱发氧化应激反应,从而对血液中血细胞以及血液生化指标产生影响,损害血液的携氧、免疫等功能;血脂的代谢能力以及机体的肾、肝功能,推测MMP进而可能引发机体发生贫血、造血功能障碍、肾功能失调以及肝硬化等相关疾病。本研究有助于明确邻苯二甲酸酯类代谢物对血液的毒性效应,并为其潜在的风险评估和相关疾病的预防提供一定的理论指导。

