双酚A类似物的生殖毒性及人体生殖健康风险研究进展
魏锦博,何正宇,王昌泽,户业丽,汪畅,曹慧明,曹梦西,*,梁勇
1. 武汉工程大学环境生态与生物工程学院,武汉 430205 2. 江汉大学环境与健康学院,武汉 430056 3. 上虞新和成生物化工有限公司,绍兴 312300
双酚A(bisphenol A, BPA)于1891年被首次合成,作为聚碳酸酯和环氧树脂等高分子材料的合成原料和显色剂,在工业生产中被广泛使用[1-3],是全球年均生产量最大的化学原料之一[4]。至2013年,BPA全球年产量已超过580万t,且仍有增长趋势[5]。塑料或涂层制品中的BPA在长时间的高温、酸碱或紫外辐射下,可通过水解或氨解迁移至食物、环境和皮肤[6-8],进而被人体接触并摄入。目前已在多种环境介质、人体介质中检出BPA,包括空气、室内灰尘、地表水、废水和沉积物等环境样品[9-11]以及包括人类在内多种动物的血液、尿液、唾液、毛发、母乳和羊水等生物样本[12-15],甚至在母体胎盘、脐带血和新生儿尿液中也有检出[7, 16]。进入人体的BPA可与多种受体相互作用,如雌激素受体(ER)、雄激素受体(AR)、雌激素相关受体γ(ERRγ)、甲状腺激素受体(TR)和芳香烃受体(AHR)等[17-19],对人体内分泌系统产生干扰,甚至会对后代的生长发育和生殖功能造成危害[7, 20-23]。流行病学调查显示性欲减退、生殖障碍、多囊卵巢综合征、出生缺陷和包括乳腺癌在内的多种癌症发生等都与BPA的持续暴露有关[5, 8, 20, 24-28]。正因如此,BPA于2008年和2017年先后被美国国家毒理学计划(National Toxicology Program, NTP)和成员国委员会(Member State Committee, MSC)列为环境内分泌干扰物(environmental endocrine-disrupting chemical, EDC)[8]。
随着2008年开始各国陆续发布法律条令限制BPA在塑料制品中的使用[1, 12],BPA替代物的开发成为工业生产亟待解决的问题,这直接刺激了与BPA结构类似的其他双酚类化合物(BPs),如双酚S(bisphenol S, BPS)、双酚F(bisphenol F, BPF)、双酚AF(bisphenol AF, BPAF)、双酚B(bisphenol B, BPB)、双酚E(bisphenol E, BPE)、双酚C(bisphenol C, BPC)、双酚Z(bisphenol Z, BPZ)、双酚FL(bisphenol FL, BPFL)、双酚AP(bisphenol AP, BPAP)、双酚BP(bisphenol BP, BPBP)、双酚M(bisphenol M, BPM)和双酚P(bisphenol P, BPP)等BPA类似物的开发、生产和工业应用。随着BPA类似物的不断投产和使用,越来越多BPA类似物在食物、空气、室内灰尘、水体和沉积物等环境样本和人体尿液、血清等生物样本中被检出,人类尿液排泄数据表明世界人类BPs日均摄入量为每人0.06~0.68 μg·d-1,而另一项研究表明人类血清中各BPs中位数水平为0.07~11.94 ng·mL-1,尽管部分BPs可由人体代谢排出,但BPs对人体的持续暴露仍然增加了体内游离BPs风险[9, 29-35]。且实验表明多种BPA类似物(如BPB、BPF和BPE等)可通过胎盘转移[36],提示BPA类似物的生物安全性有待进一步研究。研究表明,BPA类似物与BPA具有相似的生殖内分泌干扰效应,且部分类似物所展现的生殖毒性比BPA更强[2, 17, 25, 31, 37-39]。
相较于BPA而言,双酚类似物的生殖毒性及相关分子机制的研究较少,这阻碍了对BPA及其类似物于环境安全和人体健康的综合评价。本文将综述近年来国内外针对BPA类似物的生殖毒性、致毒分子机制和人体生殖健康风险的研究进展、存在的问题及展望。
1 BPA类似物的生殖毒性效应(Reproductive toxic effects of BPA analogues)
针对BPA类似物生殖毒性的探索主要来源于小鼠、大鼠和斑马鱼等模式动物,下文则是在动物研究的基础上对BPA类似物对雄性及雌性生殖系统的影响做出的统计。
1.1 BPA类似物对雄性生殖系统的影响
BPA类似物对雄性动物生殖系统的危害主要体现在一些生殖毒性指标的改变,包括雄性的性器官及性附器官质量、性器官组织学变化、生殖细胞发生过程、精子产量及活力、体内激素含量、类固醇激素合成相关基因的表达、卵黄蛋白原表达量(斑马鱼)、氧化应激反应、表观遗传变化和后代数量及健康程度(表1)。值得注意的是环境浓度、低浓度和较高浓度BPs暴露对精子数量及质量均会产生不良影响,以环境相关浓度的BPS(10 ng·kg-1·d-1)[40]暴露小鼠后会破坏睾丸组织结构致使精子数量显著下降,经BPF(25 μg·L-1)[41]、BPAF(25 mg·kg-1·d-1)[42]、BPB(37.5 mg·kg-1·d-1)[43]和BPE(10 mg·kg-1·d-1)[44]暴露的小鼠中观察到同样的现象,其会破坏睾丸及附睾组织,而除了致使精子数降低,BPs还会显著降低精子活力,最终造成小鼠生育能力下降,这可能与BPs暴露导致雄性生殖系统氧化应激水平的增加有关[41-43,45-46](表1)。除BPC和BPFL,不同剂量BPA类似物暴露雄性动物后均会提高体内雌二醇(E2)水平,显示出同BPA相似的类雌激素效应[41,46-49]。BPC(0.5 μmol·L-1)暴露青鳉8 h便可引起体内雌激素响应生物标记基因的表达水平显著升高,引起生殖调控系统紊乱[50]。与其他BPs有所不同的是,BPS(10 mg·kg-1·d-1)和BPE(0.05 mg·kg-1·d-1)暴露后引起小鼠体内睾酮(T)水平升高,这可能与不同暴露方式下的BPs在体内不同代谢过程所导致的生物体组织浓度差异有关[44](表1)。除此之外,BPs暴露甚至会引起多代毒性效应,BPS(50 μg·kg-1·d-1)和BPE(50 μg·kg-1·d-1)暴露孕鼠,会对F3代小鼠的生殖系统产生损害,这可能是雄鼠睾丸的表观遗传修饰发生改变所致[51-52]。

表1 双酚A(BPA)类似物对雄性动物生殖系统的危害Table 1 The effect of bisphenol A (BPA) analogies on male reproductive systems
1.2 BPA类似物对雌性生殖系统的影响
BPs于雌性生殖健康的研究中,子宫和卵巢质量(相对质量及绝对质量,湿质量及干质量)、性腺体质量比、卵巢中各时期卵泡数量和结构变化、青春期启动时间、发情周期和受精时间、怀孕率、体内激素水平、类固醇激素生成酶相关基因表达、分娩情况及后代存活率、氧化应激水平、表观遗传修饰变化以及后代生殖健康等方面是主要靶点。在环境浓度、低浓度和较高浓度下,不同实验动物中的研究均表明BPA类似物会对雌性动物的生殖系统造成损害,如表2所示。BPS(10 μg·kg-1·d-1)[53-54]、BPF(50 mg·kg-1·d-1)[54]、BPB(5 mg·kg-1·d-1)[54]、BPC(45 mg·kg-1·d-1)[55]、BPZ(30 mg·kg-1·d-1)[56]、BPAP(80 μg·kg-1·d-1)[57]和BPFL(2 mg·kg-1,每3 d给药1次)[45]暴露后均会显著改变实验对象的子宫或卵巢质量,并影响卵巢中各时期卵泡的发育、数量以及卵母细胞质量,表明雌性动物的生殖系统同样是BPs的主要作用靶点。上述BPs会显著影响实验动物体内的E2水平,同时改变睾酮(T)、孕酮(P)、黄体生成素(LH)和促卵泡生成素(FSH)等在雌性动物生殖系统发育及繁殖中起重要作用的激素水平,扰乱激素平衡,严重干扰内分泌,从而损害生殖健康(表2)。在去除卵巢的SD大鼠暴露于BPAF(50 mg·kg-1·d-1)或BPC(45 mg·kg-1·d-1)后,其子宫出现雌激素样变化,表明BPAF和BPC具有强雌激素效应[55]。孕期暴露BPS(50 μg·kg-1·d-1)或BPE(50 μg·kg-1·d-1)致使F3代雌性小鼠出现性早熟、发情周期紊乱、怀孕率降低和幼鼠存活率降低等问题,产生多代毒性效应[58]。
2 BPA类似物生殖毒性的分子机制(Molecular mechanisms of reproductive toxicity of BPA analogues)
研究者已发现BPs对生殖系统的多种危害(表1和表2)[40-50,52-56,58-59,60-68]。对BPs生殖毒性分子机制的研究一直持续探索着。对BPs生殖毒性的分子机制研究最早从BPA开始,其化学结构决定了它与雌激素受体(ER)具有一定的亲和性。而随着研究的深入,发现BPA除了能与E2竞争性结合ER外还会对雄激素受体(AR)、雌激素相关受体γ(ERRγ)、甲状腺激素受体(TR)和芳香烃受体(AHR)等生物体内核受体产生干扰作用。除了核受体,BPA与膜相关雌激素受体——G蛋白偶联受体30(G protein-coupled receptor 30, GPR30)也表现出很强的结合亲和力。BPA通过对以上与生物体生殖相关受体产生干扰,从而扰乱生物体内激素的正常功能并最终对生殖功能造成损害。BPA类似物生殖毒性的分子机制研究大多是基于BPA类似物与BPA结构上的相似性,利用细胞、体外竞争性结合受体和计算机模拟的方法进行研究和探讨。
2.1 雌激素受体途径
BPA可与E2竞争性结合ER(包括ERα、ERβ),尽管其对ER的结合亲和力仅有E2的千分之一,但即使是低剂量的BPA也具有生殖毒性[1]。由于BPA与2种ER亚型的配体结合域结合后引起的ER构象变化的不同使得BPA同E2一样是ERα的激动剂,而成了ERβ的拮抗剂。BPA与ER的作用方式分为基因组作用模式和非基因组作用模式。经典基因组模式为BPA与细胞内的ERα和ERβ完全结合,形成配体-受体复合物,通过与细胞核内的雌激素反应元件(estrogen responsive element, ERE)结合调控靶基因表达;非基因组作用模式中BPA通过与细胞膜上的ERα和ERβ结合使其活化并与膜内其他信号蛋白(如生长因子受体等)相互作用,从而形成多分子复合物介导快速信号传导的发生[69]。非基因组模式下BPA可通过活化ERα介导的核外信号激活ERK/MAPK、PI3K/Akt和Ca2+流(与E2作用模式相同)以及抑制ERβ介导的p38/MAPK信号通路(与E2作用模式相反)发挥作用[70],不少研究表明BPA的非基因组雌激素活性与E2相当[71]。
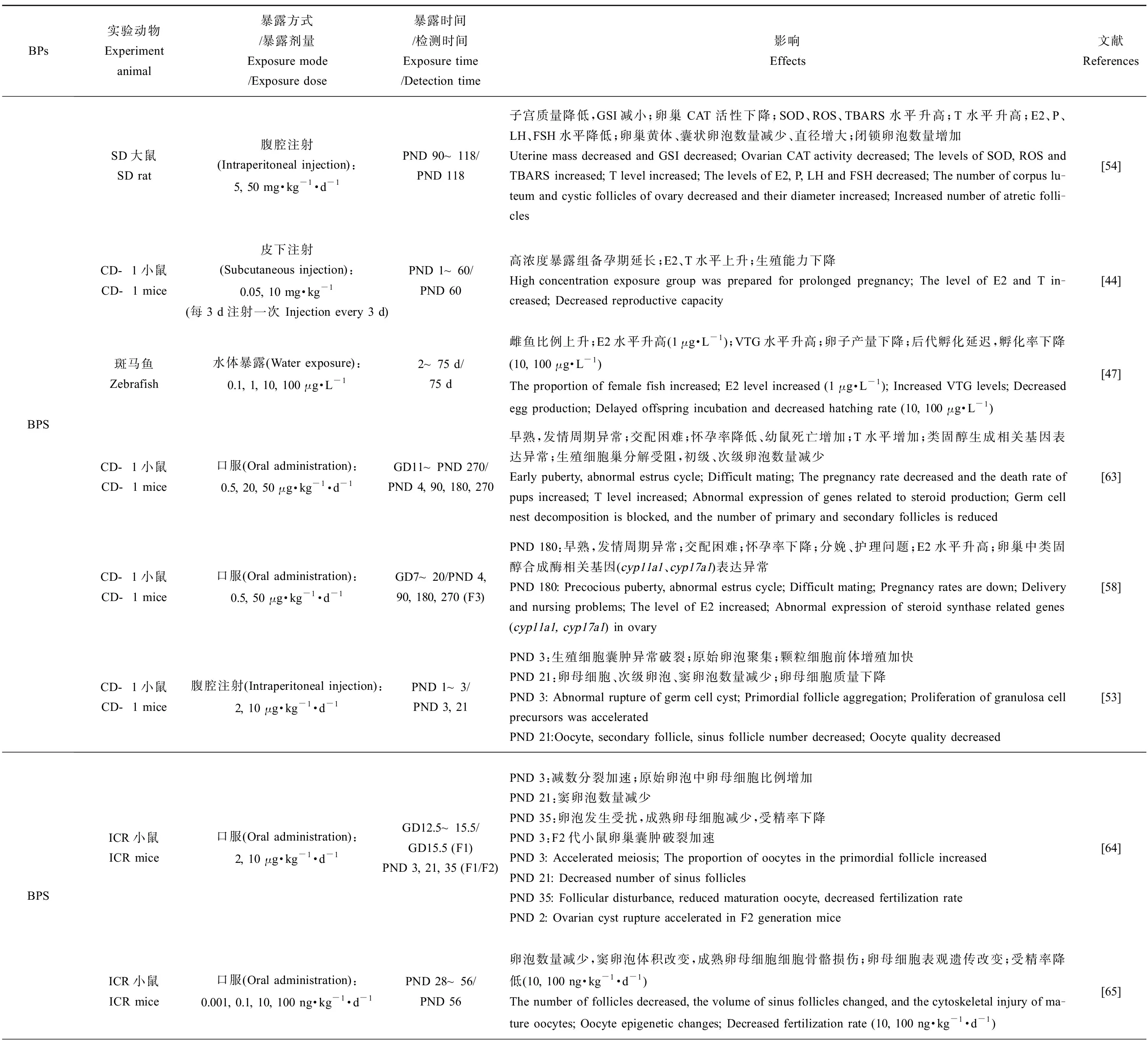
表2 BPA类似物对雌性动物生殖系统的危害Table 2 The effect of BPA analogies on female reproductive systems
体内和体外实验均发现BPS和BPF具有和BPA类似的雌激素和抗雌激素效应[39],BPS在低剂量下也可高效激活ERα介导的ERK/MAPK通路;通过离体模型推测BPS和BPF的雌激素受体结合活性约为BPA的0.32倍和1.07倍。利用cyp19b-GFP转基因斑马鱼(ER特异性介导E2调控cyp19b基因的表达)的研究也表明BPF同BPA有相当的雌激素活性,而BPS的雌激素活性较弱[72]。在Tox21的比较中,BPAF不仅是BPA类似物中活性最高的ER激动剂,离体研究表明BPAF对ERβ的结合活性比ERα的更高[2, 73]。BPAF可通过ERα诱导的C-X-C趋化因子配体12的表达而促进ERα阳性乳腺癌细胞(T47D和MCF-7)的增殖,但对ERα阴性细胞的增殖无影响[74];同时有研究指出BPAF可激活ERβ通路和Ca2+流超载致使维持卵巢颗粒细胞生理特性的KGN细胞出现凋亡[75]。而利用干扰RNA对ER进行沉默的研究也表明BPAF通过经典基因组通路和ERK1/2依赖的非基因组通路调控雌激素活性通路[76]。动物模型和体外研究均表明BPB有与BPA相似甚至更高的雌激素活性效价,可与E2对ER产生竞争性结合[77];此外,BPB可通过破坏卵母细胞中ERα的定位模式并诱导其功能障碍而影响卵母细胞的减数分裂及其细胞质量,BPB可能通过胞外ERK1/2信号通路和PI3K/AKT信号通路诱导睾丸间质细胞增殖[62, 78]。采用青鳉进行的体内实验以及HELN-ERα和HELN-ERβ荧光素酶报告体系的体外实验均表明,BPC可结合ERα和ERβ并激活下游通路最终表现出强雌激素效应,其作用强度与BPAF和BPB在同一水平(均强于BPA)[50, 73, 79]。同时,BPC、BPAF、BPE与BPA类似,均可通过ER介导的ERK1/2信号通路提高细胞内Ca2+水平,进一步表明其可通过ER途径影响生殖[80]。分子动力学(molecular dynamics, MD)模拟联合体外的竞争性结合实验或细胞实验的研究结果也表明BPE、BPZ、BPBP、BPAP和四甲基双酚A(TMBPA)通过与ERα-LBD结合这一分子起始事件激活下游通路引发雌激素效应[81-83],而BPM、BPP和BPFL这3种BPA类似物在分子对接、MD模拟和体外实验中被证明为ER的拮抗剂,抑制HELN-ERα/ERβ的转录活性[79, 84-85],且Cao等[86]认为hERα中的Thr347是区分BPs拮抗或激动雌激素效应的关键残基。
2.2 膜雌激素受体途径
除了与经典的ER结合,BPA类似物还被证明可通过膜雌激素受体GPR30发挥内分泌干扰效应。GPR30是与ER作用模式不同的一种膜相关雌激素受体,主要通过激活第二信使环腺苷酸(cyclic adenosine monophosphate, cAMP)和表皮生长因子受体(epidermal growth factor receptor, EGFR)等的蛋白激酶途径介导快速非基因效应和转录调节[87]。BPA在低浓度时主要是通过激活GPR30介导的非基因组途径产生毒性效应[88]。环境相关剂量下BPA可通过激活GPR30介导的cGMP-PKG信号通路、cAMP-PKA信号通路、EGFR-MAPK通路介导的ERK1/2快速磷酸化等途径影响精原细胞、精母细胞的增殖和卵母细胞减数分裂[87, 89-90]。通过SKBR-3细胞荧光竞争结合实验,发现BPS、BPF、BPAF、BPB与BPA类似同样可与GPR30直接结合,且BPAF和BPB的结合亲和力比BPA高9倍[91]。除此之外,低剂量的BPF可通过GPR30激活Akt和ERK1/2信号从而诱导细胞增殖,这与E2的作用模式相似[92]。与BPF相同,不同的研究均表明BPAF可通过GPR30单独(不需要ERα参与)激活ERK1/2和Akt磷酸化等信号通路诱导的细胞增殖,这一结果也为BPAF在乳腺癌产生和发展中的作用提供了解释[93-94]。Li等[62]发现BPB可能通过GPR30介导的ERK1/2信号级联放大反应诱导青春期后期大鼠睾丸间质细胞的增殖。BPC同样被报道为GPR30的激动剂,且其诱导细胞内Ca2+水平增加可能同样与GPR30介导的信号通路有关[80, 95]。Liu等[96]通过MD模拟发现,Leu137TM3和Trp272TM6是这几种BPs识别结合并激活GPR30的关键残基,为BPs与GPR30分子识别机制研究提供了理论依据。
2.3 雄激素受体途径
与BPs和ER作用会产生类雌激素效应和抗雌激素效应不同,几乎所有已被报道的在雄激素受体途径发生作用的BPs都会产生抗雄激素作用[1-2]。BPA产生抗雄激素效应可能是因为:(1) BPA与AR的结合干扰了正常雄激素-AR复合物氨基/羧基末端结构域(N/C)之间的分子内的二聚化作用,导致AR稳定性降低而自然降解[97];(2) BPA促进AR泛素化而降解;(3) BPA结合AR-LBD导致受体与其辅助伴侣蛋白——90-kDa热休克蛋白(Hsp90)稳定性增加,而阻止AR与之解离,最终导致AR无法转移至细胞核以介导下游基因的转录;(4) BPA占用AR-LBD位点后干扰了辅助AR核转位的配体依赖的核定位序列,导致配体-受体复合物介导的基因转录不会被刺激,从而产生生殖毒害作用[98]。BPS、BPF、BPAF、BPB、BPE、BPC、BPZ、BPAP、TMBPA和BPP也在不同的体外雄激素受体终点检测中显示为抗雄激素效应,其中BPAF、TMBPA和BPE可能具有更强的雄激素拮抗效应,而BPS的拮抗效应最弱[2, 99]。Conroy-Ben等[81]通过QSAR的方法对比雄激素拮抗剂——羟基氟他胺和BPs与AR结合模型发现BPBP、BPZ、BPB、BPA、BPE、BPF和BPS均通过与AR-LBD的Thr877和Asn705形成氢键而结合(与羟基氟他胺相同),且QSAR模型研究结果与酵母报告基因雄激素试验(YAS)测定的结果一致。目前,BPs与雄激素受体相互结合并发挥生理相关作用的研究有限,且对其产生抗雄激素效应的相关机制了解不足,未来应予以关注。
2.4 雌激素相关受体途径
ERRγ是一种孤儿受体,也是人类48个核受体之一,在发育期哺乳动物大脑以及成年动物大脑和肺等器官中高表达,有研究指出ERRγ在胎儿大脑和胎盘中均有表达,并且ERRγ可能参与前列腺的生长和发育[100]。而不少体外竞争性结合ERRγ-LBD的实验中表明BPA与ERRγ有很强的结合亲和力并且通过保持或锁定ERRγ-LBD的helix12的活性构象而维持ERRγ的高转录活性[73, 101-102]。BPA可与下丘脑[103]、海马区神经元[104]和胎盘[105]中的ERRγ结合而影响下游生殖调控、棘突发生(MAPK信号途径诱导)及BPA在胎盘中的积累。体外实验表明,BPA以时间依赖性的方式诱导ERRγ核易位并增加BPA/ERRγ靶基因的表达,BPA通过促进Ca2+的内流和表皮生长因子(EGF)的分泌,导致EGFR/ERK通路被激活,最终使得BPA通过BPA/ERRγ/EGF/EGFR/ERK信号通路诱导细胞增殖[106]。BPS、BPF、BPAF、BPB、BPC、BPE、BPZ、BPAP、BPP和BPM与ERRγ的体外结合实验同样证明这些BPs具有较高的ERRγ受体亲和力,且BPB和BPE的结合亲和力与BPA相当[73]。Okada等[107]在2008年也得到类似的结果,而且部分BPs的结合活性与人ERRγ荧光素酶报告基因的测定结果吻合。低浓度BPA、BPS和BPF暴露小鼠精母细胞GC-2会显著提高细胞中Errγ的转录,表明ERRγ也是BPS和BPF对生物体生殖产生影响的靶点之一[108]。而对BPAF和BPC进行分子比较对接的结果显示,BPAF和BPC在与ERRγ-LBD结合时也表现为激动构象,发挥关键作用的可能是ERRγ-LBD的helix7上的N346与BPs形成的氢键,且这一计算机预测结果与HG5LN GAL4-ERRγ细胞暴露的活性检测结果相关联[109]。虽然通过体外的配体-受体竞争性结合实验和转染细胞活力及基因表达测定研究可知晓大部分BPs都可与ERRγ进行结合,但是BPs在ERRγ相关通路上对生物体产生生殖毒性的研究仍然有限,也需要更进一步的探究。
2.5 甲状腺激素相关受体途径
甲状腺激素(TH,包括T3和T4)是哺乳动物卵巢正常发育所必需的激素,可改变促性腺激素的释放进而影响卵泡命运,甲状腺激素失衡则会导致卵巢质量下降,精子发生、数量及活力下降,生殖激素合成和分泌紊乱,甚至增加不孕风险[110-111]。在非洲爪蟾[112]、青鳉[113]、啮齿动物[111-112]和猪颗粒细胞[110]中的实验均表明BPA可通过干扰TH与TR的结合影响信号的传导。BPA暴露促进斑马鱼幼鱼体内甲状腺激素运转蛋白(TTR)的表达,且体外荧光竞争实验也表明BPA可与TTR结合,干扰体内正常TH的运输[114-115]。另外也有证据表明BPA可能会通过干扰TH的合成而对生物体产生干扰,BPA暴露斑马鱼后,TH合成相关基因(tg、tshr)的表达量显著上调,而大鼠甲状腺肿瘤细胞FRTL-5暴露于较低浓度BPA后同样使得TH合成相关基因(tg、tshr、nis和tpo)的表达上调[114, 116]。综上所述,BPA可通过对TH的产生、运输和作用环节产生干扰效应,从而间接影响生殖健康。虽然BPA类似物于甲状腺干扰的研究较少,但是已有研究均表明BPA类似物会造成甲状腺干扰。Lu等[117]利用MD模拟结合体内及体外实验发现BPA、BPS等BPs对TRβ有不同程度的抗甲状腺激素活性。而暴露于BPF和BPS的斑马鱼甲状腺发育相关基因(hhex和tg)、甲状腺激素运输相关基因(ttr)和甲状腺激素代谢相关基因(ugt1ab)的转录发生了变化,且幼鱼体内的T3和T4含量显著增加,说明BPS和BPF同样可能干扰TH的合成、分泌及运输[114]。分子对接结果提示BPS与BPF对TR有结合能力,体外荧光竞争结合实验证实其能与TR结合(与BPA类似);此外,3种BPs均能诱导TH依赖的垂体GH3细胞增殖,而在T3存在时抑制T3的诱导,表明BPS和BPF与BPA一样具有干扰TH信号通路的潜力[118]。类似的结果也在BPAF、BPAP、BPC、BPB和BPZ暴露大鼠垂体GH3细胞后产生,表明BPA类似物的TH干扰能力[119]。结合上述研究可知这些BPA类似物的甲状腺干扰效应和机制与BPA类似,需引起研究者的关注并进一步研究。
2.6 芳香烃受体途径
芳香烃受体(AhR)是一种配体激活的转录因子,AhR与配体结合后会被芳香烃受体核转位蛋白(ARNT)带入细胞核与特异性DNA反应元件结合,从而启动包括细胞色素P450家族在内的异源物质代谢相关基因的转录,其在生物体的发育、代谢过程和免疫炎症中起着重要的作用。野生型和AhR-KO小鼠卵泡的BPA暴露实验显示,BPA可抑制2种卵泡生长并降低E2水平,且BPA对AhR-KO卵泡生长的抑制作用要弱于野生型,表明BPA可能通过AhR信号途径部分抑制卵泡生长[120]。BPA暴露妊娠期大鼠可诱导胚胎中芳香烃受体抑制剂(AhR repressor, AhRR)的基因表达上调从而抑制胚胎中AhR的功能[121]。此外,围产期暴露BPA导致的雄性后代的精子发生能力降低及精子畸形率增加,可能与睾丸中AhR信号通路所激活的炎症反应有关[122]。最近的一项研究表明BPA类似物BPF、BPS和BPAF在低浓度(1~100 nmolL-1)下暴露HepG2细胞系均会诱导AhR的RNA和蛋白质水平的增加,从而使受其调节的相关CYP酶的表达出现异常,最终加剧染色体损伤,且分子对接和分子动力学模拟结果也显示上述BPs与AhR的结合亲和力同强效激动剂(PCB 126)的亲和力水平相当[123]。关于BPs与AhR相互作用的相关研究仍停留在计算模拟水平,需要更多的实验证据来支撑这一观点。
2.7 其他受体途径
体外竞争结合受体测定的研究表明,除了能与上述几种人核受体结合外,BPA、BPS、BPF、BPAF、BPB、BPC、BPE、BPZ、BPAP、BPP和BPM均可与孕烷X受体(PXR)进行结合;除BPS和BPF外,其他测试的BPs可与组成型雄烷受体(CAR)结合,且结合作用极强;而除BPS外,其他BPs均可结合糖皮质激素受体(GR)[73]。Kojima等[99]在测定BPs暴露转染人PXR的COS-7细胞的荧光素酶活性实验中发现BPA、BPAF、BPB、BPZ、BPAP和BPP均是人PXR的激动剂,且BPZ、BPAP和BPP比BPA的激动效应更强。另一项关于HG5LN-PXR的研究显示BPM和BPBP同样是PXR的激动剂[79]。同时,Kojima等[99]还首次通过COS-7细胞的反式激活实验证明了BPA及其类似物BPAF、BPB、BPZ、BPAP和BPP具有CAR逆向激动活性,同时通过基于CHO-K1细胞的反式激活实验证明这6种BPs都是GR的拮抗剂。在一项暴露于BPA、BPS和BPF的重组酵母(稳定表达人GR)系统中GR激活实验的结果也同样表明了BPs的GR拮抗作用[124]。
除了PXR、CAR和GR,BPAF、BPC、BPM和BPZ被证明可与人过氧化物酶体增殖物激活受体(hPPARs)和人视黄X受体(hRXRs)相互作用[125],且与它们相比BPA具有更高的hPPARs和hRXRs结合亲和力。综上所述,BPA及其类似物同样会对PXR、CAR、GR、PPAR和RXR这些同属核受体家族的受体蛋白产生结合作用,即便最终激动或拮抗效应有所不同,但由于核受体作为配体激活的转录因子在特异性调节参与代谢、发育和繁殖的靶基因的表达上起着至关重要的作用,理应对这些污染物的核受体影响做更深层次的机制相关研究。
3 BPA类似物的人体生殖健康风险(Human reproductive health risks of BPA analogues)
BPA类似物主要通过消化道被人体接触吸收,2013年的研究估算人体每日通过膳食摄入BPs的量为幼儿243 ng·kg-1(以体质量计)和成人58.6 ng·kg-1(以体质量计),表明了BPs对人体的较高浓度持续暴露,由于BPA类似物在环境中的检出量日益增多,人类对BPs的接触也呈上升趋势[126]。最近一项基于废水流行病学评估人类暴露于BPA类似物的研究则表明,人类平均每日BPF、BPS、BPP、BPZ、BPB、BPAF和BPAP的暴露水平分别为10.2、5.21、1.15、0.66、0.61、0.58和0.35 μg,说明BPA类似物的人体暴露风险正在升高[32]。相较于多数模式动物研究中的BPs暴露浓度而言,人类暴露剂量水平相对较低,但已有环境相关浓度的研究表明在人类可接触的BPs浓度下,动物研究仍显示出了BPs的生殖毒性,提示BPA类似物的人体生殖健康风险不容忽视[40, 47, 49, 65]。BPS、BPAF和BPB被人体摄入后主要在肝脏和肠道中被代谢为BPs-葡糖苷酸,少量代谢为BPs-硫酸盐、羟基化BPs和其他代谢产物,而BPF主要代谢为BPF-硫酸盐后随尿液排出[31, 126]。一项d4-BPS于人体内的药代动力学研究表明,与BPA相比,BPS吸收快、代谢慢,其在口服后1 h内被迅速吸收,人体内半衰期为6.8 h,且在人体内主要以毒性更强的未偶联形式存在,48 h时BPS在男性中通过尿液排泄率约为92.17%,女性排泄率为70.36%,提示女性可能有更高的BPs暴露风险[127]。BPF和BPAF同样在动物研究中被报道有比BPA更长的体内半衰期和更高的残留量[128]。Karrer等[129]基于生理毒物动力学计算机模型分析发现,在环境相关浓度下BPs在肠道和肝脏中代谢速率的排序为:BPA>BPF>BPS。此外,BPs在体内的代谢产物同样存在健康风险,研究表明BPAF的主要代谢产物BPAF-葡糖苷酸可对PXR和PPARγ产生拮抗作用[130];BPB、BPC和BPF可通过多种途径产生二聚代谢产物,尽管对其毒性研究甚少,但由于BPA的二聚代谢物被证明比BPA具有更强的雌激素效应,故而BPs的代谢产物毒性也应引起关注[9]。虽然大部分BPs可能通过人体代谢降低毒性后排出,但因环境中BPs的广泛存在和日益升高的含量,人体处在持续暴露中,使得体内游离BPs暴露风险增加。
由于BPA类似物的酚类结构与人体性激素结构相似,被认为可干扰人体内雌二醇、孕酮、黄体生成素、促卵泡激素、睾酮和雄烯二酮等性激素水平,从而对人体的生殖系统造成扰乱,影响人类生殖健康[131-133]。BPE、BPF同BPA一样可抑制人类睾丸外植体睾酮的生成,BPS和BPB则会加快睾丸间质细胞INSL3的生成,表明BPA类似物对雄性生殖具干扰效应[134]。BPAF、BPB和BPC等BPs可通过激活CatSper影响人类精子细胞Ca2+信号通路,而破坏人类精子功能[135]。流行病学研究表明BPA类似物的暴露与男性生殖障碍、前列腺癌、女性不孕、乳腺癌和多囊卵巢综合征等生殖相关疾病的发生有关[2, 136-137]。除此之外,BPA类似物与女性孕产风险及胎儿生长缓慢具有相关性。孕妇尿液中BPS含量与女性妊娠年龄和女婴晚产风险的增加相关[138],另有报道孕妇尿液中BPS浓度与早产相关[139]。母亲尿液BPS含量与女婴体质量偏低和下腹围及股骨长度相关[140]。而产前暴露于BPF可能与男婴出生体质量降低有相关性[141]。BPB则被报道与子宫内膜异位有关[128]。最新的一项横断面分析显示适孕女性尿液BPC含量与甲状腺体积呈显著负相关,与促甲状腺激素含量呈显著正相关,而BPC的持续暴露可能会导致甲状腺功能退化进而造成孕妇先兆子痫、胎盘早剥、胎儿宫内发育迟缓、早产以及流产等生殖健康风险[142]。此外,在叶酸补充不足条件下,孕期女性尿液中总双酚类物质(包括BPA、BPS、BPF、BPAF、BPZ、BPB、BPAP和BPP)含量与孕期时间延长有关[143]。综上所述,尽管BPs在人体内可能被代谢排出,但是持续暴露于BPs仍然可能引发生殖健康风险。
综合计算机模拟(QSAR和MD模拟)和体外实验(酵母或细胞报告基因检测)的结果,对各BPA类似物的ER结合亲和力和类雌激素或抗雌激素效应作为指标进行评估得知,相较于BPA而言,除BPS外,其他BPA类似物均表现出与BPA相似或更强的ER结合能力且体外实验同样证实这一结果(表3)[79, 81, 83-85]。在众多BPs中,BPAF所展现出的类雌激素作用最强,而这与BPAF分子结构中酚环间烷基部分的卤化作用相关,其对配体-ERα结合过程中的静电相互作用和氢键的产生有较大影响[144]。相比之下,BPS表现出比BPA更低的ER结合亲和力以及更弱的雌激素效应,这可能与其结构中碳氧双键饱和的连接方式有关,在今后新型BPA类似物的设计中应充分考虑。这提示我们计算机模拟是对新型BPA替代物毒性预测的有效手段,未来应该综合开发基于不同核受体(NRs)的毒性预测模型以期更准确地预测新型化合物毒性。
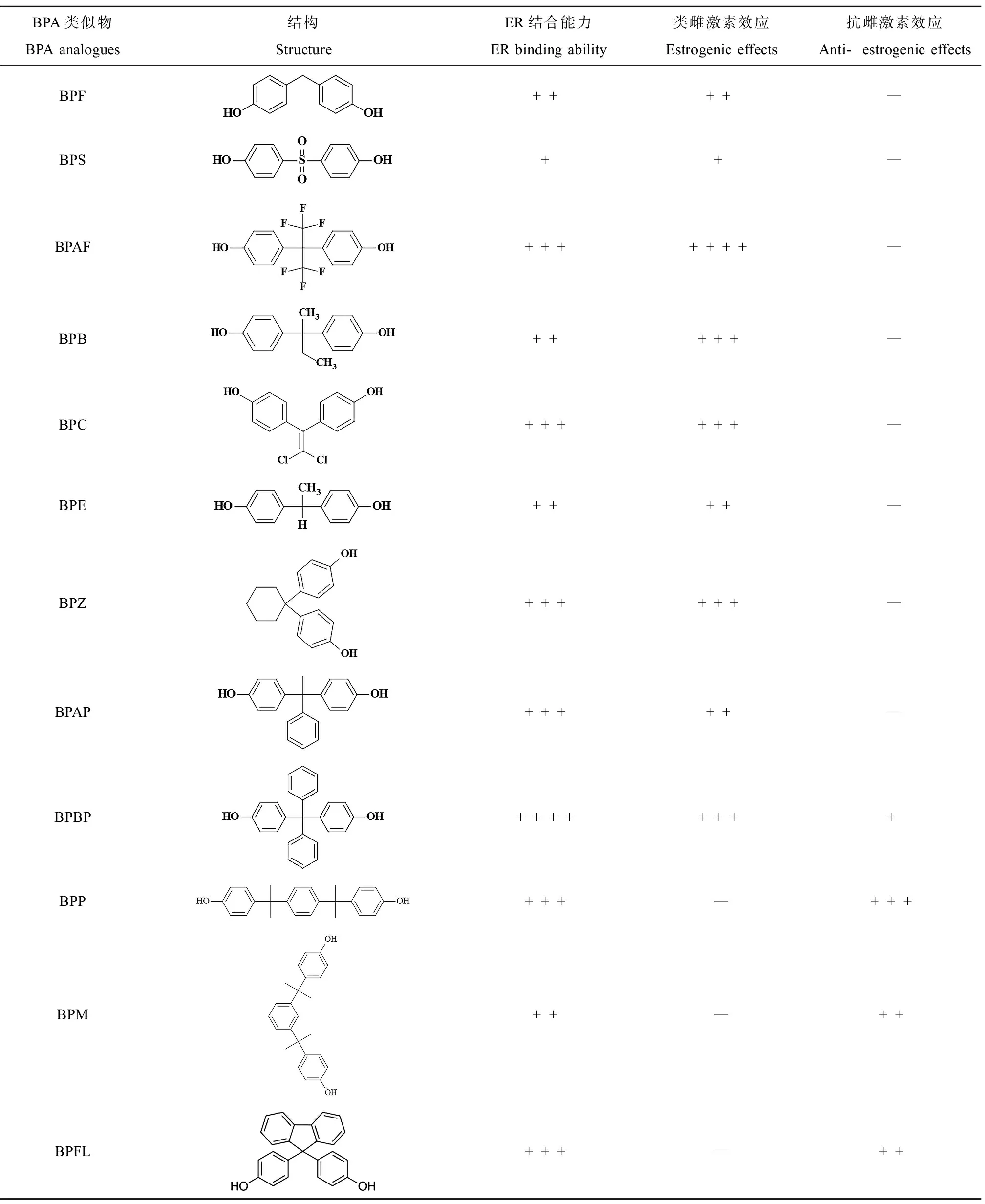
表3 BPA类似物的内分泌干扰能力(基于竞争性结合人雌激素受体(ER)的实验结果)[79, 81, 83-85]Table 3 Endocrine activity of BPA analogues (based on the competitive receptor-binding assays of human estrogen receptor (ER)) [79, 81, 83-85]
4 展望(Perspectives)
BPs作为环境内分泌干扰物,尽管BPA在人类直接接触途径上因各国政策的调整而使其风险降低,但是BPA类似物的开发以及应用已然成了新的问题,且目前已经在世界范围内多种人体样本中普遍存在,其能通过胎盘屏障和血睾屏障影响生殖腺而最终可能对子代产生危害,在职业接触人群的分析中也发现这类化学品的长期接触会对人类生殖产生不利影响,严重时可导致不孕不育。通过在哺乳类模式动物和水生鱼类模式动物上的研究也进一步说明了其在雄性和雌性生殖系统上的毒性作用,但目前关于BPA类似物在动物模型研究中的暴露浓度主要是基于BPA对于实验室动物的最低可见有害作用浓度和人体每日耐受摄入量进行设置,普遍高于环境浓度且暴露时间相对较短,真实环境浓度下BPA类似物对生物体长期暴露的研究偏少,不利于评估BPA类似物对人体健康的影响。随着相关研究的增多,环境相关浓度已经受到更多国际同行的重视,所以暴露剂量的降低、暴露时间的延长以及模拟人群的暴露途径是环境毒理学领域的关注重点。另外,目前的研究仍旧以BPA环境检测和人体检出为基础,但随着BPA限用,多种类似物可能取而代之,因此化学品的实际使用情况在确定毒理研究的优先次序中也很重要。此外,生活环境的复杂性使得人体暴露于多种BPs下,在单一BPA类似物的研究基础上也应考察复合暴露可能带来的影响。
BPA类似物的生物利用度、偶联度以及体内半衰期存在差异,相关研究较少且多为体外代谢模型,无法模拟化合物的体内Ⅱ期代谢,故而BPA类似物的动物体内代谢同样是这一领域的新关注点。尽管进入人体的BPs大部分可通过葡萄糖醛酸化和硫酸化而排出体外,但不少研究仍表明一些已投入生产应用的新型BPA类似物(如BPAF、BPB)的生殖毒性相较BPA反而更高,而对这些类似物的生物安全性的研究仍然较少,在其生殖毒性的机制方面同样需要更深的探究。现有研究表明BPA的体内代谢产物具有比BPA更强的雌激素效应,但BPA类似物的相关研究同样较少,了解BPs在体内的代谢过程和代谢产物的毒性能对BPs生殖毒性发生的机制有更全面的解释,在未来的研究中应该更加关注BPA类似物在人体内代谢产物的毒性评估。
伴随着计算机科学在环境领域的广泛应用和蛋白质结构解析方法的日益成熟,开发高通量、稳定、易操作的体外模拟技术对化合物毒性进行预测同样是毒理学领域的发展重点,由于其在化学品毒性预测方面的极大潜力,如今已经得到了广泛应用并受到了领域内的认可。依托于上述计算机模拟技术,BPA及其类似物对ER蛋白结合和效应产生机制已得到了较为充分的研究,但随着对其他核受体和膜受体在EDC引起生殖和其他内分泌干扰研究中的关注,相关的机制研究仍然极为缺乏,也需要更多从业者探究和解释,并且需要更多体内研究以补充体外研究的不足。

