镉对集胞藻光合活性的影响
阮港,许萍萍,殷旭旺,张春梅,宋高飞,米武娟,毕永红,*
1. 大连海洋大学水产与生命学院,大连 116023 2. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉 430072
镉是一种生物半衰期相对较长的非必需重金属元素,容易在生物体中积累并行使生理功能[1],具有高致毒性[2];如镉与巯基紧密结合,是一种酶抑制剂[3],破坏细胞内部离子平衡并与蛋白质中的金属离子发生置换反应导致其失去活性[4];镉激发细胞的氧化应激造成脂质过氧化、引起蛋白质/DNA损伤[5];镉还可通过干扰DNA合成与修复,破坏细胞的增殖和分化、细胞周期进程和细胞凋亡等[6]。即使在较低浓度下,镉也能通过诱导氧化应激和影响生长、代谢、营养吸收、光合作用和呼吸作用对光合生物产生毒害效应[7-9]。镉对藻类的毒性试验表明,镉胁迫能显著抑制栅藻生长并破坏细胞超微结构[2];镉对藻类光合系统具有毒性效应,破坏叶绿素合成[10-12],竞争性结合放氧复合体(OEC)上Ca2+位点和叶绿素a的Mg2+等[13]。长期以来,镉被认为是没有任何有益功能的有毒重金属。但最近研究表明,植物需要微量Cd2+才能达到最佳生长状态[14];在硅藻中,金属镉、钴和锌可以在功能上互相替换,以保持最佳的生长速度[15]。可见,镉的确切生物效应仍不甚明了,需要深入研究。
蓝藻作为水生生态系统总初级生产力的重要贡献者,是重金属进入食物链的主要途径之一;暴露在环境中的蓝藻细胞对重金属胁迫敏感,集胞藻作为光合作用研究的模式生物,是研究水体重金属潜在生态风险的重要模型[16]。尽管Cd2+对藻细胞光合系统影响的研究已非常深入,但此前的研究主要集中在藻细胞对重金属胁迫的生理响应和生物吸附能力[17-21],Cd2+的毒性机制仍不明确,且Cd2+的急性毒性胁迫影响光合系统中的位点存在一些相互矛盾的结果[10, 22],例如,PSⅠ和PSⅡ对镉的敏感性存在争议;Cd2+的胁迫位点位于电子传递链的确切部位存在分歧。本文选择集胞藻PCC 6803为对象,探究不同浓度Cd2+对细胞抗氧化酶系统和光合活性的毒性效应,以期寻找Cd2+作用于蓝藻细胞的靶标位点,进一步认识重金属对淡水蓝藻的毒性作用及其急性致毒机理、评估重金属的生态风险提供理论依据。
1 材料与方法(Materials and methods)
1.1 材料和培养条件
集胞藻(Synechocystissp.)PCC 6803来自中国科学院水生生物研究所淡水藻种库(FACHB-collection)。以改良BG11培养基(不含EDTA)为培养液,在(30±1) ℃、30~40 μmol·m-2·s-1持续光照条件下,以130 r·min-1转速进行摇床培养,采用紫外分光光度计(UV1701,日本岛津)测定培养物在730 nm的吸光值,通过A730 nm监测其生长。初始接种浓度A730 nm=0.1接入250 mL三角瓶,收集处于对数生长期(A730 nm=0.8~1.0)的藻细胞用于本研究。
3 000 r·min-1转速离心5 min收集对数生长期的藻细胞,无菌水冲洗3次后,置于BG11培养基中,接种量少于培养基的1%,接入含有100 mL BG11的三角瓶。分析纯的试剂CdCl2·2.5H2O购于中国国药有限公司。设置各处理组中Cd2+浓度分别为0.05、0.25、0.50和1.00 mg·L-1,以0 mg·L-1作为对照组。每个浓度设置3个重复,试验周期为24 h。
1.2 指标测定
1.2.1 光合色素含量的测定
光合色素含量的测定如前人[23]描述,取5 mL培养物4 000 r·min-1离心10 min,弃去上清液,加入5 mL预冷的90%的甲醇,混匀后在4 ℃冰箱避光提取24 h,4 000 r·min-1离心10 min后,取上清液,采用紫外分光光度计测定665、652和470 nm波长的吸光值,参照公式计算叶绿素a(Chla)和类胡萝卜素(Car)的含量:
Chla(mg·L-1)=16.82A665-9.28A652
Car (mg·L-1)=(1000A470-1.91Chla)/225
1.2.2 活性氧(ROS)含量测定
集胞藻细胞内的ROS用二氯二氢荧光素双醋酸盐(DCFH-DA)检测。DCFH-DA能进入细胞内,被酯酶分解为DCFH,DCFH与H2O2等小分子过氧化物结合而被氧化成具有荧光性的DCF。在24 h取样,离心,重悬于100 mmol·L-1PBS (pH 7.2)缓冲液中,再使用PBS缓冲液洗涤细胞2次,200 mL培养物加入96孔板用酶标仪(PerkinElmer VICTOR Nivo,美国)检测DCF荧光强度(激发波长485 nm和发射波长530 nm)和叶绿素荧光(激发波长485 nm和发射波长670 nm)。使用叶绿素荧光法归一化单个细胞ROS含量,使用公式FDCF/FChl计算相对ROS丰度。
1.2.3 超氧化物歧化酶(superoxide dismutase, SOD)活性测定
取适量藻液4 000 r·min-1离心10 min后,将藻泥悬浮于1 mL生理盐水(0.9% NaCl),加入适量锆珠,4 ℃冷冻破碎,4 ℃、1 800 r·min-1离心10 min,取上清用于蛋白含量与酶活测定。SOD的测定使用试剂盒(南京建成),蛋白质测定使用微孔BCA蛋白试剂盒WST-1法(康为世纪),使用蛋白量归一化SOD含量。
1.2.4 快速荧光诱导动力学曲线(OJIP)和PSⅡ最大光化学效率(Fv/Fm)的检测
OJIP曲线和Fv/Fm使用AquaPen-C AP-C 100荧光仪 (Photon Systems Instruments,Brno,捷克)测定,其中Fv=Fm-F0,F0和Fm分别是藻细胞在暗适应状态下的最小和最大荧光产量[24-25]。调节合适的细胞浓度,室温暗适应10 min,蓝藻F0的测定使用弱蓝色测量光(450 nm,<0.1 μmol·m-2·s-1),该光强不足以引起光化学电子传递,Fm采用饱和脉冲光(1 800 μmol·m-2s-1)照射800 ms测得。以照射时间为横坐标,荧光强度为纵坐标,对快速叶绿素荧光诱导动力学曲线作图,为了更好地观察J点和I点,把横坐标改为对数坐标,结果得到OJIP诱导曲线。
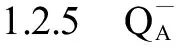
Ft=A1exp(-t/T1)+A2exp(-t/T2)+A3exp(-t/T3)+A0
式中:Ft代表可变荧光产量,A0~A3指幅度,T1~T3是时间常数,半衰期由时间常数T计算得来,公式t1/2=ln 2T。
1.2.6 S-state检测
取3 mL待测样品放入样品室,打开测量光测定F0,测量光照射时间是1 ms。随后打开光化光闪光照射样品,光化光闪光次数为10次,每次闪光时间间隔为100 ms。以照射时间为横坐标,荧光强度为纵坐标作图即为S-state曲线[29]。根据S-state曲线,无活性PSⅡ反应中心(PSⅡX)比例可通过F0第4次光化光闪光后100 ms处荧光值的差值进行估算,具体计算公式为:ΔF4=F400 ms/F0-1。由于本试验中相对可变荧光强度降低,使用修改后公式[30]来计算PSⅡX的比例:PSⅡx(%)=ΔF4×100(F300 ms/F0-1)。
1.3 数据分析
本试验各组均设置3个平行。统计软件使用SPSS25.0(IBM,USA),处理组和对照组间采用单因素方差(One-way ANOVA)分析检验,若差异显著进行最小显著差异(LSD)多重比较检验组间差异显著性。绘图和数据处理使用R语言中的tidyverse包。
2 结果(Results)
2.1 光合色素含量变化
不同浓度Cd2+对叶绿素a含量影响如图1所示。0.05 mg·L-1浓度处理后,叶绿素a与对照组相比呈现上升趋势;以0.25、0.50和1.00 mg·L-1处理集胞藻后,叶绿素a含量与对照组相比显著下降(P<0.01)。
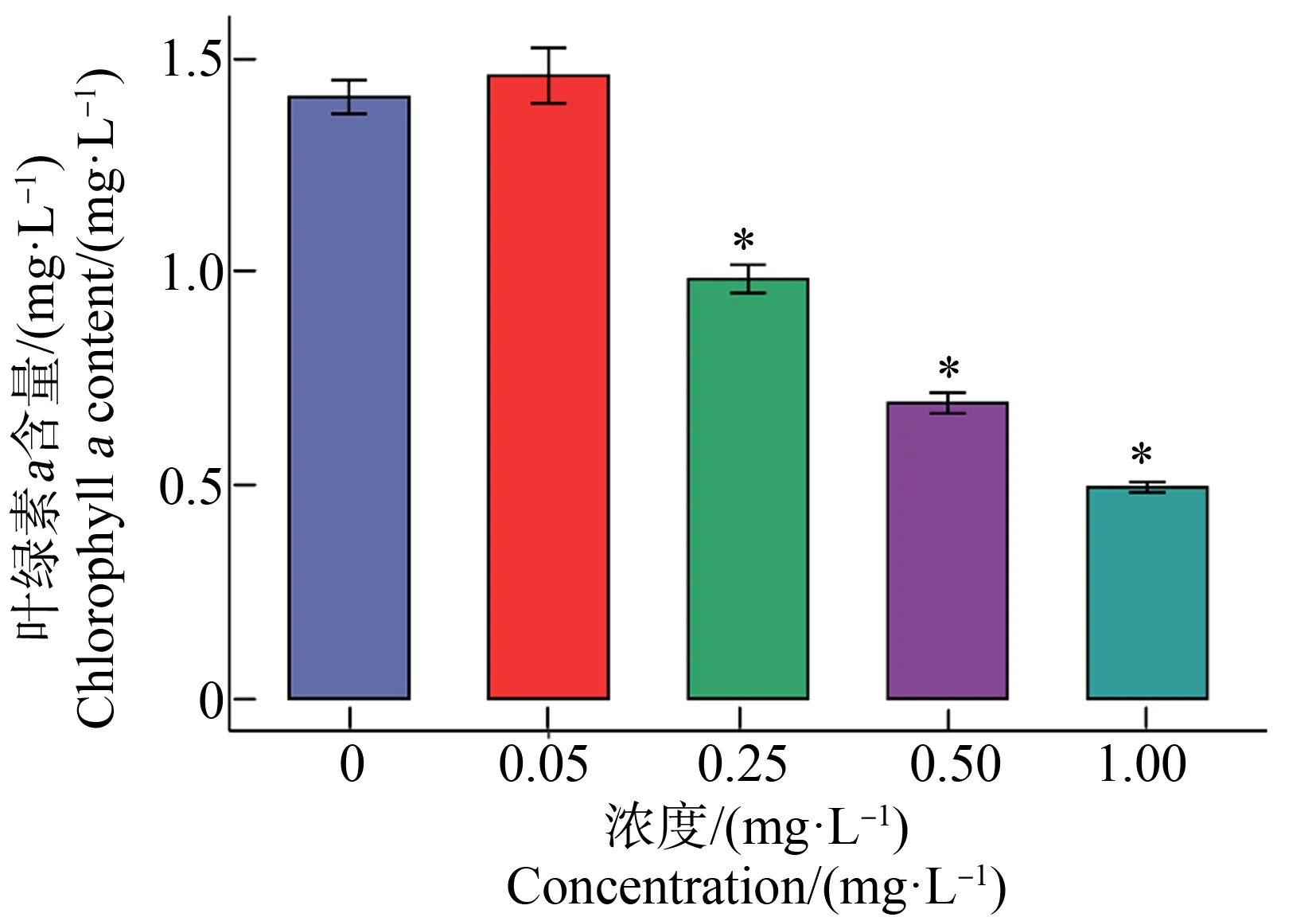
图1 不同浓度镉离子处理24 h对集胞藻光合色素含量的影响注:*表示与对照组相比存在显著性差异。Fig. 1 Effect on the pigment content in Synechocystis sp. after exposure to different concentrations of cadmium for 24 hNote: *indicates significant difference compared with the control group.
2.2 ROS含量和SOD活性变化
如图2所示,处理24 h后,Cd2+浓度0.05 mg·L-1处理组与对照组相比ROS含量显著上升(P<0.01),Cd2+浓度为0.25、0.50和1.00 mg·L-1的处理组ROS含量分别是对照组的1.47倍、2.58倍和2.69倍。
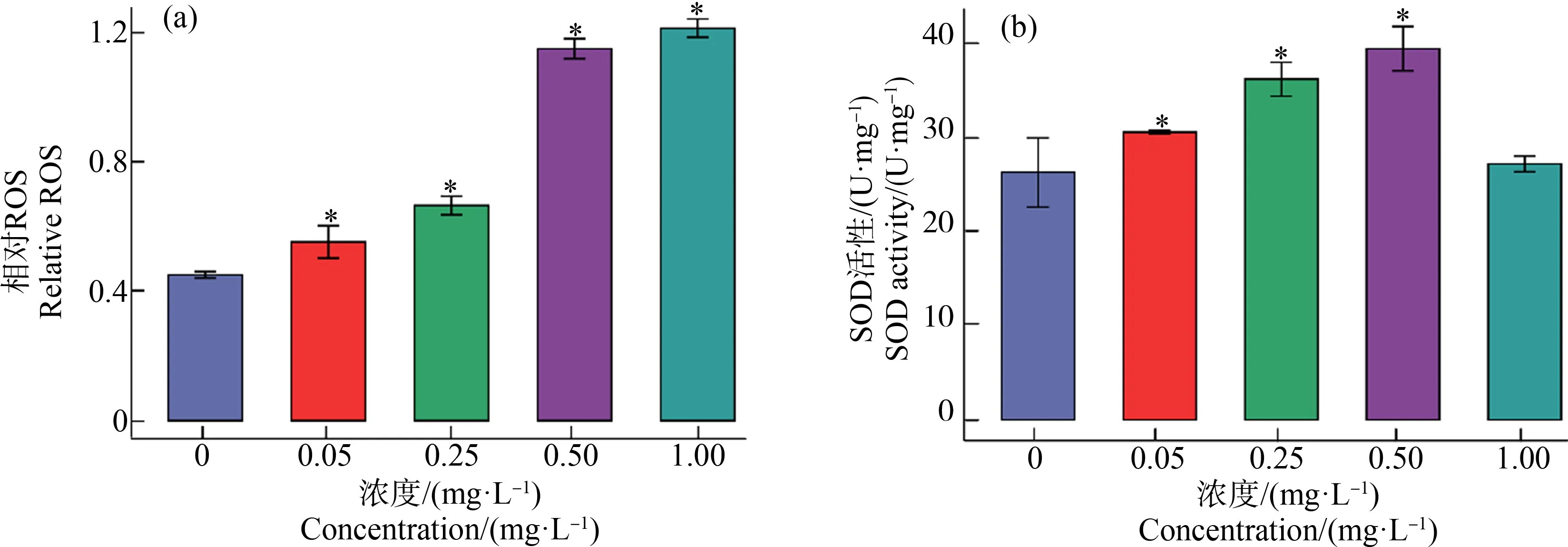
图2 不同浓度镉离子处理24 h集胞藻活性氧(ROS)含量和超氧化物歧化酶(SOD)活性的变化注:*表示与对照组相比存在显著性差异。Fig. 2 Change of reactive oxygen species (ROS) content and superoxide dismutase (SOD) activity in Synechocystis sp. after exposure to different concentrations of cadmium for 24 hNote: *indicates significant difference compared with the control group.
与对照组相比,Cd2+浓度为0.05、0.25和0.50 mg·L-1的处理组藻细胞中SOD活性显著上升(P<0.05);Cd2+浓度为1.00 mg·L-1的处理组藻细胞中SOD活性与对照组差异不显著(P>0.05)。
2.3 叶绿素荧光活性的变化
集胞藻在不同Cd2+环境中,叶绿素荧光诱导曲线和PSⅡ最大光化学效率(Fv/Fm)如图3和图4所示。由图3可知,Cd2+浓度为1.00 mg·L-1,P峰消失。归一化的OJIP曲线可以更好比较各峰之间的变化;Cd2+浓度0.50 mg·L-1,J峰显著上升(P<0.01)。由图4可知,Cd2+浓度为0.50 mg·L-1和1.00 mg·L-1,处理组Fv/Fm相对于对照组显著下降(P<0.01)。
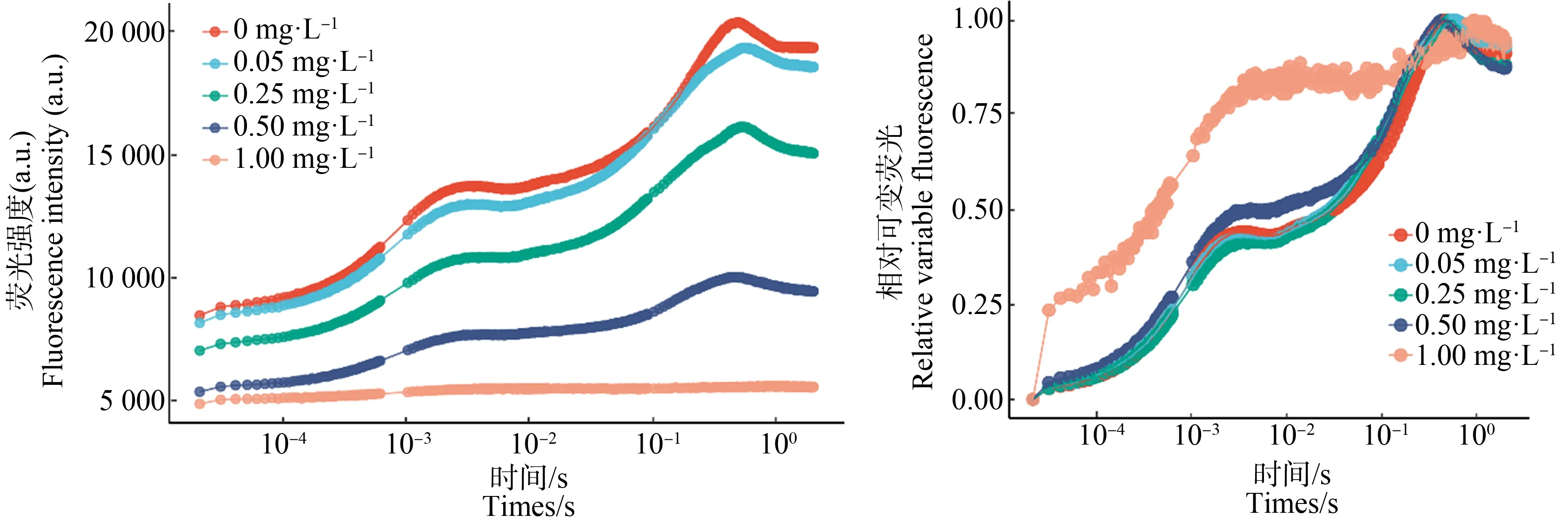
图3 不同浓度镉离子处理24 h集胞藻的OJIP曲线注:相对可变荧光计算公式为Vt=(Ft-F0)/(Fm-F0)。Fig. 3 OJIP fluorescence transients of Synechocystis sp. after exposure to different concentrations of cadmium for 24 hNote: Relative variable fluorescence is calculated by Vt=(Ft-F0)/(Fm-F0).
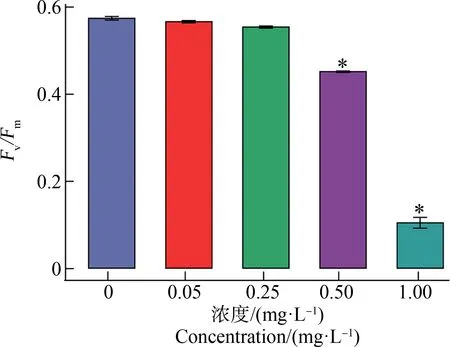
图4 不同浓度镉离子处理24 h集胞藻的PSⅡ最大光化学效率(Fv/Fm)变化注:*表示与对照组相比存在显著性差异。Fig. 4 Change of PSⅡ maximum photochemical efficiency (Fv/Fm) in Synechocystis sp. after exposure to different concentrations of cadmium for 24 hNote: *indicates significant difference compared with the control group.
2.4 Cd2+对再氧化的影响

图5 不同浓度镉离子处理24 h集胞藻再氧化曲线注:荧光强度计算公式为Ft-F0。Fig. reoxidation kinetic curves of Synechocystis sp. after exposure to different concentrations of cadmium for 24 hNote: Fluorescence intensity is calculated by Ft-F0.
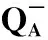
表1 不同浓度镉离子处理24 h集胞藻的再氧化曲线参数Table 1 Parameters of reoxidation kinetics in Synechocystis sp. after exposure to different concentrations of cadmium for 24 h
2.5 Cd2+对无活性PSⅡ反应中心(PSⅡX)的影响
不同浓度Cd2+作用下连续单饱和反转闪光激发后S-state曲线如图6(a)所示。PS Ⅱ反应中心的一部分不能将电子从初级受体QA传递给次级受体QB,成为PSⅡX。据此计算细胞内的PSⅡX的比例的结果如图6(b)所示,Cd2+浓度为0.50 mg·L-1和1.00 mg·L-1,集胞藻PSⅡX比例显著上升。
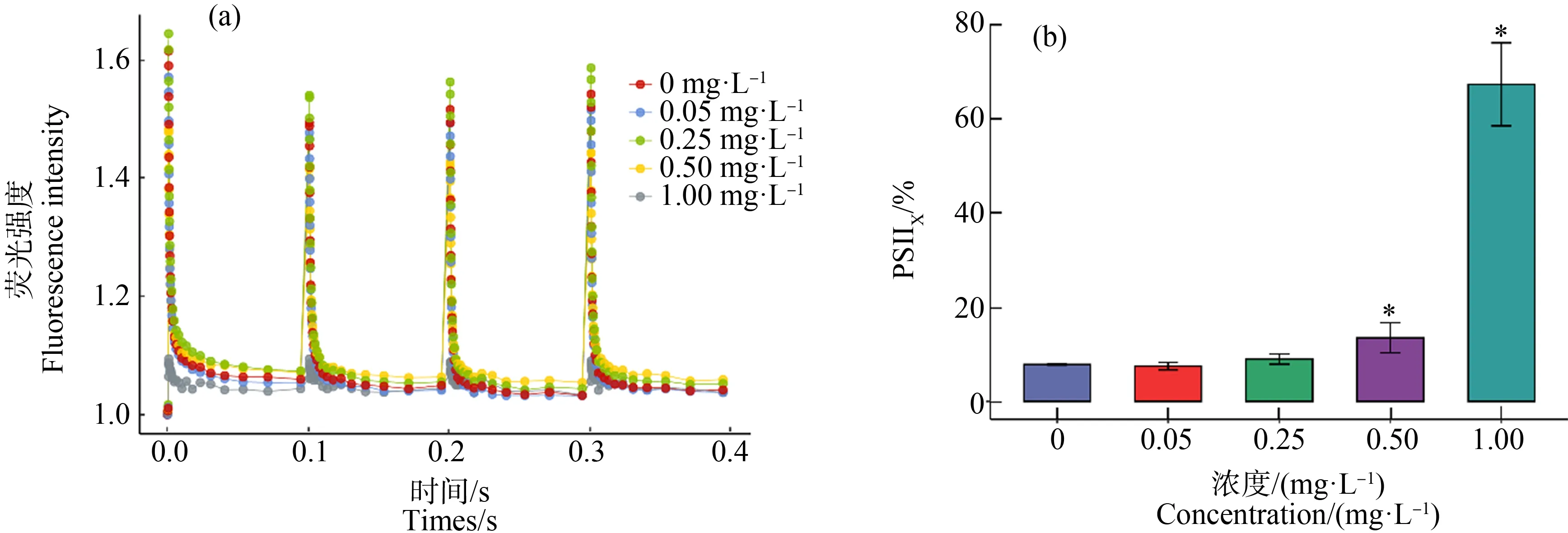
图6 不同浓度镉离子处理24 h集胞藻荧光衰减曲线(a)和无活性PSⅡ反应中心(PSⅡX)比例(b)的变化注:*表示与对照组相比存在显著性差异,荧光强度计算公式为Ft/F0。Fig. 6 Fluorescence decay curves (a) and the proportion of inactive PSⅡ reaction center (PSⅡX) (b) of Synechocystis sp. after exposure to different concentrations of cadmium for 24 hNote: *indicates significant difference compared with the control group, and fluorescence intensity is calculated by Ft/F0.
3 讨论(Discussion)
尽管地壳中镉元素含量很低,但人类通过采矿、有色金属冶炼和肥料生产使其浓度在局部环境中增加到有毒水平,如化工园区或密集种植区土壤中的Cd2+浓度达到100 mg·kg-1以上。这些Cd2+最终汇集到江河湖海中,威胁水域生态系统的安全与健康。蓝藻作为水域生态系统的重要成员,对镉具有较强的吸附/吸收能力;研究表明蓝藻细胞能在30 min吸附70%以上Cd2+,胞内聚集的Cd2+抑制叶绿素合成并破坏类囊体膜蛋白结构,可直接或间接损伤电子传递系统、酶活和光合系统,进而降低蓝藻细胞的光合能力;可见,蓝藻细胞对Cd2+的胁迫极为敏感[22]。不高于0.50 mg·L-1的低剂量镉浓度能够激发集胞藻细胞的氧化应激和抗氧化酶系统,该结果与曲壳藻[31]暴露在镉胁迫中的表现基本一致。本试验也发现,镉胁迫对细胞光合系统造成损伤,破坏光合电子传递链导致电子外溢,胞内的氧与外溢电子结合产生ROS[32];镉离子含量的增加会导致ROS的产生量持续增加,引起胞内ROS聚集;过量的ROS导致亚细胞结构的破坏,并使其他酶失活,破坏色素和光合系统,导致藻细胞光合作用和其他代谢过程发生紊乱[33-34]。为了应对镉胁迫产生的ROS氧化压力,细胞合成SOD消除ROS的毒性效应;这使得SOD酶活性应激性增强。
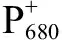
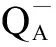
Cd2+会直接影响藻细胞的色素成分和生长增殖[7, 37-40],本研究发现,0.25、0.50和1.00 mg·L-1Cd2+处理集胞藻时,其叶绿素含量受到显著抑制。该结果与已有文献的研究结果类似[26, 41]。另一方面,本试验0.05 mg·L-1的Cd2+能促进集胞藻叶绿素的合成。与之前的研究结果“低浓度Cd2+(0.1 mmol·L-1)能促进集胞藻生长和叶绿素合成”[38],导致蛋白质合成以及细胞中可溶性糖含量增多[23]等类似;这些结果均表明集胞藻能够耐受一定浓度的Cd2+。推测该现象为“毒性兴奋效应”,低毒性能激发藻细胞的代谢能力,促进藻细胞大分子的合成。综合以上分析,集胞藻能耐受不高于0.25 mg·L-1的Cd2+浓度胁迫,高浓度的Cd2+对集胞藻生长具有显著抑制作用。

