血清6型鸭疫里默氏杆菌发酵工艺与攻毒模型的建立
崔松奇,饶潇君,赵海明,田春利,阎燊,张文芳,张丹丹,李娥,刘洋,余海涛,刘兴刚,孔敏,高月花,胡峰,黄兵,李玉峰


摘 要:本试验对不同地区分离的3株血清6型鸭疫里默氏杆菌,通过摇瓶试验筛选出血清6型鸭疫里默氏杆菌适宜的增菌液体培养基和细菌计数培养基,通过5L发酵罐各菌株生长曲线的对比,筛选出适合工业化发酵的菌株以及发酵工艺参数,通过鸭疫里默氏杆菌疾病模型条件筛选确立了攻毒模型。结果显示:WF201910株和TA201912株适宜的增菌液体培养基为商品化的RA培养基,LY202001株适宜的增菌液体培养基为商品化的TSB培养基,三个菌株适宜的细菌计数培养基均为TSA培养基;5 L发酵罐发酵TA201912株在RA液体培养基最高菌数可以达到3.28×1010 CFU/mL,通过500 L发酵罐放大工艺验证,该工艺参数适合于规模化生产;4周龄雏鸭腿部肌肉注射鸭疫里默氏杆菌3 d后开始发病,发病与死亡高峰期为攻毒后3~6 d,临床症状与病原学鉴定均符合血清6型鸭疫里默氏杆菌疾病。本试验为血清6型鸭疫里默氏杆菌灭活疫苗的研制打下了基础。
关键词:鸭疫里默氏杆菌;血清型;发酵工艺;攻毒模型
中图分类号:S858.32 文献标识码:B文章编号:1673-1085(2022)01-0012-08
鸭疫里默氏杆菌病是由鸭疫里默氏杆菌(Riemerella anatipestifer,RA)引起的一种高致病性、接触性传染病,又称鸭传染性浆膜炎(infectious serocitis,IS),可引起雏鸭和雏鹅的肝周炎、纤维素心包炎和气囊炎等,因死亡、消瘦、淘汰、胴体品质下降、疾病治疗等造成巨大的经济损失[1]。
鸭疫里默氏杆菌主要感染1~8周龄,尤其是2~3周龄的雏鸭,引起多发性、渗出性炎症和全身性败血症[2]。临床上主要表现为眼和鼻分泌物增多、喘气、咳嗽、下痢、共济失调和头颈震颤,慢性经过的病鸭主要表现为脑膜炎症状、颈斜、生长缓慢或成僵鸭。剖解病变以纤维素性心包炎、肝周炎和气囊炎为特征[3-5]。鸭疫里默氏杆菌病发病率可达90%以上,死亡率高达75%。该病在世界范围内广泛流行,是目前危害养鸭业最为严重的细菌性传染病之一,给养鸭业造成巨大经济损失[3]。
通过对近3年200余株鸭疫里氏杆菌的分离鉴定,以及相关报道,目前鸭疫里默氏杆菌的流行血清型主要有血清1型、2型、6型、7型,占分离菌株的80%以上。目前商品化的鸭传染性浆膜炎疫苗有1型、2型、4型、7型的、10型二价或三价疫苗以及与大肠杆菌的二联灭活疫苗,由于鸭疫里默氏杆菌各血清型之间交叉保护效果不好,而且缺少商品化的血清6型鸭疫里默氏杆菌的相关疫苗,在国家禁抗、限抗的大背景下,血清6型鸭疫里默氏杆菌在部分养鸭地区成为了主要的流行菌株,给养殖户造成了很大的损失,因此开展血清6型鸭疫里默氏杆菌的研究,开发出含有血清6型鸭传染性浆膜炎灭活疫苗迫在眉睫。
1 材料
1.1 试验动物
190只25~30日龄肉鸭,由河北廊坊种鸭场提供。
1.2 菌株
血清6型鴨疫里默氏杆菌WF201910株、TA201912、LY202001株,由山东省农业科学院家禽研究所提供。
1.3 培养基
TSA、TSB 培养基均由本试验室配制。
RA专用液体培养基与固体培养基购自洛阳宏顺技术有限公司。
1.4 主要仪器
BIOTECH 型发酵罐(5 L),购自上海保兴生物设备工程有限公司;500 L生产规模发酵罐,购自青岛某设备科技有限公司;紫外可见分光光度计,购自尤尼柯仪器有限公司。
2 方法
2.1 培养基筛选
取冷冻保存的血清6型鸭疫里默氏杆菌WF201910株、TA201912、LY202001株,每株细菌分别接种于TSB与RA专用液体培养基中,37 ℃培养24 h,TSB活化的细菌划线于TSA固体平板,RA专用液体培养基活化的细菌划线于RA专用固体平板,置于37 ℃、5%CO2培养箱中培养24 h。挑选凸起、边缘整齐、奶油状、透明、光滑菌落,TSA平板培养的菌落接种于TSB液体培养基中,RA专用固体平板培养的菌落接种于RA专用液体培养基中,37 ℃培养18 h。TSB培养的细菌按照5%的比例接种于TSB摇瓶中,RA专用液体培养基培养的菌落按照5%的比例接种于RA专用液体培养基摇瓶中,37 ℃摇床上培养,每1 h对每个摇瓶取样1次,进行OD值的测定和活菌计数。
2.2 菌株筛选
将发酵至OD值(600 nm)达到1.3~1.5的WF201910株和TA201912株血清6型鸭疫里默氏杆菌制备的二级菌种,按照5%的比例接种于RA专用液体培养基5 L发酵罐中,将发酵至OD值(600 nm)达到1.3~1.5的LY202001株血清6型鸭疫里默氏杆菌制备的二级菌种按照5%的比例接种于TSB培养基5 L发酵罐中。调节溶氧为30%~50%,初始转速为200 RPM,每0.5 h取样1次,进行OD值的测定和活菌计数。
2.3 规模化发酵罐工艺验证
取适宜培养基中培养达到最高菌数的筛选菌株,按照5 L发酵罐摸索的发酵参数与收获终点判定标准,开展500 L发酵罐工艺验证。将发酵至二级菌种OD值(600 nm)达到1.3~1.5,按照5%的比例接种至500 L发酵罐中,培养体积为350 L,发酵过程中通过调节搅拌转速和通气量使溶氧维持在30%~50%,每1 h取样一次进行OD值测定、活菌计数与纯粹检验。
2.4攻毒模型的建立
2.4.1 菌种存活率 各菌株活化后接种于TSB培养基37 ℃培养18 h,进行细菌计数和OD值(600 nm)的测定,2~8 ℃保存,24 h后再次进行细菌计数,确定每个菌株2~8 ℃保存24 h细菌的存活率。
2.4.2 预估菌数 正式培养各菌株,确保各菌株收获的OD值(600 nm)与存活率试验收获的OD值(600 nm)相同,然后进行细菌计数,待24 h后细菌计数结果统计后,计算各菌株的预估菌数。预估菌数=计数结果×各菌株存活率
2.4.3 稀释度 按照预估菌数把各型菌株稀释为2×1010 CFU/mL、2×109CFU/mL 、2×108 CFU/mL、2×107 CFU/mL 、2×106 CFU/mL、2×105 CFU/mL 6个稀释度。
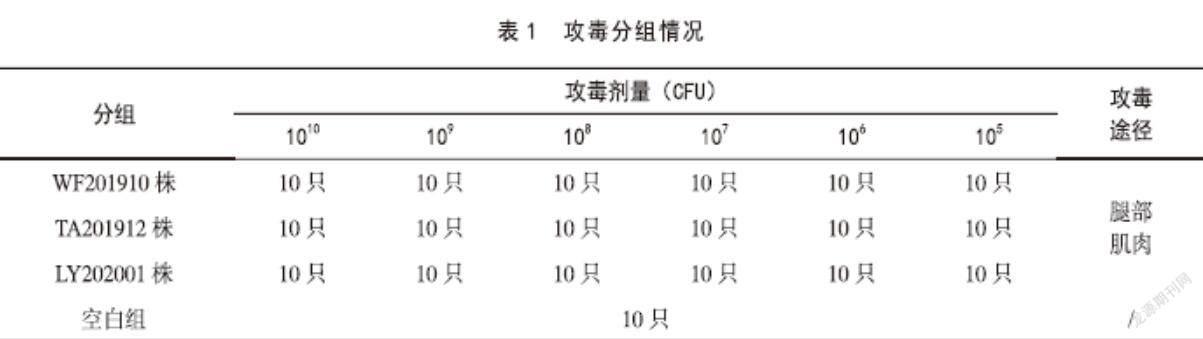
2.4.4 攻毒试验 取25~30日龄血清6型鸭疫里默氏杆菌抗原抗体双阴性的易感鸭180只,每个菌株每个稀释度腿部肌肉攻毒0.5 mL,同时10只不接种作为空白对照,在攻毒动物房隔离器内隔离饲养。攻毒后每天观察试验动物的精神状态、采食情况、发病情况,连续观察7日,期间死亡的试验动物及时进行解剖,第8天所有试验动物无论发病与否全部解剖,观察病理变化情况,同时进行病原分离和生化鉴定。攻毒7日,以10只易感鸭8只发病的最小剂量作为该菌株的发病剂量。攻毒分组和攻毒剂量情况见表1。
3 结果
3.1 培养基筛选
各菌株培养基摇瓶培养结果见表2、表3。
由表2、表3可知,各菌株使用RA专用液體培养基培养和TSB液体培养基培养后进行活菌计数,结果显示3个菌株生长曲线均出现了TSA平板计数结果显著高于RA平板细菌计数结果,说明血型6型鸭疫里默氏杆菌更适合于在TSA平板上生长;同时对比同一菌株在不同液体培养基的细菌生长曲线可以看出,WF201910株和TA201912株适宜的增菌液体培养基为商品化的RA培养基,LY202001株适宜的增菌液体培养基为商品化的TSB培养基。各菌株使用适宜培养基5 L发酵罐培养结果见表4。
由表4可以看出,菌株WF201910株在RA液体培养基最高菌数可以达到2.32×1010 CFU/mL,TA201912株在RA液体培养基最高菌数为3.28×1010 CFU/mL,LY202001株在TSB培养基最高菌数可以达到1.95×1010 CFU/mL,表明TA201912株更适合于规模化生产。
3.2 规模化500 L发酵罐参数验证试验结果
结果见表5。
由表5可以看出,TA201912株按照5 L发酵罐的工艺参数进行500 L扩大生产,最高菌数可以达到3×1010 CFU/mL以上,说明5 L发酵罐的工艺参数可以用于规模化生产。
3.3 攻毒模型试验结果
3.3.1 不同菌株攻毒效果比较 3个菌株不同攻毒剂量攻毒结果分别见表6、表7、表8。
由表6、表7、表8不同菌株攻毒效果可以看出,WF201910株按照1×1010 CFU进行攻毒,发病率可达90%;TA201912株按照1×109 CFU进行攻毒,发病率可达90%;LY202001株按照1×109 CFU进行攻毒,发病率可达100%,均符合发病标准。
3.3.2 各菌株发病试验动物临床症状 各菌株攻毒后发病鸭均出现不同程度的精神不振、行动蹒跚、眼鼻有分泌物流出、排绿色或黄绿色稀薄粪便等的临床症状。
3.3.3 各菌株发病试验动物剖检病理变化 取3个菌株攻毒后濒死鸭解剖,均可见到不同程度的肝周炎,犹如伪膜覆盖在肝脏表面,或薄或厚,纤维素性浆膜炎,心包膜炎,气囊浑浊。不同菌株攻毒后试验动物的剖解病变分别见图1。
3.3.4 各菌株发病试验动物病原分离与鉴定
3.3.4.1 细菌形态 无菌操作取发病鸭肝脏进行涂片,经革兰氏染色镜检可见革兰氏阴性小杆菌;瑞氏染色两端浓染。
无菌操作取各菌株攻毒发病鸭肝脏组织涂抹接种到TSA(含5%新生牛血清)和麦康凯琼脂平板,37 ℃二氧化碳培养箱中培养48h后,在TSA平板上均可见呈凸起、边缘整齐、光滑型菌落;在麦康凯琼脂平板上均不生长。
3.3.4.2 生化鉴定 取各分离菌株开展生化鉴定试验,结果显示葡萄糖、乳糖、麦芽糖、山梨醇发酵试验、VP试验、硫化氢试验均为阴性,明胶穿刺试验呈阳性。各分离菌株生化试验结果见表9。
3.3.4.3 血清型鉴定 取洁净载玻片,用记号笔在载玻片反面划分3个区域,每个区域分别滴加经TSA平板分离的细菌液0.01 mL、阴性血清对照和血清6型阳性对照菌株。然后每个区域分别加入等量的血清6型阳性血清(凝集价不低于1:8),各分离菌株玻板凝集试验结果见表10。
由表10可以看出,各分离菌株均与血清6型阳性血清发生了凝集,证明攻毒后试验鸭发病的原因是鸭疫里默氏杆菌导致的。
4 讨论
4.1 菌株适宜培养基的筛选
从试验结果可以看出,同样是血清6型的鸭疫里默氏杆菌,不同菌株适宜的培养基类型不同,WF201910株和TA201912株适宜的增菌液体培养基为商品化的RA培养基,LY202001株适宜的增菌液体培养基为商品化的TSB培养基。但是从细菌计数情况来看,3株细菌在RA专用固体培养增值的效果都不如TSA平板的增值效果,而且在RA专用固体培养基培养的菌落生长速度慢,菌落数量少,所以在接下来的5 L发酵罐小试与中试试验中均使用TSA平板进行细菌计数。
4.2 适宜于规模化生产的血型6型鸭疫里默氏杆菌筛选
从试验结果可以看出,各菌株以相同OD值的二级菌种按照5%接菌量在5 L发酵罐培养,WF201910株和TA201912株在RA液体培养基最高菌数分别达到2.32×1010 CFU/mL、3.28×1010 CFU/mL,LY202001株在TSB培养基最高菌数可以达到1.95×1010 CFU/mL,结果显示TA201912株在RA液体培养基培养是3种菌株中最适合于规模化生产,可以做为血型6型鸭疫里默氏杆菌规模化生产的后备菌株。
4.3 攻毒模型建立
不同地区的3株血清6型鸭疫里默氏杆菌分离株在毒力方面有所差异,LY202001株毒力最强,以109 CFU/羽剂量进行攻毒可使100%的动物发病,且死亡率高达60%;TA201912株毒力次之,以109 CFU/羽剂量进行攻毒可使90%的动物发病;WF201910株毒力最弱,以1010 CFU/羽剂量进行攻毒可使90%的动物发病。从发病情况来看,3株菌株攻毒后基本上是3 d后开始发病,发病与死亡的高峰期在攻毒后3~6 d。通过临床症状、病理学检查及病原学鉴定,结果显示3株菌株符合该病模型的复制要求,均可作为血清6型鸭疫里默氏杆菌的攻毒用后备菌株。
参考文献:
[1] 夏业才,陈光华,丁家波.兽医生物制品学(第二版)[M].北京:中国农业出版社,2018:893.
[2] SAIF Y M.禽病学[M].北京:中国农业出版社,2012:893.
[3] 任晓梅,王小兰,韩文龙,等. 鸭疫里默氏杆菌的分离鉴定与生物学特性研究[J].中国动物传染病学报,2018, 26(3): 47-51.
[4] 程安春,汪铭书,陈孝跃,等.我国鸭疫里默氏杆菌血清型凋查及新血清型的发现和病原特性 [J].中国兽医学报,2003,23(4):320-323.
[5] 张大丙,郭玉璞.不同血清型鴨疫里氏杆菌分离株的部分特性比较[J].中国兽医杂志,1999,25(10):13-15.
Establishment of Fermentation Technology and Infected Model of Riemerella anatipestifer Serotype 6
CUI Songqi1,RAO Xiaojun1,ZHAO Haiming1,TIAN Chunli1,YAN Shen1,ZHANG Wenfang1,
ZHANG Danan1,LI E1,LIU Yang1,YU Haitao1,LIU Xinggang1,KONG Min1,GAO Yuehua2,
HU Feng2,HUANG Bing2,LI Yufeng2
(1.Haowei Biotechnology Co. , Ltd. ,Tianjing 301700,China;
2.Institute of Poultry Science, Shandong Academy of Agricultural Science, Key Laboratory of Poultry Diseases Diagnosis and Immunology, Jinan 250100, China)
Abstract: In this experiment, 3 strains serotype 6 of Riemerella anatipestifer (RA) from different geographical locations were isolated. We selected the liquid culture medium and bacterial counting medium by the test of shaking flask, and got the technical parameter through the contrast test of the growth curve of the strains by 5 L fermentation tank of industrial propagation. Disease model were slected through the infected model. The results show that, the optimum fermentation liquid culture medium of WF201910 strains and TA201912 strains were commercial RA culture medium, and the optimum fermentation liquid culture medium of LY202001 strains were commercial TSB culture medium. While bacterial counting culture medium of TSA were suited for all the three strains. Through 5 L fermentation tank the number of TA201912 strains viable bacteria reached a peak 3.28×1010 CFU/mL by using commercial RA culture medium, which technical parameter were also suited by using 500 L fermentation tank in the fermentation process. We administered the RA to 4-week old duckling by muscular injection in the leg, which clinical signs appeared after 3 days, and the peak of morbidity and mortality reached at 3~6 days. Clinical signs and etiological identification were corresponding to the disease caused serotype 6 of RA. This experiment provided preliminary guidance for the inactivated vaccine of serotype 6 of RA.
Keywords: Riemerella anatipestis; Serotype; Fermentation Technology; Infected Model

