线粒体靶向抗氧化剂SS-31对脓毒症小鼠模型急性肝损伤的影响
满明银, 李娜娜, 卜 月,于凯江
哈尔滨医科大学附属第一医院 重症医学科, 哈尔滨 150000
脓毒症是严重感染引起的宿主反应失调导致的致命性器官功能障碍[1]。2016年的一项荟萃分析[2]显示,每年可能有530万人因脓毒症而死亡。导致脓毒症患者死亡的主要原因是多器官衰竭。肝脏具有解毒、代谢、合成、分泌等重要功能,对于维持人体生理稳态具有重要作用[3]。肝脏也是人体重要的免疫器官[4],是脓毒症最易损伤的器官之一[5]。研究[6]表明,脓毒症相关肝损伤发病率为34.7%。相关研究[7]认为,肝脏的损伤常发生在脓毒症早期。脓毒症相关肝损伤按照发病机制可分为原发性和继发性,继发性肝损伤为促炎因子及活性氧自由基(ROS)等所致损伤[8]。
SS-31(在文献中也被称为Elamipretide, MTP-131, BendaviaTM)是一种水溶性、芳香阳离子线粒体靶向四肽。近年来在不同病因引起的线粒体功能障碍的相关研究[9-12]中,SS-31被证明可在包括肾脏、脑、心脏和骨骼肌在内的多个器官中改善线粒体功能,抑制线粒体ROS 的产生、降低促炎介质水平。但目前尚未有SS-31在脓毒症相关急性肝损伤中的研究,尚不清楚其能否减轻脓毒症相关肝损伤。
本实验通过观察SS-31能否减少脓毒症小鼠氧自由基的释放及促炎因子的产生,从而对脓毒症相关急性肝损伤起到抗炎、抗氧化的保护作用,进而为脓毒症肝损伤的防治提供新的治疗靶点及靶向治疗药物。
1 材料与方法
1.1 材料
1.1.1 实验动物 选用6~8周龄SPF级C57BL/6J 雄性小鼠(北京维通利华实验动物技术有限公司),体质量19~23 g。实验动物生产许可证号:SCXK(京)2016-0011;实验动物使用许可证号:SYXK(黑)2021-004。
1.1.2 主要仪器和试剂 微量冷冻离心机(美国Thermo公司),高速冷冻离心机(美国Thermo公司),-80 ℃冰箱(美国Thermo公司),实验室纯水净化器(美国Thermo公司),精密电子天平(瑞士Mettler Devices公司),多功能酶标仪(美国MD SpectraMax M5),小动物麻醉机(美国 Surgivet 公司);ELISA试剂盒(江苏酶免实业有限公司),PBS 1×(500 mL)(美国SIGMA公司),SS-31(杭州专肽生物技术有限公司)。
1.2 模型制备
1.2.1 实验动物分组 24只实验小鼠随机分为对照组(control组) 、治疗药物组(control+SS-31组)、脓毒症肝损伤组(LPS组) 、脓毒症肝损伤 +治疗药物组(LPS+SS-31组) ,每组均为 6 只。
1.2.2 模型建立 实验小鼠在实验前12 h 开始禁食,实验前4 h 禁水。造模前各小鼠称重,control组、control+SS-31组小鼠按体质量给予10 mL/kg的PBS液腹腔注射,LPS 组、LPS+SS-31组小鼠按体质量给予10 mL/kg 的LPS( PBS液稀释至1 mg/mL) 腹腔注射。继之control组、LPS组小鼠按体质量给予生理盐水10 mL/kg腹腔注射,control+SS-31组、LPS+SS-31组小鼠给予SS-31(生理盐水溶解至1 mg/mL) 10 mg/kg腹腔注射。注射器为胰岛素针 30号5/16(0.3 mm×8 mm)。
1.3 取材
1.3.1 动物麻醉及取材准备 4组小鼠于模型建立12 h后使用小动物麻醉机在小鼠活体状态下给予异氟烷实行吸入麻醉。麻醉满意后,固定于仰卧位,于腹正中线行1.5~2.0 cm 的纵行切口,充分暴露胸腹部,取心腔血及肝组织。
1.3.2 血标本采集 充分暴露胸部后,以 1 mL注射器缓慢抽血,收集血液试管为EP管(每管内预先加入10 μL肝素抗凝),血液收集完毕后混匀,置于冰盒中静置15 min后,4 ℃条件下离心(4000 r/min) 5 min,取上清液,分装做好标记,-80 ℃冰箱保存,待行血清肝功能检测。
1.3.3 组织标本采集 小鼠处死后,打开腹腔,游离并取出肝脏,每只小鼠取出肝脏的左外侧叶置入4%多聚甲醛溶液中固定48 h,然后进行石蜡包埋、切片,并行HE染色,观察病理组织学改变;剩余肝脏组织保存于-80 ℃冰箱。
1.4 检测方法
1.4.1 小鼠血清指标检测 取上清液,采用ELISA试剂盒检测小鼠血清中ALT、AST的浓度值。依次将5组不同浓度的标准品加入室温平衡20 min后酶标板中,将解冻后的10 μL待检样品和40 μL样品稀释液先后加入预先设计的待检样品孔中,除空白孔外,每孔加入由过氧化物酶(HRP)标记的抗体 100 μL,用封板膜封住反应孔,37 ℃恒温箱中孵育 60 min。倒掉上层液体,拍干,用稀释后的洗涤液反复洗板 5 次,在所有孔中先后加入底物A、B各 50 μL,37 ℃避光孵育15 min。加入终止液 50 μL,通过多功能酶标仪测定 450 nm 处吸光度值,再根据计算公式得出实际样品浓度。操作严格按照ELISA试剂盒说明书进行。
1.4.2 小鼠肝脏病理切片 小鼠肝脏组织浸泡于甲醛溶液中固定48 h后,将肝脏组织进行修型,放置于石蜡包埋盒中经过脱水、透明、浸蜡等过程,进行包埋。包埋后进行组织切片,厚度为 4 μm,将载有石蜡切片的载玻片置于60 ℃烤箱中烘烤2 h,置于室温过夜。石蜡切片经脱蜡、组织软化、苏木精染色、盐酸乙醇分化、伊红染色、脱水、透明后封片。HE染色后切片于显微镜下观察其病理变化。
1.4.3 ELISA 法测定小鼠肝组织ROS、超氧化物歧化酶(SOD)、IL-1β、IL-6、TNFα 水平 取0.1 g 肝组织,置于冰上剪碎后置于EP管中,加入 PBS 液900 μL,充分研磨至组织匀浆,4 ℃条件下离心(3000 r/min)20 min,取上清液并做好标记,并使用ELISA试剂盒进行检测。检测过程严格按照ELISA试剂盒检测方法及说明书进行。
1.5 伦理学审查 本研究方案经由哈尔滨医科大学实验动物伦理委员会审批,批号:2021037,符合实验室动物管理与使用准则。

2 结果
2.1 各组小鼠表现 各组小鼠模型制备完成后12 h观察各组小鼠状态。4组小鼠均无死亡,control组及control+SS-31组小鼠较造模前未见明显异常表现;LPS组及LPS+SS-31组小鼠出现不同程度的精神萎靡、少动、蜷缩、毛发竖起、大便不成形等情况,其中LPS+SS-31组小鼠上述异常表现程度较LPS组轻。各组间小鼠体质量比较,差异无统计学意义(表1)。
2.2 各组小鼠血清指标比较 为检测SS-31能否减轻脓毒症肝损伤,比较4组小鼠血清中 ALT、AST水平。与control组比较,LPS组小鼠血清中 ALT、AST水平均显著升高(P值均<0.05);与LPS组小鼠比较,LPS+SS-31组小鼠血清中 ALT、AST水平均显著降低(P值均<0.05)(表1)。
2.3 各组小鼠氧化应激指标比较 为检测SS-31能否减轻脓毒症小鼠氧化应激,比较4组小鼠肝组织匀浆上清液中ROS、SOD水平。与control组比较,LPS组小鼠中ROS、SOD水平显著改变(P值均<0.05);与LPS组小鼠比较,LPS+SS-31组小鼠中ROS水平显著降低(P<0.05)(表1)。
2.4 各组小鼠炎性指标水平比较 为检测SS-31能否改变脓毒症小鼠肝组织中炎症介质水平,比较4组小鼠肝组织匀浆上清液中TNFα、IL-1β、IL-6水平。与control组比较,LPS组小鼠中TNFα、IL-1β、IL-6水平均显著升高(P值均<0.05);与LPS组小鼠比较,LPS+SS-31组小鼠中TNFα、IL-1β、IL-6水平显著降低(P值均<0.05)(表1)。
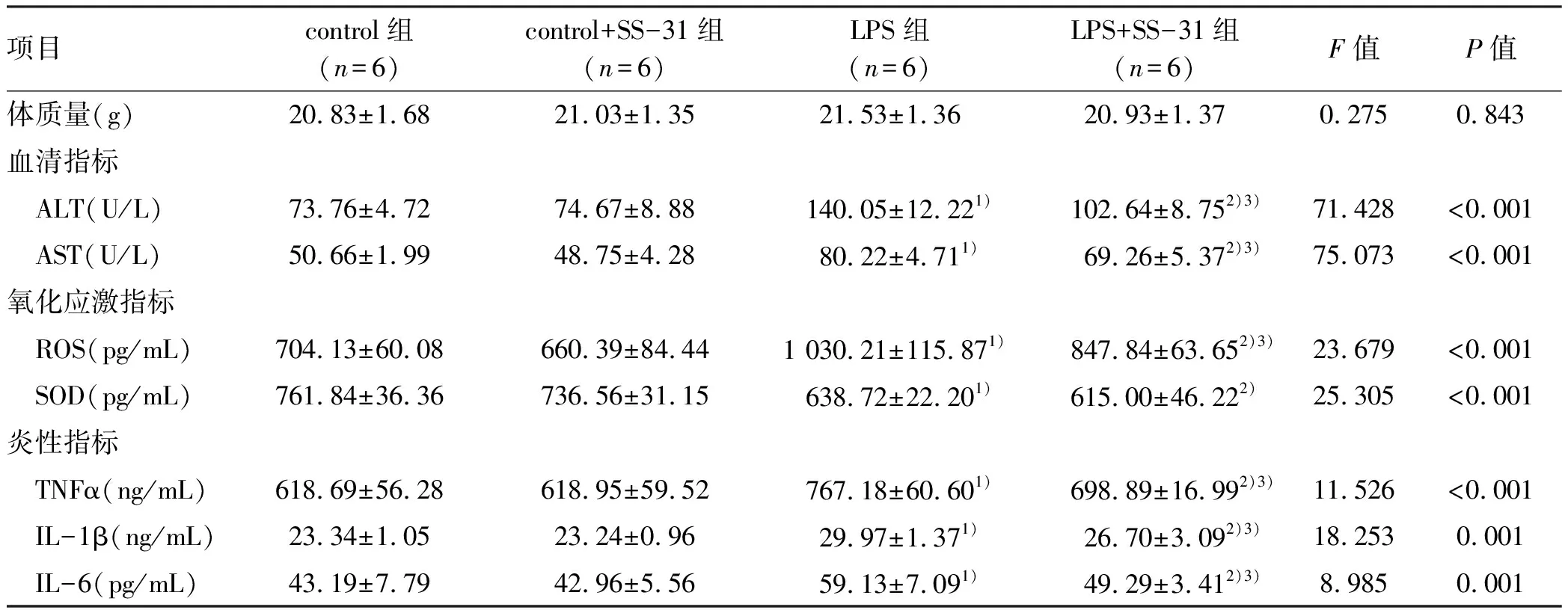
表1 4组小鼠各指标比较
2.5 各组小鼠肝组织病理切片比较 与 control组比较,LPS 组小鼠肝组织切片HE染色显示出肝小叶结构破坏、炎性细胞浸润、细胞间隙模糊、肝细胞肿胀; LPS+SS-31组炎性细胞浸润减少,肝细胞肿胀减轻(图1)。

注:a, control组;b,control+SS-31组;c,LPS组;d,LPS+SS-31组。图1 肝组织病理切片(HE染色,×400)
3 讨论
本实验采用小鼠动物模型,通过监测ALT、AST来反映不同组别脓毒症小鼠的肝损伤情况,并分别从氧化应激、炎症反应、组织病理等多个角度进行分析,探讨线粒体靶向肽SS-31对小鼠脓毒症肝损伤的作用。
脓毒症时易引起包括肝脏在内的多器官损伤,进一步导致器官功能障碍甚至衰竭,在微观上线粒体是脓毒症时易受损伤和出现功能障碍的细胞器,脓毒症所引起的线粒体功能障碍在影响机体ATP能量产生和供应的同时,也引起了大量氧自由基的释放,进一步加重了机体损伤,促进了脓毒症器官损伤的发展。而肝脏作为人体内最大的解毒和免疫器官,当肝细胞受到严重损伤时,其合成、代谢、解毒、分泌与免疫功能发生严重障碍,其对内毒素的清除上发生障碍,反过来加剧了机体的损伤。既往相关研究[9,13-15]表明,SS-31可通过改善线粒体氧化呼吸链中复合物活性、稳定心磷脂改善膜的生物物理性能、减轻线粒体质子泄漏、减少ROS产生等途径改善线粒体功能,减少ROS释放。
本实验研究结果显示,与control组相比,小鼠腹腔注射LPS后12 h,血清中ALT、AST水平均显著升高,表明 LPS 诱发小鼠产生了脓毒症,发生了肝损伤,这与既往研究[16]结果一致。本实验结果表明,使用线粒体靶向肽SS-31后可以减轻脓毒症小鼠的急性肝损伤,且与LPS组相比发现腹腔注射SS-31后降低了脓毒症小鼠模型中的ROS含量,这可能是通过SS-31改善了脓毒症小鼠体内的线粒体功能实现的。ROS可作用于核因子(NF) -κB、活化蛋白-1等氧化还原敏感性转录因子,从而调节促炎基因的转录,增加炎症介质释放,加重炎症反应。本实验结果表明,SS-31可减少小鼠高表达的TNFα、IL-1β、IL-6等炎性因子,这与既往研究[17-18]一致。既往大量研究[19]证实,NF-κB是脓毒症炎症反应的重要通路,SS-31可下调年龄相关的NF-κB的激活,SS-31通过改善线粒体功能,减少ROS的释放,进而减少NF-κB通路的激活及炎症介质释放可能是SS-31减轻炎症反应的重要机制之一。氧化应激产生的大量ROS可导致体内SOD消耗,使SOD浓度降低,但本实验使用SS-31未能逆转SOD的降低,这可能与SS-31使用后仍超过某一“阈值”导致SOD被消耗有关。既往相关研究[20-21]证明了SS-31应用的安全性与耐受性良好,在本实验中,与对照组相比,未发现注射SS-31药物后小鼠产生不良反应,为SS-31应用的安全性提供了支持。
综上所述,本实验结果表明在脓毒症小鼠腹腔注射SS-31治疗后,可减少体内ROS的产生,下调脓毒症时高表达的炎性因子,从而减轻小鼠脓毒症肝损伤。通过对线粒体功能开展多方面机制研究,线粒体靶向药物有望为脓毒症的治疗提供新的靶点。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:满明银负责课题设计,资料分析,撰写论文;李娜娜参与收集数据,修改论文;卜月负责实验及修改论文;于凯江负责拟定写作思路,指导撰写文章并最后定稿。

