青霉素类抗生素的聚合物分析
胡昌勤 张夏 李进
(中国食品药品检定研究院,北京 102629)
对药物杂质谱(impurity profile)的控制是保证药品安全性的重要环节,也一直是当前国内外药品质量控制的热点之一[1-2]。β-内酰胺抗生素主要包括青霉素类和头孢菌素类,作为临床中最重要的一类抗菌药物,由于自身结构的不稳定,产品中有机杂质(有关物质)的种类复杂、含量较低且结构不稳定,对其杂质谱的控制一直备受关注;其中聚合物类杂质作为一类引发β-内酰胺抗生素过敏反应的重要过敏性杂质,目前依然是β-内酰胺抗生素杂质谱控制中的最薄弱环节[3]。伴随着科学技术的进步,液相-质谱联用技术(LC-MS)在杂质谱分析中的广泛应用,使得人们对β-内酰胺抗生素聚合物的聚合反应机理、结构等的认知不断完善,已逐渐形成了相对系统的对聚合物分析的策略与方法。本文以此为线索,综述近年来在青霉素类抗生素聚合物分析中取得的进展。
1 β-内酰胺抗生素聚合物的质谱分析
1.1 凝胶色谱-柱切换-质谱分析技术
LC-MS技术是分析β-内酰胺抗生素聚合物的有效工具,但由于通常无法预测样品中聚合物杂质在反相高效液相色谱(RP-HPLC)系统的出峰位置,使得LC-MS分析存在较大的盲目性。凝胶色谱依据其独特的分子筛机制,通常可以方便地将聚合物类杂质与β-内酰胺药物按分子量分离,虽然其专属性不太理想,但可快速聚焦LC-MS的分析对象。然而,凝胶色谱的流动相通常含有较高浓度的不挥发性无机盐,无法与质谱(MS)系统直接联用,而凝胶色谱-柱切换-质谱分析技术可有效解决这一难题。
凝胶色谱-柱切换-质谱分析技术的实质是二维色谱分析技术,最基本的凝胶色谱-柱切换-质谱分析系统可由3台色谱泵通过一个六通阀连接构成(图1)[4],其实验步骤可概括如下:
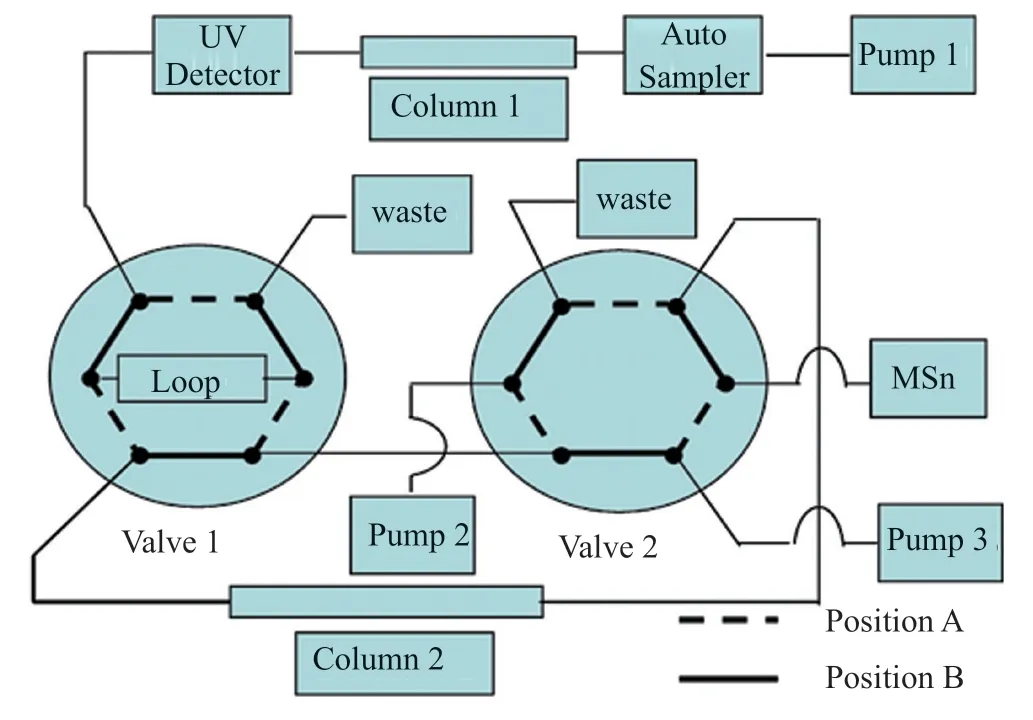
图1 凝胶色谱-柱切换-LC/MS分析系统原理图[4]Fig.1 Schematic diagram of column switching LC/MS system[4]
步骤1:将切换阀1和切换2置于位置A;样品通过泵1(流动相 I)经自动进样器送入色谱柱1,经分离后,由UV检测器检测;此时,泵2(流动相 Ⅱ)通过定量环,平衡色谱柱2;泵3(流动相Ⅲ)清洗质谱仪。
步骤2:当检测器检测到目标杂质时,切换阀1从位置A切换至位置B,保持0.5 min,然后再切换回位置A;切换阀2保持在位置A不变;此时,tR±0.25 min的目标杂质峰被切换到定量环中。
步骤3:切换阀1和切换阀2保持在位置A,目标杂质由泵2(流动相Ⅱ)通过定量环送入色谱柱2,持续约5 min进行脱盐;同时目标杂质在色谱柱2中被富集。
步骤4:脱盐结束后,切换阀2从位置A切换至位置B,切换阀1保持在位置A,此时,保留在色谱柱2中的目标杂质由泵3(流动相Ⅲ)被送至质谱仪采集质谱数据。
一维色谱中的色谱柱1为凝胶色谱柱,通过流动相Ⅰ对杂质进行分离;二维色谱中的色谱柱2采用C18脱盐短柱,通过流动相Ⅱ对目标杂质进行脱盐与富集;流动相Ⅲ不仅用于洗脱目标杂质,其还应有利于目标杂质在MS分析中的电离。以对注射用哌拉西林钠/他唑巴坦钠的聚合物杂质分析为例,采用TSK凝胶色谱系统分析其强制聚合溶液,在药品主成分之前明显可见4个杂质峰(图2A),采用柱切换-质谱分析技术对凝胶色谱系统中分离到的每一个组分进行质谱分析,共可鉴别出7种不同结构的杂质,其中6种为聚合物杂质[5]。以对凝胶色谱中Polymer-2组分的分析为例,经凝胶色谱(一维色谱)分离后,Polymer-2组分被切换到二维色谱的色谱柱2上,经脱盐后,由流动相Ⅲ洗脱到质谱系统;总离子流质谱图提示Polymer-2中含有两个组分(图2B~C),分别对这2个组分进行质谱分析,二者在一级质谱图中均存在m/z为1071.4的准分子离子峰,二级质谱图中的裂解碎片相似(图2B~C),根据对质谱碎片的解析,推测他们均为哌拉西林开环二聚体哌嗪开环物(图2D)。上述结果提示,凝胶色谱-柱切换-质谱分析中的二维色谱系统,不仅具有脱盐、富集功能,且与适宜的流动相Ⅲ配合还兼有对凝胶色谱组分进一步分离的作用。该功能已在对多个品种的聚合物分析中被成功应用。

图2 凝胶色谱-柱切换-质谱分析技术分析哌拉西林钠/他唑巴坦钠聚合物杂质Fig.2 Analysis of polymer impurities in piperacillin sodium tazobactam sodium by gel chromatography-column switched-mass spectrometry
1.2 聚合物结构分析中质谱参数的选择
在对β-内酰胺抗生素聚合物进行在线分析时,利用一级质谱确定目标杂质的分子量,利用二级质谱分析其裂解规律,推测聚合物的可能结构是目前常用的分析策略。对药物活性成分(API)分子质谱裂解规律的系统解析有助于对聚合物结构的解析。 在对青霉素类抗生素聚合物进行质谱解析时,关键是确定聚合物的聚合位点,而正确地设定质谱参数有助于对聚合位点的判断。李晓东等[6]通过比较正离子模式下不同碰撞能量对二级质谱分析中阿莫西林闭环二聚体(杂质J)和开环二聚体(杂质K)裂解途径的影响,探讨质谱参数对聚合物聚合位点处的裂解规律。由图3可知,确定阿莫西林二聚体发生a、b、c裂解的特征碎片离子,有助于帮助推断聚合物的结构。
对闭环二聚体,在碰撞能量为5 V时,二级质谱图中m/z731(分子离子峰)与m/z366(a裂解产生的阿莫西林分子离子峰)的离子丰度相对较强,且出现m/z572(b裂解产物)的特征离子;碰撞能量为15 V时,出现m/z396(m/z572碎片的c裂解脱氨产物)、m/z498和m/z349的特征离子,提示阿莫西林6位侧链的氨基易丢失;碰撞能量为25 V时,m/z498离子消失,m/z311离子出现,且m/z311离子是高碰撞能量下唯一能观测到的聚合物特征碎片(图3A)。上述结果提示,在碰撞能量5~15 V范围获得的质谱图易于对阿莫西林闭环二聚体裂解途径的解析。
对开环二聚体,在碰撞能量为5 V时,二级质谱图中m/z749(分子离子峰)与m/z705(脱氨基后形成的分子离子峰)的离子丰度相对较强,m/z546(b或c裂解产物)的特征离子峰较弱,未见m/z366的特征离子(a裂解产生的阿莫西林分子离子峰);碰撞能量为15 V时,高丰度特征碎片离子有m/z688、m/z556、m/z546和m/z529;碰撞能量为25 V时,出现m/z366,且可见m/z399和m/z323的特征离子。提示开环二聚体的聚合位点(a裂解途径)不易发生断裂,而易发生脱羧、脱氨、6位侧链酰胺键的断裂和脱四氢噻唑环的反应(图3B),进而形成一系列有别于闭环二聚体的特征碎片离子。上述结果还提示,在碰撞能量15~25V范围获得的质谱图易于对阿莫西林开环二聚体裂解途径的解析。

图3 阿莫西林二聚体的质谱裂解规律[6]Fig.3 Mass fragmentation process of amoxicillin dimers[6]
2 对青霉素聚合反应机理的探讨
根据青霉素类抗生素的聚合反应机理推断出聚合物的可能结构,再利用LC-MS技术分析目标杂质的质谱裂解途径,验证所推测结构的正确性是实践中较方便、实用的方法。通过对文献的汇总,我们认为青霉素类抗生素可能发生3类4种聚合反应[7]:第一类为羧基与β-内酰胺环的反应,包括聚合反应I(青霉素的2位羧基与另一分子药物β-内酰胺环的反应)和聚合反应Ⅱ(一分子青霉素β-内酰胺开环形成的羧基与另一分子药物β-内酰胺环的反应);第二类为聚合反应Ⅲ(青霉素侧链的氨基与另一分子药物β-内酰胺环的反应);第四类为聚合反应Ⅳ(药物侧链的氨基与另一分子药物2位羧基的反应)。利用计算化学的方法,推测各种聚合反应的反应途径与机理及优势聚合反应,结果显示,对6位侧链不含氨基的青霉素类药物,聚合反应I的反应活化能较低为优势反应,实际产品中的聚合物主要为聚合反应I的产品及降解物[7-8];对6位侧链含有氨基的青霉素类药物,聚合反应Ⅲ最容易发生,实际产品中的聚合物主要为聚合反应Ⅲ的产物及降解物[7]。以氨苄西林为例,根据青霉素的聚合反应机理推测其可能存在4种二聚体结构(图4A),反应活化能计算提示二聚体Ⅲ为优势反应(图4B),通过对氨苄西林强制聚合溶液(约100 mg/mL水溶液,室温放置10 d)的LC-MS分析,证明色谱峰1、3和4均为聚合反应Ⅲ形成的二聚体,色谱峰5为二聚体Ⅳ开环物,色谱峰2可能为二聚体Ⅲ开环物,没有发现二聚体I和二聚体Ⅱ(图4C);虽然氨苄西林按聚合反应Ⅲ途径聚合,理论上可以形成4种二聚体Ⅰ的差向异构体,但实际聚合样品中,色谱峰4为优势产物,提示聚合产物具有明显的构型优势[7]。这也较好地解释了对氨苄西林、阿莫西林实际产品分析时通常仅发现一种二聚体杂质[8-10]的现象。

图4 基于青霉素聚合反应机理分析氨苄西林聚合物[7]Fig.4 Analysis of ampicillin polymers based on the polymerization mechanism[7]
理论计算及对青霉素G钠、青霉素V钾和苯唑西林钠中的聚合物分析,均证明青霉素羧基与β-内酰胺环的聚合反应(聚合反应Ⅰ)是侧链不含氨基结构的青霉素的优势聚合反应途径[7,11-12],但在磺苄西林钠的强制聚合溶液中未发现任何一种二聚体,提示该类药物聚合反应不易发生[12]。由于在氨苄西林强制聚合溶液中也未发现聚合反应Ⅰ的产物[7],提示侧链具有较强吸电子基团的青霉素分子不易发生聚合反应Ⅰ。
此外,对氨苄西林钠/舒巴坦钠、阿莫西林/克拉维酸钾和哌拉西林钠/他唑巴坦钠复方制剂的分析中,虽然理论计算表明,青霉素类药物与酶抑制剂均可以按聚合反应Ⅰ途径形成异聚体,但对实际样品的分析均没能发现有异聚体的存在[5,10,13],其原因有待进一步的研究。
3 对青霉素聚合物的MS解析
虽然青霉素类抗生素可能发生3类4种不同的聚合反应,但不同聚合物具有不同的质谱裂解途径,因此依据其分子量和二级质谱对裂解规律的解析可以予以鉴别。如LC-MS分析青霉素G强制聚合溶液中的二聚体Ⅰ、二聚体Ⅱ和二聚体Ⅰ开环物,三者的二级质谱图明显不同(图5A);二聚体Ⅰ分子中由于存在完整的青霉素G结构和青霉素开环物结构,故其不仅易发生脱羧等青霉素开环物常见的裂解反应,还能发生青霉素G的特有裂解反应如e裂解(脱C=O)等(图5B),出现独特的m/z552、m/z506和m/z477等特征离子;而二聚体Ⅰ开环物和二聚体Ⅱ的分子量虽然相同,但前者更易在聚合位点a处发生裂解,形成m/z353和m/z309等特征离子(图5B),进而有别于二聚体Ⅱ[7]。

图5 3种青霉素G二聚体的质谱分析Fig.5 Mass spectrometric analysis of three kind of dimers of penicillin G
利用不同聚合物质谱裂解途径的差异,在LC-MS分析中可分别对不同的杂质峰进行解析。如分析苯唑西林钠强制聚合溶液[12],色谱峰1、色谱峰2和色谱峰3一级质谱图中的准分子离子峰均提示三者的分子量为820 Da,但色谱峰1和色谱峰3的质谱图基本相同,与色谱峰2的质谱图明显不同(图6A),提示色谱峰1和色谱峰3为同分异构体;色谱峰1和色谱峰3二级质谱中的主要裂解碎片m/z402、376、384、243等符合聚合物Ⅱ的质谱裂解规律(图6B),提示二者为苯唑西林二聚体Ⅱ的一对差向异构体;色谱峰2二级质谱图中的主要裂解碎片m/z402、643、579、287、243等符合聚合物Ⅰ开环物的裂解规律(图6C),提示其为苯唑西林二聚体Ⅰ开环物。

图6 苯唑西林钠二聚体的质谱分析Fig.6 Mass spectrometric analysis of dimers of oxacillin sodium
青霉素聚合物自身结构不稳定性,易发生各种不同的降解,故增加了聚合物分析的难度。如采用LC-MS分析青霉素V钾中的聚合物时,杂质峰Ⅱ的分子量为674Da;虽然依据其分子量结合青霉素的聚合/降解反应机理可推测出3种可能的结构(图7A),但在二级质谱分析中出现的m/z516和m/z174特征碎片(图7B),最大可能产生于二聚体Ⅱ脱羧降解物(图7C),故推测其为二聚体Ⅱ脱羧物。

图7 青霉素V二聚体Ⅱ脱羧降解物的解析Fig.7 Analysis of the decarboxylated degradant of penicillin V dimer Ⅱ
对青霉素聚合物各类常见降解反应的总结,将有助于对聚合物结构的解析。以哌拉西林聚合物为例[5],按不同的聚合反应途径,哌拉西林可形成不同结构的聚合物,聚合物经水解、脱羧可形成不同的开环物和脱羧物;采用TSK凝胶色谱系统分析哌拉西林钠/他唑巴坦钠强制聚合溶液时(图2A),从主成分前的4个杂质峰中共鉴别出的7个杂质。其中,HPSEC-1含有哌拉西林开环物(MW535)、哌拉西林二聚体Ⅱ脱噻唑酸物(MW893)、哌拉西林二聚体Ⅰ(MW1034)和哌拉西林开环二聚体脱羧物(MW1008);HPSEC-2中含有一对哌拉西林开环二聚体哌嗪开环物(MW1070)差向异构体;HPSEC-3中含有哌拉西林开环二聚体(MW1052,USP41中的杂质n);HPSEC-4中含有哌拉西林开环三聚体(MW1560.5)。所有聚合物类杂质不仅包括优势聚合产物二聚体Ⅰ、三聚体及其水解形成的开环物、脱羧物和哌嗪开环物,还包括少量的二聚体Ⅱ脱噻唑酸物。诸杂质的形成过程可概括为图8。但采用二维色谱技术分析该强制聚合溶液时,其RPHPLC色谱图中并没有检出哌拉西林二聚体Ⅱ脱噻唑酸物和哌拉西林开环二聚体哌嗪开环物色谱峰(图9),提示其在样品中的含量较低,仅在被富集后才能被MS检出。此外,在对阿莫西林胶囊热降解聚合物杂质的分析中,发现各类聚合物的降解物主要为脱羧物[6],提示各类青霉素聚合物的降解反应,开环和脱羧作用是其主要的降解反应途径。

图8 哌拉西林聚合物及其产生途径[5]Fig.8 Piperacillin polymers and its production pathway[5]

图9 HPSEC-RP-HPLC-二维色谱法分析哌拉西林强制聚合样品Fig.9 HPSEC-RP-HPLC-2D chromatogram of piperacillin polymerization samples
利用LC-MS进行青霉素三聚体、四聚体等杂质的解析时,首先应根据分子量和聚合反应机理推测出其可能的结构;再通过分析二聚体的裂解规律,寻找代表青霉素母核分子的特征裂解碎片,用于判断高聚物杂质的聚合度。如对阿莫西林高聚物的质谱分析[10],在其强制降解溶液中分别存在分子量为1095、1460和1825 Da的杂质峰,推测他们可能是阿莫西林闭环三聚体、四聚体和五聚体;通过对阿莫西林闭环二聚体质谱裂解规律的解析(图3A),可知其易发生脱四氢噻唑环(丢失159 Da)的反应(b裂解途径),故可以根据脱159 Da的碎片离子数目判断杂质的聚合度。如分子量为1095 Da的杂质,在其二级质谱中存在m/z937.5、m/z778.2、m/z619.2连续3个脱159 Da的碎片离子,提示分子中存在3个159 Da的青霉素母核;m/z555、m/z349、m/z311的碎片与阿莫西林闭环二聚体的碎片相同,故推测其为阿莫西林闭环三聚体(图10)。同理,分子量为1460 Da的杂质,在其二级质谱中存在m/z1302.4、m/z1143.4、m/z984.3和m/z825.4连续4个脱159 Da的碎片离子,提示分子中存在4个159 Da的青霉素母核,推测其为阿莫西林闭环四聚体(图10)。
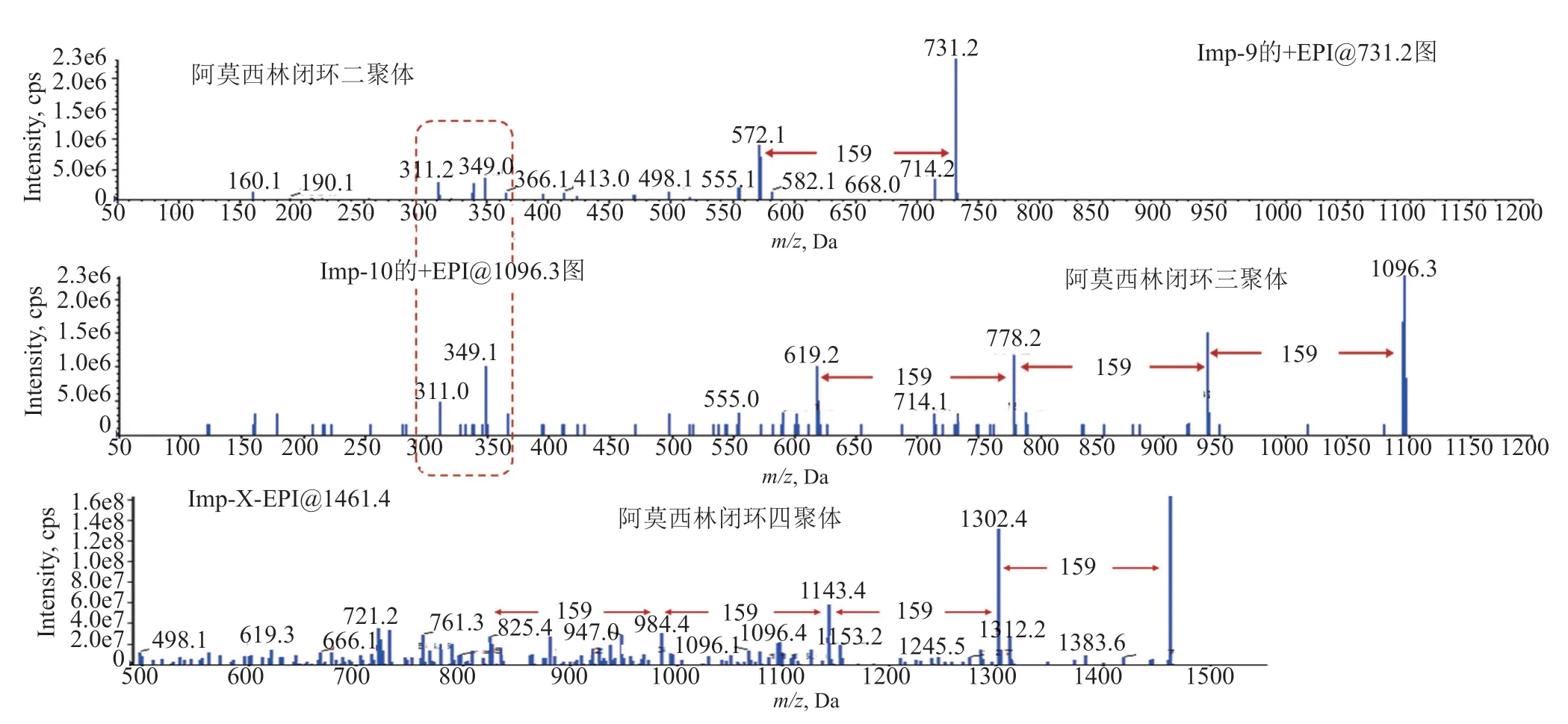
图10 不同聚合度阿莫西林闭环聚合物二级质谱图的比较Fig.10 Comparison of the mass spectra of amoxicillin polymers with different polymerization degrees
4 结论
对青霉素聚合反应机理的研究目前已经取得较大进展,基于母核结构的青霉素聚合反应包括聚合反应Ⅰ(母核的羧基与另一分子β-内酰胺环的反应)和聚合反应Ⅱ(母核水解开环,新形成的羧基与另一分子β-内酰胺环的反应)两类;基于侧链中氨基结构的青霉素聚合反应包括聚合反应Ⅲ(侧链的氨基与另一分子β-内酰胺环的反应)和聚合反应Ⅳ(侧链的氨基与母核2位羧基的反应)。理论计算及强制聚合实验均表明,聚合反应Ⅰ是侧链不含氨基的青霉素类药物的主要聚合反应途径;聚合反应Ⅲ是侧链具有氨基的青霉素类药物的主要聚合反应途径。聚合物以二聚体为主,各类聚合物可进一步发生降解反应,降解物主要包括开环物和各类脱羧物。
对青霉素聚合物的分析,通过理论计算结合强制聚合反应是进行聚合物分析的较理想方案;利用LC-MS在线分析技术,特别是凝胶色谱-柱切换-质谱分析技术,通过选择适宜的质谱条件获取聚合物聚合位点的结构信息,是推测聚合物结构的最有效途径。青霉素闭环聚合物和开环聚合物通常具有完全不同的质谱裂解途径,根据对聚合物质谱裂解途径的解析,可以较好地推断出聚合物的结构;通过对各类聚合物质谱裂解规律的总结,有助于对聚合物结构的解析。

