基于星点设计-效应面法优化红花多糖提取工艺研究
王 锐,李娅兰,白皓天,杨 婧
(黑龙江中医药大学1.药学院,2.基础医学院,黑龙江 哈尔滨 150040)
红花(Carthamus tinetoriusL),又被称为“红蓝花”。本草学考证认为,“红花”最早出现在《新修本草》中,为活血散瘀药,它可以帮助循环和减轻疼痛,排除血瘀[1]。许多报道指出,红花具有抑制冠状动脉肥大、抗氧化、抗心肌缺血、抗凝血、抗血栓形成等多种生物学活性[2-4]。除了作为中药使用外,红花还广泛用于中药生产,如红花油、红花口服液、红花注射液和红花粉等[5,6]。目前关于红花羟基黄色素、红花羟基红色素以及黄酮类成分研究较多,而对红花多糖研究较少。红花多糖是红花的主要化学组成成分之一,主要结构是葡萄糖、阿拉伯糖、木糖和半乳糖[7]。近年来,国内外对红花多糖的研究主要侧重于其抗癌作用和免疫调节作用。Yang 等[8]通过体外实验已经证实红花多糖在体外可以抑制细胞的增殖和诱导细胞凋亡,可以作为一种有效的抗宫颈癌药物的候选药物。因此研究其最佳提取工艺对红花多糖的开发利用有一定的促进作用。
星点设计-效应面法主要是调查独立变量效果的五因素五级实验项目,其基本原理是描述研究因子相互作用对应的效果表面,从效果表面选择最佳效果面积,按照最佳实验条件-最佳效果区域推测所研究的独立变量的值范围[9]。星点设计实验次数较少、预测性好、应用方便,可以在一定程度上改善正交实验的缺点,并且较好地保证了实验的精确度。尽管星点设计-效应面法足以进行因子分析,但精度仍不足以完全取代传统设计,最好首先使用星点效应面法查找最佳区域,然后将效应面优化方法应用于较小范围[10,11]。充分发挥星点设计-效应面法的最大优势。
1 材料与方法
1.1 仪器与试剂
FA2004 分析天平(上海良平仪器仪表有限公司),TDL-40B 台式离心机(上海安亨科学仪器厂),数显式电热恒温水浴锅(上海跃进医疗器械厂),TU -1901 双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),OSB-2200 旋转蒸发仪(日本EYELA 株式社会),葡萄糖(天津市科密欧化学试剂有限公司国药集团化学试剂有限公司)。
1.2 试验方法
1.2.1 提取工艺 采用水提醇沉法:称取一定量的干燥红花,放入锅中并加入蒸馏水,间隔30 min 煎煮一次,共煮3 次之后浓缩至原有体积的1/3。加入4 倍体积的95% 乙醇,放入冰箱冷却24 h 后取出,于离心机中3 000 r/min,离心30 min 得沉淀。将沉淀用去离子水溶解后用95% 乙醇反复沉淀2~3 次,使得红花多糖充分溶出,得到的沉淀45 ℃烘干,最后得到棕黄色固体即红花多糖。
1.2.2 红花多糖的含量测定
1.2.2.1 标准曲线的制作 标准溶液的配制:称取20 mg 无水干燥葡萄糖于200 mL 容量瓶中,定容至刻度。将溶液中的0.1、0.2、0.4、0.8、1.0 mL 准确吸到带塞子的10 mL 试管中,定容至2.0 mL。配制成5~50 μg/mL 的葡萄糖标准溶液[12]。取2.0 mL 蒸馏水将其作为一个空白。
红花多糖溶液的配制:按照标准溶液配制步骤,配制红花多糖溶液浓度为200 μg/mL。从多糖溶液中吸取4~20 mL 到具塞试管中,加水定容至2.0 mL,即制备成40 μg/mL 的多糖溶液。
测定最大吸收波长:精确量取上述葡萄糖液和多糖溶液各1.0 mL,并将试管中加入蒸馏水1.0 mL,分别与5% 苯酚溶液1.0 mL 以及5.0 mL 的浓硫酸混合,密封,冷却至室温。在400 nm~700 nm 之间进行扫描,以确定最高吸收波长。
建立标准曲线:在上述标准系列溶液中加入1 mL 苯酚以及5 mL 浓硫酸,室温放置至冷却,于481 nm 处测定其溶液的吸光度(OD)。
1.2.2.2 精密度实验 准确称量20 mg 的多糖样品,并在481 nm 的条件下按照“1.2.2.1”下的方法,连续测定6 次。
1.2.2.3 重复性实验 精度称取6 个多糖样品,按照“1.2.2.1”方法制备6 个浓度为0.1 mg/mL浓度的溶液,并确定OD 值。
1.2.2.4 稳定性实验 按“1.2.2.1”项下操作,对同一样品分别在0~200 min 处测定OD 值。
1.2.2.5 加样回收率实验 准确称取20 mg 红花多糖,将其放入100 mL 容量瓶中定容至刻度,再吸取1.0 mL 定容至10 mL。精密吸取6份1.0 mL 多糖样品溶液,放入20 mL 试管中,分别加入30、50 μg/mL 的葡萄糖标准溶液1.0 mL 各3 份,按照“1.2.2.1”项下方法操作,根据公式计算回收率。将20 mg 红花多糖置于容量为100 mL 的容量瓶,吸取其中1.0 mL 溶液,加水至10 mL。分别吸取6 种1.0 mL 多糖样品溶液于20 mL 试管中,各自添加3 份浓度为30、50 μ g/mL 葡萄糖标准溶液。按照“1.2.2.1”下方法计算回收率。
回收率=(M-C)÷V×100%
其中M 是混合后测得多糖量,C 是样品中多糖量,V 是葡萄糖加入量。
1.2.2.6 多糖含量的测定 正确称量20 mg 的多糖,放入100 mL 容量瓶中充分搅拌均匀,取1.0 mL 加水至10 mL。 从样品溶液中取1.0 mL,按照“1.2.2.1”项下测定OD 值,根据公式计算含量。
1.2.3 单因素考察实验
1.2.3.1 考察不同因素对提取率的影响 固定其他条件不变,将料液比改为1∶5~1∶20,提取时间为30~120 min,改变提取次数为1~4 次,改变提取温度为70~100 ℃,按照“1.2.1”项下制备红花多糖,进行考察红花粗多糖提取率的变化试验。
1.2.4 星点设计-效应面法优化红花多糖提取工艺
1.2.4.1 星点实验设计 根据单因素分析得出,提取次数对红花粗多糖提取率无显著影响(P>0.05),因此以单因素考察实验为依据,设定料液比(X1)、提取时间(X2)、提取温度(X3)为考察因素,以红花多糖提取率(Y)作为评价指标,各项因子均设置5 水平。分别用-α、-1、0、+1、+α 表示,对于三因素的星点设计α =1.682。实验因素与水平层次安排见表1。

表1 星点设计-效应面法的因素水平Tab 1 Factor level of central point design-response surface method
2 结果
2.1 红花多糖含量测定
2.1.1 标准曲线的制作 通过使用紫外分光光度计扫描范围为400~700 nm 来确定红花多糖最大吸收波长。见图1、2。
采用苯酚-硫酸法[13]。由图1、2 可知,葡萄糖和红花多糖都在481 nm 有最大吸收,因此葡萄糖能够用作红花多糖的标准对照品,以确定其含量。

图1 红花多糖紫外扫描曲线Fig 1 UV scanning curve of safflower polysaccharide

图2 葡萄糖紫外扫描曲线Fig 2 UV scanning curve of glucose
参照“1.2.2.1”下方法,以OD(A)为纵坐标,以葡萄糖标准溶液浓度(C,μg/mL)为横坐标,根据目标检测技术分析数据结果绘制一个标准曲线,进行线性关系模型回归。见图3。得出OD 值对于葡萄糖浓度的标准曲线方程为Y=0.009 2X-0.004 9(R2=0.999 9),由曲线可知,OD 值与葡萄糖浓度在5~50 μg/mL 的范围内呈良好的线性关系。

图3 标准曲线Fig 3 Standard curve
2.1.2 精密度实验 在481 nm 下,经6 次测定,平均OD 为0.151,相对标准偏差(relative standard deviation)为1.859%,平均加样回收率为16.945±0.287,表明此方法精密度预测性良好。见表2。

表2 红花多糖含量测定精密度实验结果Tab 2 Precision experimental results of determination of safflower polysaccharide content
2.1.3 重复性实验 遵循方法“1.2.2.3”,RSD 为2.257%,平均加样回收率为16.891±0.348,表明重复性良好。见表3。

表3 红花多糖含量测定重复性实验结果Tab 3 Repetitive experimental results of determination of safflower polysaccharide content
2.1.4 稳定性实验 按照“1.2.2.4”方法下操作,200 min 过后吸光度有下降趋势,多糖溶液在200 min 以内都是稳定存在。RSD 为2.393%,平均加样回收率为(16.809±0.369)%。见表4。

表4 红花多糖含量测定稳定性实验结果Tab 4 Stability test results of safflower polysaccharide content determination
2.1.5 加样回收率实验 按照“1.2.2.5”方法下操作,检测结果为平均加样回收率为(97.320±0.026)%,RSD 为2.949%。见表5。

表5 葡萄糖加样回收率测定结果实验结果Tab 5 Determination results of recovery rate of glucose sampling experimental results
2.1.6 多糖含量的测定 按照“1.2.2.6”项下对多糖进行含量测定,多糖平均含量为(98.304±0.009)%,RSD 为1.076%。见表6。

表6 红花多糖含量的测定Tab 6 Determination of polysaccharide content in safflower
2.2 单因素考察结果分析
2.2.1 考察料液比对提取率对影响 由图4 可知,不同料液比对于多糖的影响较大,当料液比大于1∶1 时,料液比对多糖含量影响显著,料液比超过1∶15 时提取率有所下降,可能原因是加水量过大,药物过于稀释,造成提取率降低,所以最佳料液比1∶15。

图4 料液比对多糖提取率的影响Fig 4 Effect of solid-liquid ratio on polysaccharide extraction rate
2.2.2 考察提取时间对提取率对影响 图5 显示,当提取时间约为90 min 时,提取率随着时间的推移而增加,超过90 min,提取率下降,因此90 min 为最佳方法提取工作时间。

图5 提取时间对多糖提取率的影响Fig 5 Effect of extraction time on extraction rate of polysaccharide
2.2.3 考察提取次数对多糖提取率对影响 图6 显示次数为2 时,多糖提取率最高,提取次数越多,多糖损失越大,因此最佳提取次数为2。

图6 提取次数对多糖提取率的影响Fig 6 Effect of extraction times on polysaccharide extraction rate
2.2.4 考察提取温度对提取率的影响 从图7 中可以看出,多糖的提取率随着温度的升高而升高,其中提取率最高时为90 ℃,是60 ℃的两倍之多,因此,选择90℃作为最佳提取温度。

图7 提取温度对多糖提取率的影响Fig 7 Effect of extraction temperature on extraction rate of polysaccharide
2.3 星点实验设计结果与分析
2.3.1 模型拟合 通过Design Expert 8.0 软件分别对各因素的各水平不断进行二次多项式方程模型拟合。根据该方程通过Design Expert 8.0 软件绘制出三维效应面和二维等高线,选取较优组 合 。 二 次 方 程 拟 合 :Y=6.81+0.4X1-0.0094X2+0.15X3+0.0015X1X2+0.0025X1X3-0.015X2X3-0.36X12-0.19X22-0.35X32,P<0.05,R2=0.942 3,说明回归方程关系显著,符合要求。方差结果分析见表8。结果分析,Y模型项P<0.000 1,证明所得回归方程的作用显著。在Y模型方程中,X1,X1X3,X12,X22,X32都是一个显著项,是Y的显著相关影响因素。因此3 个因素对提取率的影响为:X1>X3>X2,X1对提取率有显著影响。使用statistica 8.0 软件处理后得到二维等高线及三维效应面图,确定最优方案为:料液比1∶16.69,提取时间89.78 min,提取温度 91.39 ℃。 此时红花多糖的提取率为7.45%。

表7 星点设计实验安排结果Table 7 Experimental results of central composite designresponse surface methodology
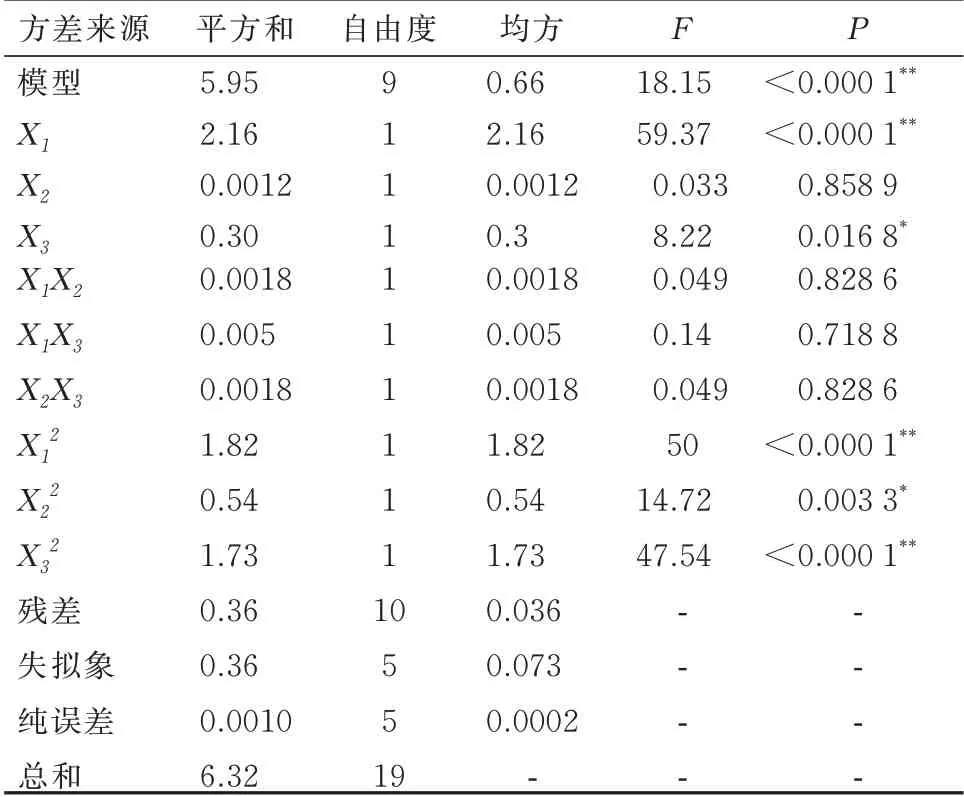
表8 方差结果分析Tab 8 Analysis of variance results
各因素间交互作用的三维效应曲面图和二维等高线如图8~10 所示。

图8 提取时间与料液比对红花多糖提取率的效应曲面及其等高线图Fig 8 Surface and contour map of effect of extraction time and solid-liquid ratio on extraction rate of safflower polysaccharide

图9 提取温度与料液比对红花多糖提取率的效应曲面及其等高线图Fig 9 Surface and contour map of effect of extraction temperature and solid-liquid ratio on extraction rate of safflower polysaccharide
图8~图10 的效应曲面图和等高线图反映了料液比(X1)、提取时间(X2)和提取温度(X3)的交互效应对红花多糖提取率的影响。其影响曲面显著程度由大到小依次为X1>X3>X2,此结果和方差分析的结论一致。

图10 提取温度与提取时间对红花多糖提取率的效应曲面及其等高线图Fig 10 Surface and contour map of effect of extraction temperature and extraction time on extraction rate of safflower polysaccharide
2.4 红花多糖提取工艺验证试验
平行称取红花多糖3 份,根据供试产品的制备方法,在最佳工艺条件下进行操作,测定红花多糖提取率,实验结果表明在最佳提取工艺条件下,红花多糖提取率高且稳定。见表9。

表9 验证试验结果Tab 9 Verification test results
3 讨论
常用的测定不同多糖进行含量的实验研究方法有苯酚-硫酸法、蒽酮-硫酸法、地衣酚-硫酸法等[14,15]。苯酚-硫酸法比其他通常用来确定多糖含量的方法更敏感、使用更方便、颜色更稳定[16]。紫外光度计法检测多糖的灵敏度较高,但稳定性不是很好,实验过程由于操作、吸收时间、显色过程中等错误因素导致实验数据误差,在某种程度上,它影响了实验结果[17]。
在本实验中,水提醇沉法提取得到的多糖破坏较小,得率较高[18]。通过单因素考察实验对各因素进行一定的考察,进一步缩小各因素取值范围。按照星点设计-效应面法挑选出最优的红花粗多糖提取工艺条件。与其他设计实验相比,星点设计-效应面法具有精确度高、可预测性好、实验少、可同时考察各种因素相互作用等优点,证明该方法具有一定的研究价值[19,20]。本研究得到的工艺优化条件,可为红花多糖的开发利用奠定一定的基础,使红花多糖在临床研究方面有一定的突破。
作者贡献度说明:
本文设计思路由杨婧教授提供;具体实验过程由王锐、李娅兰完成;数据分析与结果处理由白皓天完成。

